
- •© Уральская государственная медицинская академия, 2000 содержание
- •Список условных обозначений
- •In vitro - в пробирке
- •Введение
- •Выбор темы. Определение цели и задач курсовой работы
- •Составление рабочего плана
- •Выбор экспериментальной модели
- •Методы исследования
- •Подготовка реактивов, биопроб и работа с оборудованием
- •Проведение эксперимента
- •Статистическая обработка результатов эксперимента
- •Правила оформления курсовой работы
- •Список использованной литературы.
- •Список использованной литературы
- •Автореферат диссертации
- •Защита курсовой работы
- •Литература
- •Выполнение курсовой научной работы на кафедре биохимии (учебное пособие)
Составление рабочего плана
При составлении плана работы необходимо ориентировочно обозначить конкретные сроки начала и окончания каждого этапа работы:
Работа с литературой.
Формулировка темы, целей и задач.
Выбор и освоение методов исследования.
Производство эксперимента или клинических исследований.
Статистическая обработка результатов исследований.
Обсуждение результатов.
Формулировка выводов.
Оформление работы.
Защита работы [5,14 ].
План материального обеспечения составляется после определения объема и методов исследования. В нем должны быть отражены: необходимое количество животных, их возраст, вид и пол, реактивы, приборы и оборудование, химическая посуда, вычислительная техника. Все необходимое для работы предоставляется кафедрой (преподавателем и лаборантами). Целесообразно также согласовать с остальными курсантами и преподавателями время занятости приборов и оборудования. Все остальные принадлежности поступают в индивидуальное пользование курсанта. За сохранность оборудования , соблюдение техники безопасности и противопожарной безопасности он несет ответственность.
План оформляется в лабораторном журнале, который необходимо хранить в лаборатории на рабочем месте. Животные, отведенные курсанту для эксперимента, должны находиться в виварии в отдельной клетке и иметь маркировку с указанием ФИО курсанта, преподавателя, времени начала эксперимента и его окончания [5].
Перед началом эксперимента курсант должен ознакомиться с правилами поведения в лаборатории, техникой безопасности [2, 9] и расписаться об этом в соответствующем журнале.
Выбор экспериментальной модели
Модель – это искусственное воспроизведение заболевания на лабораторном животном. Модель должна отвечать следующим требованиям:
Максимально соответствовать типу патологии человека, так как только в этом случае полученные выводы могут быть в наибольшей степени перенесены на человека. Например, совершенно не допустимо моделирование заболевания желудка человека на жвачных животных, в связи с наличием у данных животных существенных особенностей анатомического строения и физиологического механизма пищеварения в этом органе.
Быть легко воспроизводима, то есть повторяться в стандартном виде (например, в каждый экспериментальный день).
Экспериментальное воздействие на объект, а также степень и продолжительность ответной реакции должны контролироваться по простым и доступным показателям. Например, при воспроизведении постгеморрагической анемии извлекается определенный объем крови с учетом массы тела животного, а степень анемизации фиксируется по числу эритроцитов, концентрации гемоглобина, цветовому показателю.
Иметь жесткий контроль. Это значит, что в эксперимент должны быть взяты параллельно или последовательно объекты, находившиеся в тех же условиях существования, за исключением одного фактора, с помощью воздействия которого и воспроизводится данная модель. Например, при воспроизведении постгеморрагической анемии путем кровопускания из сонной артерии контрольным животным производится в тех же условиях «ложная» операция с рассечением и ушиванием тканей, но без кровопускания.
Желательно изучить каждую модель на 2-3 видах животных. После получения результатов это значительно повысит их общебиологическую ценность.
Каждая модель должна исследоваться при многократном повторении, причем, чем менее устойчивые получаются результаты, тем большее число раз должен повториться опыт. Условно считают, что при идеальной воспроизводимости результатов опыт (как правило, in vitro) достаточно повторить три раза. При работе на беспородных животных экспериментатор повторяет один и тот же опыт 5-8 раз. Использование линейных животных позволяет уменьшить число повторов до 5-6 [5, 6, 8 ].
Следует отметить, что для многих видов патологии экспериментальные модели в общем виде разработаны, их описания можно найти в соответствующих монографических изданиях, авторефератах диссертаций и периодической литературе. В этом могут помочь периодические издания «Патологическая физиология и экспериментальная терапия», «Бюллетень экспериментальной биологии и медицины», «Фармакология и токсикология», «Проблемы гематологии и переливания крови», «Вопросы медицинской химии», «Биохимия», «Радиобиология», «Известия АН РФ», «Лабораторное дело» и «Клиническая лабораторная диагностика», реферативные журналы и др.
В условиях кафедры биохимии УГМА студенты работают с двумя видами животных: крысы и мыши.
При некоторых видах эксперимента могут иметь значения и такие обстоятельства как размер животного, что существенно, например, при изучении гипероксии, связанной с необходимостью помещать животное в барокамеру небольших размеров, а при изучении воздействия на гемопоэз – его особенности у разных видов животных.
Животные должны содержаться в стандартных условиях лабораторного вивария, получать пищевой рацион в соответствии с "Правилами проведения работ с использованием экспериментальных животных", утвержденными приказом МЗ СССР № 755 от 12.08. 1977 г. и приказом 1179 от 10.10.83, утвержденном МЗ СССР "Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения".
При работе с лабораторными животными следует соблюдать следующие основные правила обращения с ними:
Животные должны содержаться на установленном рационе, получать пищу 2 раза в сутки и иметь постоянный доступ к чистой питьевой воде. Крысы и мыши должны находится при температуре 20-25 градусов и относительной влажности 40-60 %, помещение должно периодически проветриваться или вентилироваться. Как правило, за 12 часов до забоя животных прекращают кормить, доступ к воде оставляют свободным.
Для переноски крыс и мышей берут за шкуру на задней верхней поверхности шеи или рукой за кончик хвоста. Не рекомендуется держать животных на весу более нескольких секунд.
При работе с животными не допустимы громкие звуки, резкие движения, яркий свет и воздействие других неблагоприятных побочных факторов, так как они их сильно возбуждают и могут исказить результаты эксперимента.
Фиксацию крыс производят с помощью специально приготовленных петель из мягких тканей.после дачи им легкого эфирного рауш-наркоза за передние и задние конечности. Все болезненные манипуляции на животных проводятся только под наркозом с помощью эфира или хлороформа, внутривенного введения гексенала или тиопентала натрия, также может быть использована местная анестезия 0,25 % раствором новокаина.
Забой экспериментальных животных допускается только с использованием наркоза (обезболивания).
Нежизнеспособные животные должны после окончания опыта усыпляться путем передозировки эфира или хлороформа. Трупы экспериментальных животных помещаются в специальный трупный ящик [29,30].
Перед началом опыта животное должно получить индивидуальную или групповую метку. Метка должна одновременно быть обозначена в лабораторном журнале, и, желательно, на клетке с животными. Чаще всего, метки наносятся крысам и мышам на спину, затылок и хвост с помощью какого-нибудь нейтрального нетоксичного красителя (краски Романовского, эозина), маркера или др. При этом следует учесть, что в течение нескольких дней эти метки под влиянием различных факторов (слизывание животными, механическое удаление, смывание и т.д.) тускнеют и становятся неразличимыми. Поэтому их периодически следует обновлять. Удобным способом является нанесение различного количества меток в виде колец на хвосте грызунов фломастерами или маркерами различных цветов.
Следует обратить также внимание на то, что поглощаемые животными красители могут быть небезразличны для изучаемых процессов и параметров.
Часто создание той или иной модели заболевания связано с химическим, физическим, биологическим или психическим воздействием на животное. При воздействии на лабораторных животных химическими веществами используют принятые в медицине пути их поступления. Энтеральный, когда химическое вещество примешивается в определенной пропорции к твердой пище или воде. При этом вещество не должно как отпугивать животных и вызывать у них потерю аппетита, так и не обострять его. Необходимо иметь точные данные о метаболизме данного вещества в организме, иначе в случае расщепления его желудочным соком, оно может не всосаться в ЖКТ. Данный способ введения является наиболее физиологическим, но недостаточно точным в отношении поступившей в организм дозы [22, 29].
Парентеральное введение веществ характеризуется возможностью использования точных дозировок, однако травматично для животного и обязательно должно иметь контроль в виде инъекций физраствора или того растворителя, на котором приготовлено используемое в опыте вещество. Внутримышечные инъекции делаются крысам и мышам в мышцы бедра. Внутривенные инъекции – в хвостовую вену. Для лучшего обозначения вен хвост энергично растирают рукой, подогревают водой с температурой до 50 градусов, пережимают проксимальные места инъекции. Внутрибрюшинные инъекции производятся в низ живота тупой иглой во избежание повреждения органов брюшной полости в положении животного вниз головой. Для производства внутриартериальных вливаний , как правило, используются бедренные и сонные артерии у животных после оперативного их обнажения. Подкожные и внутрикожные инъекции проводятся на коже туловища, спины [28, 29].
Могут быть использованы и другие пути введения: ингаляционный, внутрикостный, аппликационный (на хвост или предварительно выбритые участки тела), в спиномозговой канал, в портальную вену после ее оперативного обнажения, в определенные структуры головного мозга с использованием стереотаксической техники, в переднюю камеру глаза и т.д. Распространенным методом введения препаратов является способ интрагастрального введения с помощью зонда.
В эксперименте исследователи практически не ограничены теми методами введения в организм препаратов, которые существуют в клинике. Могут быть использованы собственные способы, основанные на вживлении канюль, оперативные доступы к любому сосуду или органу, введение лекарственных веществ в виде липосом при посредстве фистул ЖКТ[ 22,29 ].
Например, наиболее часто для моделирования тех или иных состояний в системе гемопоэза используются следующие воздействия: а) для активации эритропоэза применяется нитрат кобальта в дозировке 3 мг на 1 кг веса животных в расчете на атомарный кобальт при внутримышечном или внутрибрюшинном его введении 1 раз в сутки в течение 5-6 дней. б) для активации лейкопоэза у животных применяют модель асептического подкожного воспаления после ежедневных (в течение 3 суток) подкожных инъекций смеси очищенного скипидара с подсолнечным маслом в соотношении 1:1 в количестве 1 мл на 1 кг веса, стимуляцию иммунных реакций вызывают препаратом Т-активином или нуклеинатом натрия. в) для ингибирования лейкопоэза (гранулоцитопоэза) используется введение смеси бензола с подсолнечным маслом в соотношении 1:1 в количестве 1 мл на 1 кг веса однократно на протяжении 3 дней [ 18,21,35].
Среди методов физического воздействия на организм, сопровождающихся выраженными изменениями гемопоэза, следует отметить нормобарическую гипоксическую гипоксию ( рис. 1 ), гипероксию, воздействие ионизирующего излучения. Гипоксия вызывает стойкую достоверную активацию эритропоэза, гипероксия – его ингибирование, ионизирующее излучение в средних и высоких дозах сопровождается ингибированием гемопоэза [3,21,22].
С помощью трансфузиологических методов также можно стойко изменить активность определенных ростков кроветворной ткани: кровопускание из сонной артерии в объеме 2 % от массы тела обеспечивает активацию эритропоэза, а переливанием эритромассы, лейкомассы и тромбоцитарной массы можно достичь ингибирования соответственно эритропоэза, лейкопоэза и тромбоцитопоэза[ 21,21].
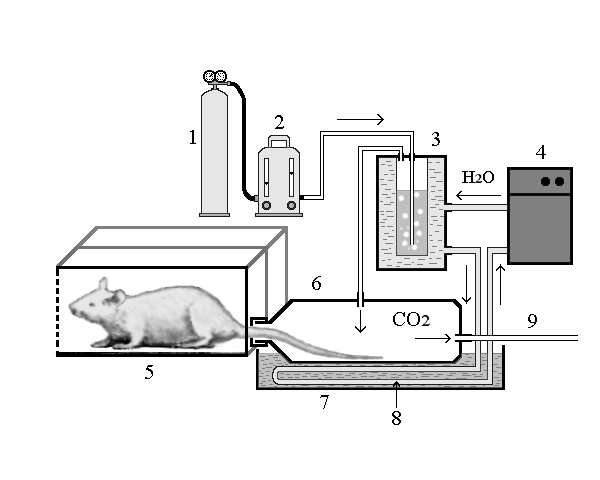
Для исследования резорбтивного воздействия углекислым газом на животных асп. Гавриловым И.В. была собранна оригинальная установка (рис.2 ), состоящая из специальной клетки для животных, транспорт газового баллона с га СО2, понижающего давление редуктора с манометром высокого и низкого давления (ДКП - 1 - 65), наркозного аппарата с эжекционной ротаметрической системой типа АН-8 (ТУ 64-1-3454-80) для ингаляционного наркоза в качестве газового счетчика, а также системы подачи, увлажнения, подогрева рабочей газовой смеси и выброса отработанной смеси газов (рис.2)
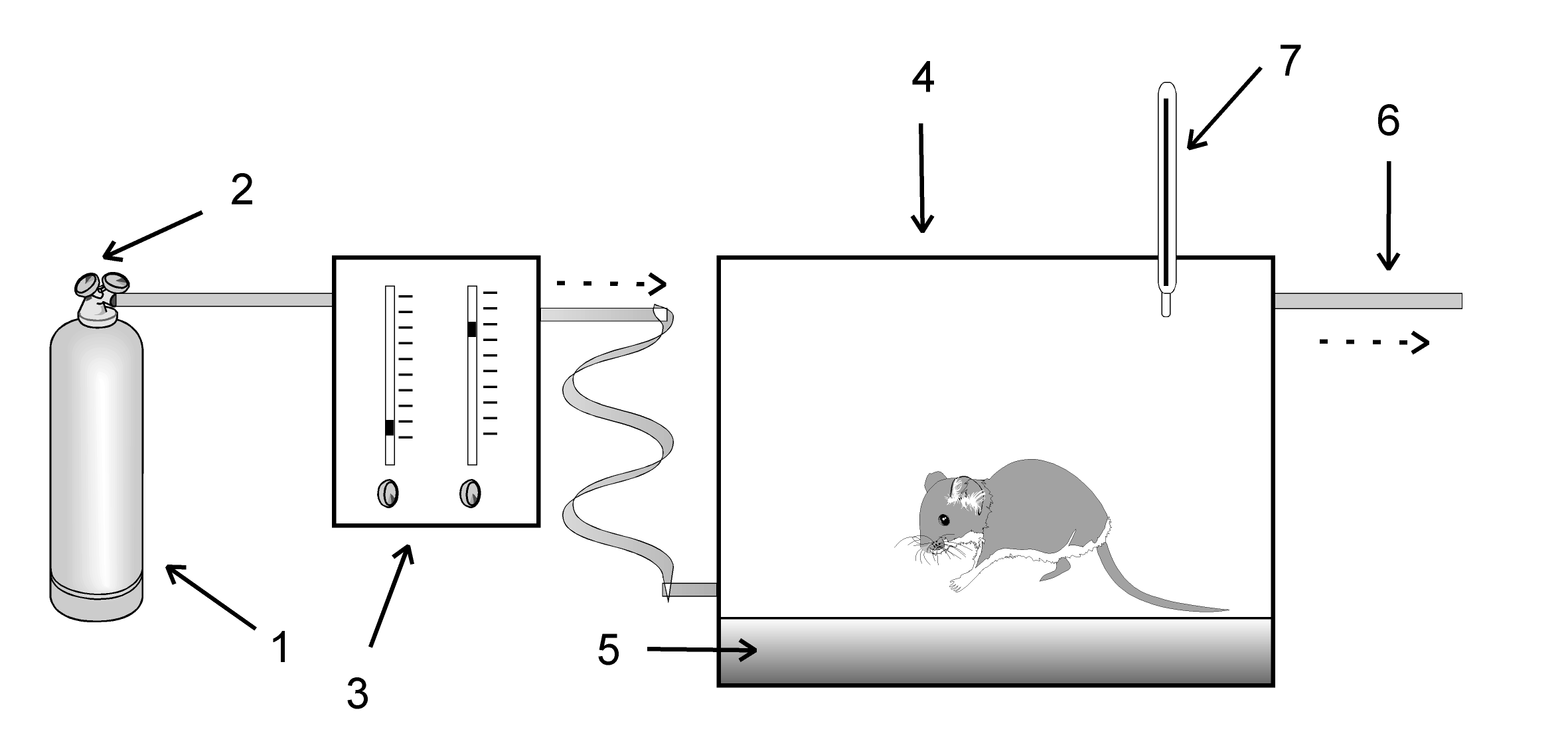
1- баллон с азотом |
5 – поглотитель углекислоты |
2-редуктор |
6-выход газов во внешнюю среду |
3-аппарат (наркозный) для смеши- вания газов |
7-термометр ----Направление потока смеси |
4-камера для животных |
газов газов |
Рис. 1 Схема установки для воздействия на животных нормобарической гипоксии ( Мещанинов В.Н.,1999).
В клетку (5) помещалось одновременно 8 крыс (4 зрелых и 4 старых), разделенных между собой перегородками. На хвосты животных, выведенных наружу через отверстия в дверцах клетки, были надеты пластиковые емкости по 0,5 литра с мягкими резиновыми муфтами (6), в дно которых были впаяны пластиковые трубки для входа и выхода смеси газов. В крышках этих емкостей имелись отверстия для хвостов крыс. Из 8 крыс, находившихся в клетке, 4 получали воздействие углекислым газом. 4 крысы являлись контролем, им создавались те же условия температуры, влажности, ограниченного пространства, и т.д. без воздействия углекислым газом.
Углекислый газ из газового баллона (1), пройдя через редуктор, наркозный аппарат (2) поступал в камеру (3), где продуванием через горячую воду (t = 50 С0) нагревался и увлажнялся. Затем по распределительной системе готовая газовая смесь (100% углекислый газ с относительной влажностью 100% при 40 С0) поступала в пластиковые емкости (6), в которых находились хвосты крыс. Для поддержания стабильной температуры все пластиковые бутылки с хвостами крыс были помещены в поддон с теплой водой (7) (t = 40 С0), температура которой поддерживалась посредством собранной из стеклянных трубок батареи (8), по которой принудительно из термостата циркулировала горячая вода. У контрольных животных хвосты были помещены в подогреваемые пластиковые баллоны с обыкновенным увлажненным до 100%, воздухом. Пройдя через пластиковые емкости, отработанная смесь газов собиралась общий коллектор (9) и выводилась во внешнюю среду [3].
1 |
6. пластиковая емкость |
2. аппарат для смешивания газов |
7. поддон с теплой водой |
3. камера нагрева и увлажнения СО2 |
8. батарея из стеклянных трубок |
4. водяной термостат 5. клетка с животными |
9. коллектор для выведения отработанных газов |
Рис.2 Установка для воздействия на животных СУВ ( Гаврилов И.В., 2000) |
|
Формирование опытной (с воздействием) и контрольной групп (без воздействия) должно вестись с учетом их падежа во время воздействия, особенно если воздействие имеет хронический характер. Из этих соображений целесообразно расчетное количество животных увеличить на 15-20 %. Например, вместо 6 «опытных» и 6 контрольных животных следует взять в эксперимент не менее 8 «опытных» и 8 контрольных животных.

 .
газовый баллон с азотом
.
газовый баллон с азотом