
- •Лабораторний практикум з фізики
- •Лабораторна робота № 6
- •Теоретичні відомості
- •Хід роботи.
- •Контрольні запитання.
- •Лабораторна робота № 7
- •Теоретичні відомості.
- •Хід роботи.
- •Контрольні запитання.
- •Лабораторна робота № 8
- •Теоретичні відомості.
- •Хід роботи.
- •Дослід 2.
- •Контрольні запитання.
- •Лабораторна робота № 9
- •Теоретичні відомості
- •Хід роботи.
- •Контрольні запитання
- •Лабораторна робота № 11.
- •Теоретичні відомості.
- •Хід роботи.
- •Контрольні питання
Лабораторна робота № 11.
Тема: Визначення заряду електрона за допомогою електролізу.
Мета: експериментально визначити заряд електрона, використовуючи закон Фарадея для електролізу.
Обладнання: електролітична ванна з водним розчином сульфату міді (CuSO4), мідні електроди, джерело постійного струму, секундомір, амперметр, терези з гирями, реостат, наждачний папір, фільтрувальний папір, ключ, електроплитка, вимикач, з'єднувальні провідники.
Теоретичні відомості.
Електроліти - це розчини та розплави солей, кислот і лугів. Під час розчину у воді нейтральні молекули розчиненої речовини внаслідок теплових співударів розпадаються на позитивні й негативні іони, а сам процес розпаду називають електролітичною дисоціацією. Одночасно з дисоціацією внаслідок співударів стають можливими зворотні процеси возз'єднання різнойменних іонів у нейтральні молекули. Цей процес називають рекомбінацією. У такому стані електроліту встановлюється рухома (динамічна) рівновага, при якій число іонів, які утворюються внаслідок дисоціації, дорівнює числу іонів, які рекомбінують за той самий час. Коли зовнішнє електричне поле відсутнє, іони в електроліті здійснюють хаотичний тепловий рух.
 Якщо
в електроліт помістити два електроди
з різницею потенціалів (мал.1), то позитивно
заряджені іони переміщуватимуться у
напрямі електричного поля до катода
(негативний електрод), а негативно
заряджені іони - у протилежному напрямі
до анода (позитивний електрод).
Якщо
в електроліт помістити два електроди
з різницею потенціалів (мал.1), то позитивно
заряджені іони переміщуватимуться у
напрямі електричного поля до катода
(негативний електрод), а негативно
заряджені іони - у протилежному напрямі
до анода (позитивний електрод).
На хаотичний тепловий рух накладається напрямлене зміщення іонів, тобто виникає
електричний струм. Отже, електропровідність електролітів є іонною і струм
в електролітах - це напрямлений рух позитивних і негативних іонів. Під час
проходження електричного струму на електродах виділяються речовини, які входять до
складу електролітів. Процес виділення речовини на електродах під час
проходження електричного струму через електроліт називається електролізом.
У 1833 році Фарадей встановив закон електролізу, який визначає масу речовини, що
виділилася на електроді:
![]() (1)
(1)
де М - молярна маса речовини; Z - її валентність; NA = 6,02 • 1023 моль -1 - стала Авогадро; e - заряд електрона; I - сила струму, що проходить крізь розчин; t - час проходження струму. Використовуючи співвідношення (1), можна визначити заряд електрона:
![]() (2)
(2)
Для визначення маси речовини, що виділиться на катоді, його зважують до і після досліду (т1 і т2), тому маса речовини т = т2 – т1. Отже, формула для визначення заряду електрона буде мати вигляд:
![]() (3)
(3)
Хід роботи.
1. Зробіть у верхній частині катода позначку, щоб надалі
не переплутати його з анодом. Будьте уважні: катод повинен
підключатися до негативного полюсу джерела струму!
2. Для отримання маси катода т1 до досліду, зважте його.
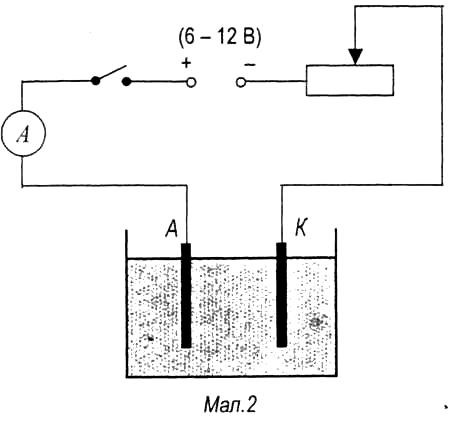
3. Закріпіть електроди в тримачі і, не занурюючи їх у ванну з
розчином CuSO4, складіть електричне коло (мал.2).
4. Опустіть електроди у ванну з розчином. Замкнувши
вимикач, встановіть за допомогою реостата силу струму не
більше 1 А і підтримуйте її постійною (за допомогою реостата)
до кінця досліду (протягом 15-20 хв).
5. Розімкніть вимикач, вийміть катод, обережно промийте
його водою, просушіть спочатку фільтрувальним папером, а
потім над електроплиткою.
6. Для отримання маси катода т2 після досліду, зважте його.
7. Визначте масу речовини, що виділилась на катоді:
m = m2 - m1
8. За формулою (3) обчисліть заряд електрона.
9. Результати вимірювань та обчислень запишіть у таблицю:
m1, кг |
m2, кг |
m, кг |
NА, моль-1 |
Z |
I, А |
t, c |
M, кг/моль |
е, Кл |
|
|
|
|
|
|
|
|
|
10. Визначте похибки вимірювань сили струму ∆I, часу ∆t і маси ∆m. Обчисліть відносну й абсолютну похибки вимірювання значення заряду електрона:
![]()
11. Запишіть результат визначення заряду електрона у вигляді: e = еобч ± ∆e.
12.
Порівняйте обчислене значення заряду
електрона еобч
з
табличним етабл
=
1,6
![]() 10
-19
Кл.
Обчисліть відносне відхилення (у %)
обчисленого значення заряду електрона
від табличного:
10
-19
Кл.
Обчисліть відносне відхилення (у %)
обчисленого значення заряду електрона
від табличного:
![]()
13. Зробіть висновок.
