- •Вопрос 1 Охарактеризуйте состояние электрона в атоме набором кван. Чисел…
- •Вопрос 2 На каком признаке основано подразделение на…
- •Вопрос 3 Сформулируйте пз Менделеева…
- •Вопрос 4 Сформулируйте основы теории вс…
- •Вопрос 5 Сформулируйте положения теории вс…
- •Вопрос 6 Рассмотрите особенности ковалентной связи…
- •Вопрос 7 (смотри вопрос 6) Ковалентная связь…
- •Вопрос 13 Кристаллы
- •Вопрос 23 Сформулируйте принцип Ле Шателье…
- •Вопрос 24 Как можно кол-но охарактеризовать глубину протекания обратим…
- •Вопрос 25 Что характеризует константа равновесия…
- •Вопрос 26 Дайте определение скорости хим. Реакции…
- •Вопрос 27 Явление катализа…
- •Вопрос 28 в чем сущность катализа…
- •Вопрос 29 в чем сущность явления гидролиза соединений….
- •Вопрос 30 Сравните гидролиз соединений…
- •Вопрос 31 Обсудите гидролиз…
- •Вопрос 32 Как количественно обсудить окислительные и восстановительные…
- •Вопрос 37 Расскажите о строении… водорода…
- •Вопрос 38 Рассмотрите строение молекулы воды…
- •Вопрос 39 Какова устойчивая степень окисления галогенов…
- •Вопрос 40 Охарактеризуйте фтор….
- •Вопрос 41 Пользуясь теорией валентных связей, охарактеризуйте…галогенов…
- •Вопрос 42 Расскажите о фторидах элементов 3 периода.
- •Вопрос 43 Рассмотрите физ. И хим. Свойства галогенов…
- •Вопрос 44 Рассмотрите строение молекул галогенов…
- •Вопрос 45 определите энтальпию реакции получения хлорида водорода…
- •Вопрос 46 Сопоставьте состав…хлоридов элементов 3 периода…
- •Вопрос 53 Приведите формулы известных вам оксохлоратов…
- •Вопрос 54 приведены е полуреакции…будет ли протекать реакция?
- •Вопрос 55 Приведите реакции получения хлора и брома…
Вопрос 7 (смотри вопрос 6) Ковалентная связь…
Все полярные молекулы обладают электрическим моментом диполя, который зависит от степени полярности химической связи. Т. е. чем более полярная ковалентная связь в молекуле, тем большим электрическим моментом обладает молекула. Полярность связи зависит от ОЭО, следовательно, чем больше разность ОЭО между хим. элементами, тем более полярна связь и больше электрический момент диполя.
Рассмотрим BCl3 , NCl3 и BrCl3. Так как Br наиболее электроотрицателен, то связь Br-Cl более полярна, а следовательно, электрический момент диполя у него больше. Поскольку молекула BCl3симметрична, то ЭМД обладать не будет
Вопрос 8 Как теория ВС объясняет хим. связь…
Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных орбиталей и между атомами появляется область с повышенной электронной плотностью, обусловливающая связь между ядрами атомов.
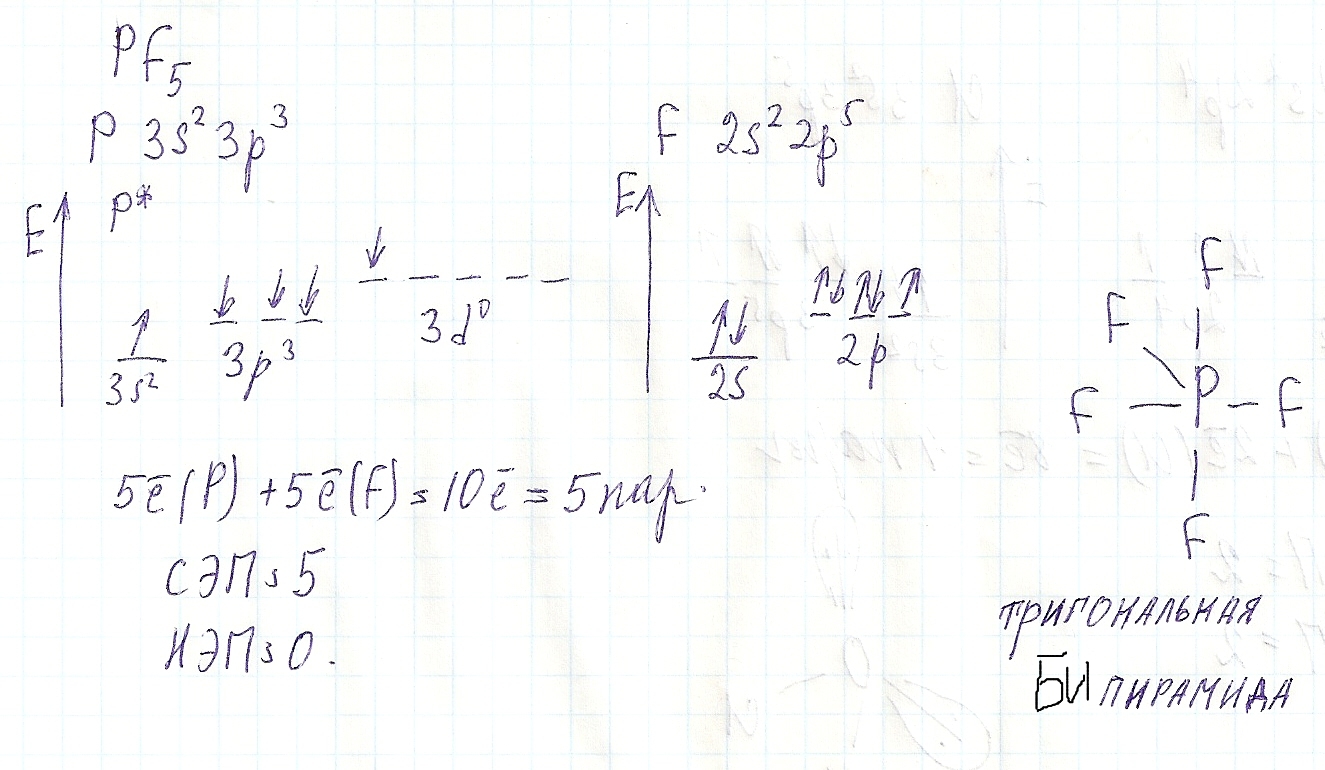
NF3аналогично NCl3
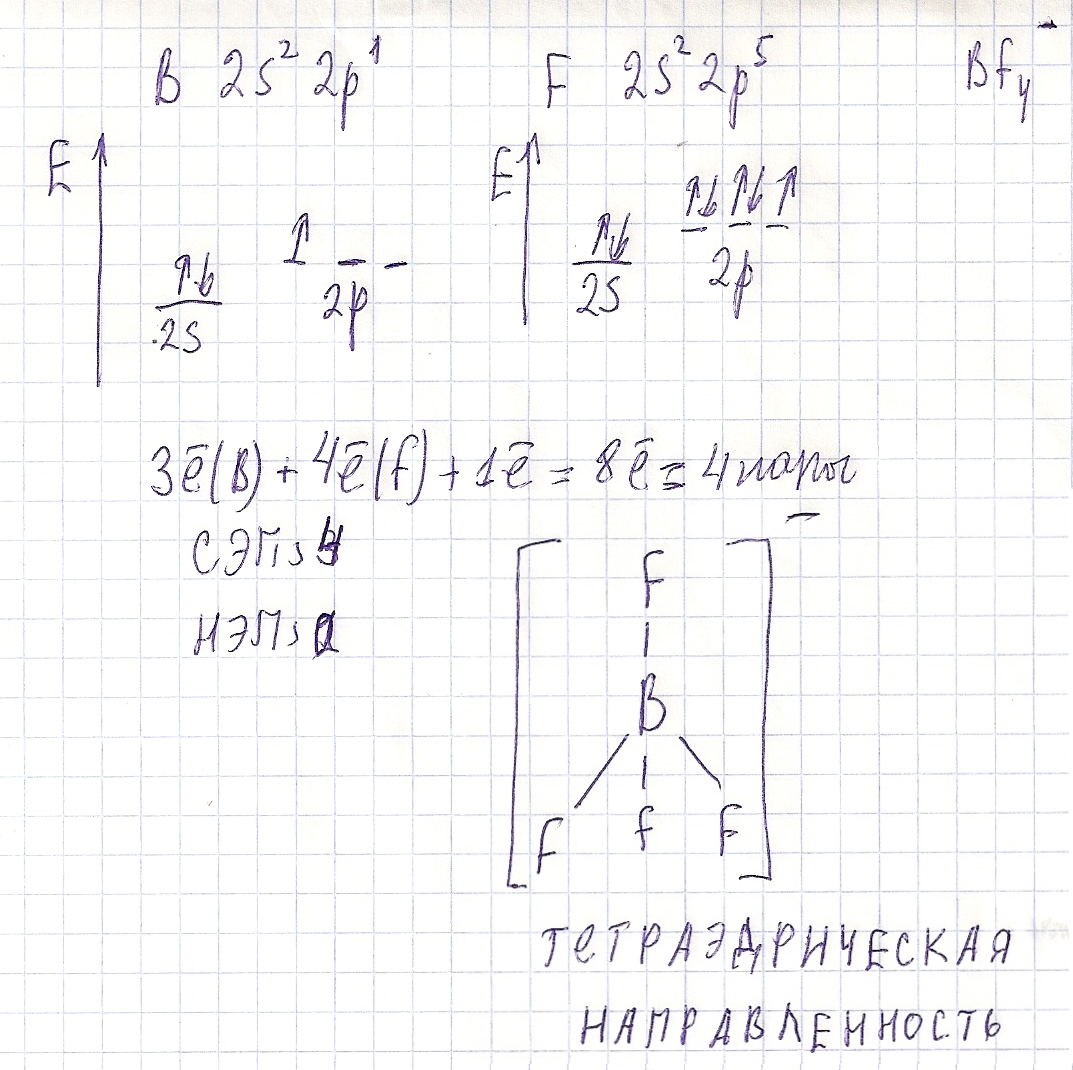
Вопрос 9 На примере молекул СО2…
Так как молекула CO2 имеет линейную направленность и симметрична, то векторная сумма моментов диполей будет равна нулю.
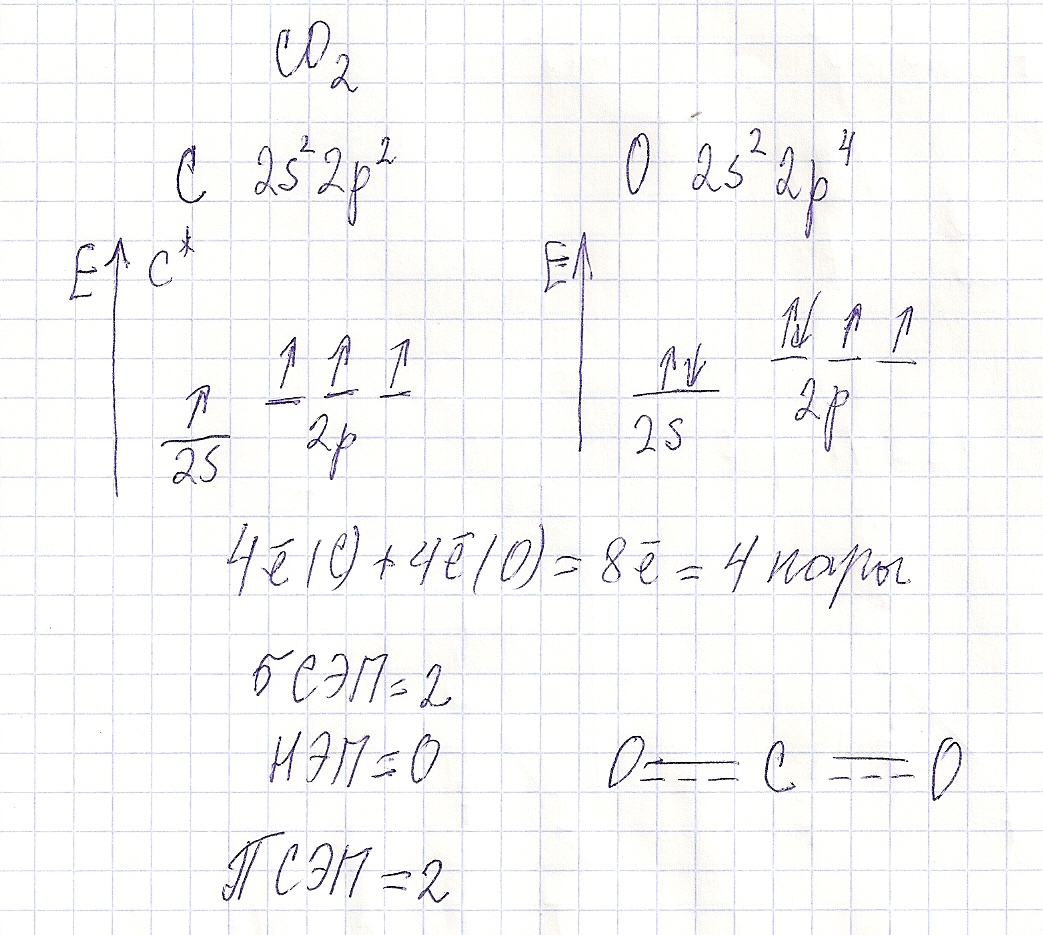
Так как молекула SO2имеет несимметричное строение, то она полярная, значит, электрический момент диполя вычисляется как векторная сумма моментов диполей отдельных связей.

Образование химической связи идет по обменному механизму.
Вопрос 10 Почему образуется хим. связь….
Химическая связь осуществляется за счет электростатического взаимодействия положительно заряженных ядер и отрицательно заряженных электронов. Химическая связь образуется только в том случае, если при сближении атомов полная энергия системы понижается.

Вопрос 11 Постройте энергетическую диаграмму…

димагнетная молекула
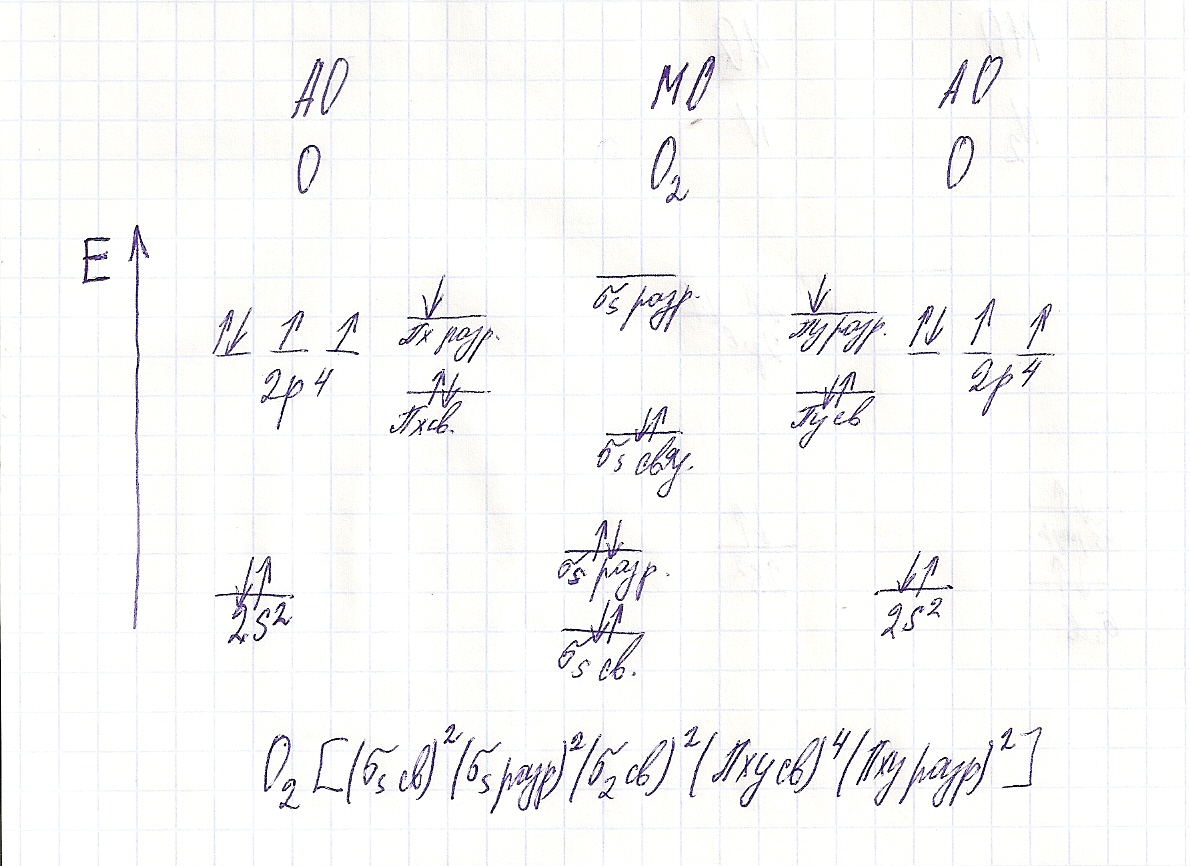
парамагнитная молекула
При переходе от атома к молекуле кислорода энергия ионизации уменьшается, потому что электроны в атоме связаны с ядрами слабее, чем в молекуле.
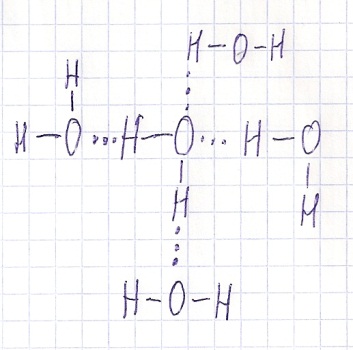
Вопрос 12 На конкретном примере рассмотрите водородную связь…
Образование водородной связи обусловлено спецификой водорода как элемента, атом которого состоит из протона и электрона. В соединениях водорода с атомами более электроотрицательных элементов на атоме водорода возникает частичный положительный заряд. Такой атом может взаимодействовать с неподеленными парами электронов атома более электроотрицательного элемента, соседней молекулы, в результате между молекулами возникает дополнительная межмолекулярная водородная связь.
Водородная связь — это связь, которая образуется, между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом, сильно электроотрицательного элемента, другой молекулы.
Чем больше электроотрицательность атома, с которым соединяется атом водорода, тем больше энергия водородной связи.
Рассмотрим образование водородной связи между молекулами воды. В молекуле воды связь O-H сильно полярна. На атоме кислорода сосредоточен отрицательный заряд, а на атоме водорода положительный. Это приводит к притяжению атома водорода одной молекулы к атому кислорода другой молекулы.
В кристаллах льда и снега молекула воды связана с соседними за счет двух атомов водорода и двух неподеленных электронных пар атома кислорода, т. е. образование водородной связи обусловлено как электростатическим так и донорно-акцепторным взаимодействием.
Для молекул, содержащих атомы водорода, возможны межмолекулярные водородные связи, если второй атом – атом фтора, кислорода или азота. В приведенном примере между молекулами Н2О образуются водородные связи, поэтому вода имеет аномально высокие температуры плавления и кипения по сравнению с однотипными соединениями H2S, H2Se и H2Te. Для молекул H2S и H2Se наиболее вероятно ориентационное взаимодействие, для H2Te – дисперсионное.
Температура плавления в ряду уменьшается.