
- •Вопрос 1 Охарактеризуйте состояние электрона в атоме набором кван. Чисел…
- •Вопрос 2 На каком признаке основано подразделение на…
- •Вопрос 3 Сформулируйте пз Менделеева…
- •Вопрос 4 Сформулируйте основы теории вс…
- •Вопрос 5 Сформулируйте положения теории вс…
- •Вопрос 6 Рассмотрите особенности ковалентной связи…
- •Вопрос 7 (смотри вопрос 6) Ковалентная связь…
- •Вопрос 13 Кристаллы
- •Вопрос 23 Сформулируйте принцип Ле Шателье…
- •Вопрос 24 Как можно кол-но охарактеризовать глубину протекания обратим…
- •Вопрос 25 Что характеризует константа равновесия…
- •Вопрос 26 Дайте определение скорости хим. Реакции…
- •Вопрос 27 Явление катализа…
- •Вопрос 28 в чем сущность катализа…
- •Вопрос 29 в чем сущность явления гидролиза соединений….
- •Вопрос 30 Сравните гидролиз соединений…
- •Вопрос 31 Обсудите гидролиз…
- •Вопрос 32 Как количественно обсудить окислительные и восстановительные…
- •Вопрос 37 Расскажите о строении… водорода…
- •Вопрос 38 Рассмотрите строение молекулы воды…
- •Вопрос 39 Какова устойчивая степень окисления галогенов…
- •Вопрос 40 Охарактеризуйте фтор….
- •Вопрос 41 Пользуясь теорией валентных связей, охарактеризуйте…галогенов…
- •Вопрос 42 Расскажите о фторидах элементов 3 периода.
- •Вопрос 43 Рассмотрите физ. И хим. Свойства галогенов…
- •Вопрос 44 Рассмотрите строение молекул галогенов…
- •Вопрос 45 определите энтальпию реакции получения хлорида водорода…
- •Вопрос 46 Сопоставьте состав…хлоридов элементов 3 периода…
- •Вопрос 53 Приведите формулы известных вам оксохлоратов…
- •Вопрос 54 приведены е полуреакции…будет ли протекать реакция?
- •Вопрос 55 Приведите реакции получения хлора и брома…
Вопрос 1 Охарактеризуйте состояние электрона в атоме набором кван. Чисел…
Главное квантовое число n – характеризует общий запас энергии электрона, энергетический уровень, размер электронного облака. Оно принимает целочисленные значения от 1 до бесконечности, но на практике от 1 до 7.
N=1 E= -13.6 – основной энергетический уровень
N=2
N=3 … возбужденное квантовое состояние
Орбитальное(побочное) квантовое число L – характеризует энергетическое состояние электрона на подуровне и форму орбитали. Принимает целочисленные значения от 1 до (n-1)
S - шар
P - гантели
D - четырехлистник
F – 3 гантели
Магнитное квантовое число m – характеризует ориентацию орбитали в пространстве. Оно связано с побочным квантовым числом и принимает целочисленные значения от +L до –L (2L+1)
Спиновое квантовое числоs – характеризует собственное вращение электрона вокруг своей оси. Может принимать значение +1/2 и -1/2.
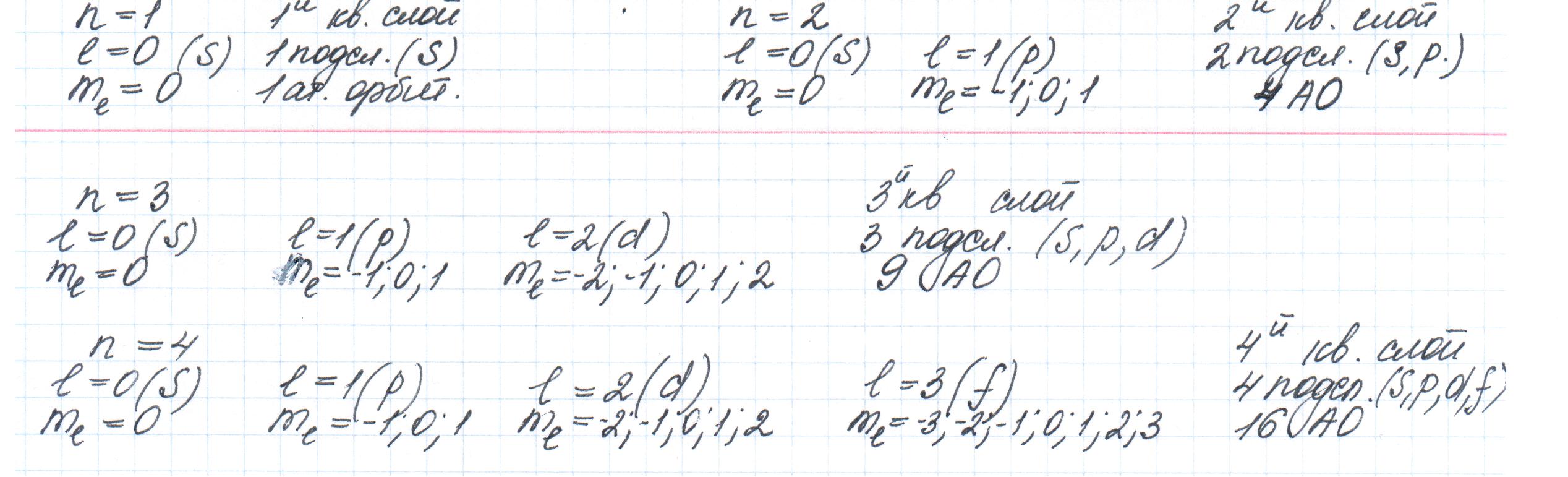
2s электроны-2шт
2p электроны-6шт
3dэлектроны- 10шт
5f электроны-14шт
Вопрос 2 На каком признаке основано подразделение на…
В основе построения таблицы, - заполнение электронами энергетических уровней и подуровней атомов элементов по принципу минимальной энергии, который отражен правилами Клечковского. В связи с этим, первые два элемента всех периодов, это s-элементы, у которых заполняется s-подуровень внешнего энергетического уровня. У р-элементов заполняется тоже внешний уровень, но р-подуровень, это последние 6 элементов всех периодов, начиная со второго. У d-элементов заполняется d-подуровень предпоследнего уровня,- это 10 элементов, которые расположены в таблице между s- и р- элементами в больших периодах. f-элементы – это элементы, у которых заполняется f-подуровень третьего снаружи уровня.
По положению элемента в ПСХЭ можно определить его электронную конфигурацию.
Например: Азот(N). Он расположен во 2-м периоде в 5-й группе главной подгруппы. На внешнем энергетическом уровне содержит 5 валентных электронов. Поскольку он находится во втором периоде, то он имеет 2 s-электрона, следовательно, общее количество электронов равно 7 (заряд ядра).
Электронная конфигурация: N+7 1s22s22p3 – p-элемент.
Хром(Cr) –расположен в 4-м периоде в 6 группе в побочной подгруппе. На внешнем энергетическом уровне содержит 6 валентных электронов. Заряд ядра 24.
Cr +24 1s22s22p63s23p64s13d5
При составлении электронных формул атомов следует учитывать провал электрона, который объясняется повышенной устойчивостью полностью или наполовину заполненных подуровней. Так, в атомах, электронная конфигурация которых близка к устойчивой, электрон с внешнего уровня проскакивает на предвнешний. В атоме хрома один 4s электрон переходит на 3d подуровень, тем самым наполовину заполняя внешний и предвнешний подуровни.
Вопрос 3 Сформулируйте пз Менделеева…
Периодический закон – свойства простых элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атома. Он является главной характеристикой атома. Заряд ядра определяет число электронов в атоме, строение энергетических уровней, свойства элемента и его положение в ПСХЭ.
В периодах с увеличением заряда ядра атома происходит увеличение числа электронов и уменьшение радиуса атома, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, притяжение этих электронов (закон Кулона); поэтому прочность связи электронов внешнего уровня с ядром увеличивается, в группах радиус атома увеличивается. Энергия ионизации (количество энергии необходимое для удаления электрона от нейтрального атома) в периодах, слева на право, увеличивается, а в группах, с увеличением заряда ядра, уменьшается. Электроотрицательность в периодах в увеличением заряда ядра увеличивается, в группах (сверху вниз) уменьшается.
