
- •1 Кинематика материальной точки. Тело отсчета. Прямолинейное движение. Движение тела в пространстве. Декартова система координат. Система отсчета.
- •2 Радиус-вектор, скорость и ускорение материальной точки, их связь с декартовыми координатами.
- •3 Движение по криволинейной траектории. Тангенциальное и нормальное ускорения.
- •4 Кинематика твердого тела. Поступательное движение твердого тела. Вращение тела вокруг неподвижной оси. Угловая скорость вращения. Вектор угловой скорости. Угловое ускорение.
- •5 Первый закон Ньютона – закон инерции. Инерциальная система отсчета.
- •7 Третий закон Ньютона. Формулирование задачи движения материальных точек. Начальные условия.
- •10 Неинерциальные системы отсчета. Силы инерции.
- •11 Замкнутая система. Законы сохранения. Связь законов сохранения со свойствами пространства и времени.
- •12 Закон сохранения импульса
- •13 Момент силы и момент импульса относительно неподвижного начала. Их связь.
- •14 Закон сохранения момента импульса
- •15 Работа и кинетическая энергия
- •16 Консервативные и неконсервативные силы. Потенциальная энергия. Примеры потенциальной энергии.
- •17 Закон сохранения и изменения механической энергии
- •18 Абсолютно неупругий и абсолютно упругий удары.
- •19 Механика абсолютно твердого тела. Вращение вокруг неподвижной оси. Момент инерции.
- •20 Теорема Гюйгенса-Штейнера. Вычисление моментов инерции. Примеры.
- •21 Колебания. Разные типы колебаний.
- •22 Гармонические колебания. Основные характеристики колебательного процесса. Дифференциальное уравнение гармонических колебаний.
- •23 Пружинный маятник. Энергия маятника.
- •24 Физический маятник.
- •25 Затухающие колебания. Дифференциальное уравнение, вид решения, график,
- •26 Вынужденные колебания. Резонанс.
- •27 Волновые процессы. Уравнение плоской волны. Дифференциальное уравнение плоской волны.
- •28 Макроскопическая система большого количества молекул. Ее параметры. Равновесная система.
- •29 Массы и размеры молекул. Атомная масса. Молярная масса.
- •30 Уравнение идеального газа.
- •31 Распределение молекул по скоростям в идеальном газе.
- •32 Газ во внешнем потенциальном поле. Распределение Больцмана. Барометрическая формула.
- •33 Степени свободы. Теорема о равнораспределении энергии по степеням свободы.
- •34 Теплопередача. Макроскопическая работа. Первый закон (начало) термодинамики. Применение к изопроцессам.
- •35 Явления переноса. Средняя длина свободного пробега.
- •36 Диффузия.
- •37 Теплопроводность.
- •38 Взаимодействие зарядов. Их знаки. Единичный заряд. Закон Кулона.
- •39 Напряженность электростатического поля. Определение. Напряженность точечного заряда. Силовые линии.
- •41 Электрический диполь. Дипольный момент. Напряженность диполя на больших расстояниях.
- •41 Поток вектора и теорема Гаусса.
- •42,43 Потенциал электростатического поля. Потенциал точечного заряда. Консервативность электростатического поля
- •44 Проводники в электрическом поле.
- •45 Поляризация диэлектриков. Поляризуемость. Вектор электрического смещения. Электрическая проницаемость.
- •46 Электрический ток. Вектор плотности тока. Закон сохранения заряда в интегральном и дифференциальном виде.
- •47 Закон Ома в дифференциальном и интегральном виде. Удельная проводимость и удельное сопротивление.
- •48 Действие магнитного поля на проводники с током и движущиеся заряды.
- •49 Магнитное поле равномерно движущегося заряда. Закон Био—Савара.
- •50 Магнитное поле бесконечного прямого провода и витка с током.
- •51 Теорема Гаусса для магнитного поля. Циркуляция магнитного поля.
- •52 Магнитное поле в веществе. Различные типы магнетиков.
- •53 Емкость проводников и конденсаторов. Емкость шарового конденсатора.
- •54 Энергия заряженного конденсатора. Плотность электрической энергии. Энергия системы заряженных тел.
- •55 Электромагнитная индукция
- •56 Магнитный поток
- •57 Работа при перемещении витка с током в постоянном магнитном поле.
- •58 Самоиндукция. Коэффициенты индуктивности.
- •59 Энергия магнитного поля.
- •60 Ток смещения.
- •61 Система уравнений Максвелла.
- •62 Следствия из уравнений Максвелла.
- •63 Электромагнитные волны.
32 Газ во внешнем потенциальном поле. Распределение Больцмана. Барометрическая формула.
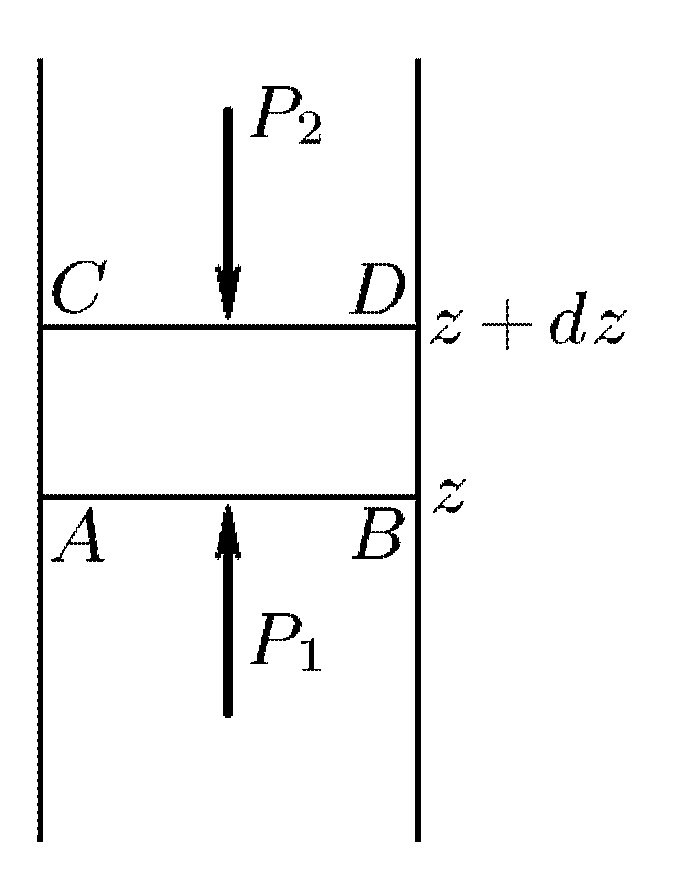
В
отсутствие внешних сил концентрация
молекул газа
![]() в
состоянии равновесия всюду одинакова.
Но при наличии силовых полей это не так.
Рассмотрим идеальный газ в однородном
поле тяжести. В состоянии теплового
равновесия температура
должна
быть одинаковой по всей толщине газа.
Найдем распределение концентрации по
высоте. Направим ось
вверх.
Выделим бесконечно короткий столб газа
в
состоянии равновесия всюду одинакова.
Но при наличии силовых полей это не так.
Рассмотрим идеальный газ в однородном
поле тяжести. В состоянии теплового
равновесия температура
должна
быть одинаковой по всей толщине газа.
Найдем распределение концентрации по
высоте. Направим ось
вверх.
Выделим бесконечно короткий столб газа
![]() (см.
рис.) с высотой
(см.
рис.) с высотой
![]() .
Пусть площадь основания столба равна
единице. Вес столба
.
Пусть площадь основания столба равна
единице. Вес столба
![]() должен
уравновешиваться разностью давлений
должен
уравновешиваться разностью давлений
![]() .
.
Это приводит к соотношению
![]() .
.
Подставляя
сюда
![]() и
принимая во внимание, что температура
одинакова
на всех высотах, получим
и
принимая во внимание, что температура
одинакова
на всех высотах, получим
![]() ,
или
,
или
![]() .
.
Аналогично можно получить формулу для любого неоднородного поля. В результате получится формула
![]() ,
,
где
![]() —
потенциальная энергия молекулы.
Интегрируя, получаем
—
потенциальная энергия молекулы.
Интегрируя, получаем
 .
.
Это
соотношение называется распределением
Больцмана. Постоянная
![]() —
концентрация при
—
концентрация при
![]() .
.
Применительно к однородному полю тяжести, если от концентрации перейти к давлению , эта формула преобразуется в
![]() .
.
Это — барометрическая формула.
Распределение энергии по степеням свободы. Теорема о равнораспределении энергии по степеням свободы. Внутренняя энергия идеального газа. Одноатомный, двухатомный и Многоатомный газы. Теплоемкость идеального газа.
Диффузия и теплопроводность. Неравновесные системы. Эволюция состояния неравновесных систем. Закон диффузии. Коэффициент диффузии. Уравнение сохранения числа частиц. Уравнение диффузии. Закон теплопроводности. Коэффициент теплопроводности.
33 Степени свободы. Теорема о равнораспределении энергии по степеням свободы.
Числом
степеней свободы любого материального
тела называется число величин, которые
надо зафиксировать, чтобы полностью
определить его положение. Чаще всего
такими величинами являются координаты.
Тогда у материальной точки в трехмерном
пространстве число степеней свободы
равно трем. Для любого тела число степеней
свободы равно
![]() ,
где
—
число материальных точек, образующих
тело. Для абсолютно твердого тела задача
упрощается. Так как все точки жестко
связаны между собой, то достаточно
задать три координаты центра инерции
и три угла поворота относительно трех
осей вращения, связанных с телом. Первые
называются поступательными степенями
свободы, а вторые вращательными.
,
где
—
число материальных точек, образующих
тело. Для абсолютно твердого тела задача
упрощается. Так как все точки жестко
связаны между собой, то достаточно
задать три координаты центра инерции
и три угла поворота относительно трех
осей вращения, связанных с телом. Первые
называются поступательными степенями
свободы, а вторые вращательными.
Перейдем
теперь к определению внутренней энергии
простейшей системы — идеального газа.
Все направления движения молекул
идеального газа равновероятны. Поэтому
можно предположить, что средние
кинетические энергии по отдельным
направлениям равны между собой, а также
равны между собой средние кинетические
энергии вращения относительно трех
осей. Можно также показать, что для
классического случая равны также средние
кинетические энергии для поступательной
степени свободы и для вращательной
степени свободы. Для квантового случая
последнее равенство выполняется не
всегда. Теорема о равнораспределении
энергии по степеням свободы еще дает
величину средней энергии для каждой
степени свободы в одном объекте:
![]() .
.
Молекулы
газов бывают разные: одноатомные,
двухатомные, трехатомные и многоатомные.
Если не рассматривать внутреннюю
структуру атома, т.е. взаимодействие
электронов и ядра, то каждый атом в
молекуле можно представить в в идее МТ.
Кроме этого часто пренебрегают движением
атомов внутри молекулы относительно
друг друга (колебания). В этом случае
нетрудно определить среднюю энергию,
приходящуюся на одну молекулу идеального
газа. В случае одноатомного газа на одну
молекулу приходится средняя энергия,
равная
![]() .
В случае двухатомного газа таких степеней
5: 3 поступательных и 2 вращательных
степени свободы (вращение относительно
оси, проходящей через атомы не дает
вклада в энергию). Средняя энергия:
.
В случае двухатомного газа таких степеней
5: 3 поступательных и 2 вращательных
степени свободы (вращение относительно
оси, проходящей через атомы не дает
вклада в энергию). Средняя энергия:
![]() .
В случае трех и многоатомного газа таких
степеней столько же, сколько у твердого
тела: 6, 3 поступательных и 3 вращательных
степени свободы. Средняя энергия:
.
В случае трех и многоатомного газа таких
степеней столько же, сколько у твердого
тела: 6, 3 поступательных и 3 вращательных
степени свободы. Средняя энергия:
![]() .
Общая формула
.
Общая формула
![]() ,
где
—
число степеней свободы молекулы.
,
где
—
число степеней свободы молекулы.
Следовательно, можно записать формулу для внутренней энергии идеального газа. Умножаем на полное число молекул:
![]()
Отсюда
![]() и
и
![]() .
.
В
классическом случае число степеней
свободы не меняется с температурой.
Однако, эксперимент и квантовая теория
показывают обратное. При малых абсолютных
температурах во внутреннюю энергию
любого газа дают вклад только 3
поступательные степени свободы. При
некоторой температуре включаются
вращательные степени свободы. И, наконец,
могут включиться колебательные степени
свободы, для которых средний вклад во
внутреннюю энергию молекулы вычисляется
так
![]() .
Это связано с тем, что при колебаниях
усредняется не только кинетическая, но
и потенциальная энергия.
.
Это связано с тем, что при колебаниях
усредняется не только кинетическая, но
и потенциальная энергия.
