
- •1 Кинематика материальной точки. Тело отсчета. Прямолинейное движение. Движение тела в пространстве. Декартова система координат. Система отсчета.
- •2 Радиус-вектор, скорость и ускорение материальной точки, их связь с декартовыми координатами.
- •3 Движение по криволинейной траектории. Тангенциальное и нормальное ускорения.
- •4 Кинематика твердого тела. Поступательное движение твердого тела. Вращение тела вокруг неподвижной оси. Угловая скорость вращения. Вектор угловой скорости. Угловое ускорение.
- •5 Первый закон Ньютона – закон инерции. Инерциальная система отсчета.
- •7 Третий закон Ньютона. Формулирование задачи движения материальных точек. Начальные условия.
- •10 Неинерциальные системы отсчета. Силы инерции.
- •11 Замкнутая система. Законы сохранения. Связь законов сохранения со свойствами пространства и времени.
- •12 Закон сохранения импульса
- •13 Момент силы и момент импульса относительно неподвижного начала. Их связь.
- •14 Закон сохранения момента импульса
- •15 Работа и кинетическая энергия
- •16 Консервативные и неконсервативные силы. Потенциальная энергия. Примеры потенциальной энергии.
- •17 Закон сохранения и изменения механической энергии
- •18 Абсолютно неупругий и абсолютно упругий удары.
- •19 Механика абсолютно твердого тела. Вращение вокруг неподвижной оси. Момент инерции.
- •20 Теорема Гюйгенса-Штейнера. Вычисление моментов инерции. Примеры.
- •21 Колебания. Разные типы колебаний.
- •22 Гармонические колебания. Основные характеристики колебательного процесса. Дифференциальное уравнение гармонических колебаний.
- •23 Пружинный маятник. Энергия маятника.
- •24 Физический маятник.
- •25 Затухающие колебания. Дифференциальное уравнение, вид решения, график,
- •26 Вынужденные колебания. Резонанс.
- •27 Волновые процессы. Уравнение плоской волны. Дифференциальное уравнение плоской волны.
- •28 Макроскопическая система большого количества молекул. Ее параметры. Равновесная система.
- •29 Массы и размеры молекул. Атомная масса. Молярная масса.
- •30 Уравнение идеального газа.
- •31 Распределение молекул по скоростям в идеальном газе.
- •32 Газ во внешнем потенциальном поле. Распределение Больцмана. Барометрическая формула.
- •33 Степени свободы. Теорема о равнораспределении энергии по степеням свободы.
- •34 Теплопередача. Макроскопическая работа. Первый закон (начало) термодинамики. Применение к изопроцессам.
- •35 Явления переноса. Средняя длина свободного пробега.
- •36 Диффузия.
- •37 Теплопроводность.
- •38 Взаимодействие зарядов. Их знаки. Единичный заряд. Закон Кулона.
- •39 Напряженность электростатического поля. Определение. Напряженность точечного заряда. Силовые линии.
- •41 Электрический диполь. Дипольный момент. Напряженность диполя на больших расстояниях.
- •41 Поток вектора и теорема Гаусса.
- •42,43 Потенциал электростатического поля. Потенциал точечного заряда. Консервативность электростатического поля
- •44 Проводники в электрическом поле.
- •45 Поляризация диэлектриков. Поляризуемость. Вектор электрического смещения. Электрическая проницаемость.
- •46 Электрический ток. Вектор плотности тока. Закон сохранения заряда в интегральном и дифференциальном виде.
- •47 Закон Ома в дифференциальном и интегральном виде. Удельная проводимость и удельное сопротивление.
- •48 Действие магнитного поля на проводники с током и движущиеся заряды.
- •49 Магнитное поле равномерно движущегося заряда. Закон Био—Савара.
- •50 Магнитное поле бесконечного прямого провода и витка с током.
- •51 Теорема Гаусса для магнитного поля. Циркуляция магнитного поля.
- •52 Магнитное поле в веществе. Различные типы магнетиков.
- •53 Емкость проводников и конденсаторов. Емкость шарового конденсатора.
- •54 Энергия заряженного конденсатора. Плотность электрической энергии. Энергия системы заряженных тел.
- •55 Электромагнитная индукция
- •56 Магнитный поток
- •57 Работа при перемещении витка с током в постоянном магнитном поле.
- •58 Самоиндукция. Коэффициенты индуктивности.
- •59 Энергия магнитного поля.
- •60 Ток смещения.
- •61 Система уравнений Максвелла.
- •62 Следствия из уравнений Максвелла.
- •63 Электромагнитные волны.
30 Уравнение идеального газа.
Уравнение состояния заданной массы газа должно иметь вид
![]() ,
,
где
![]() —
давление,
—
давление,
![]() —
объем,
—
термодинамическая температура. Единицей
давления в СИ является паскаль (Па),
равный Па=Н/м2.
Внесистемной единицей давления является
«миллиметр ртутного столба», причем 1
мм.рт.ст.=133,3 Па. Стандартное атмосферное
давление на поверхности Земли составляет
примерно 0,1 МПа.
—
объем,
—
термодинамическая температура. Единицей
давления в СИ является паскаль (Па),
равный Па=Н/м2.
Внесистемной единицей давления является
«миллиметр ртутного столба», причем 1
мм.рт.ст.=133,3 Па. Стандартное атмосферное
давление на поверхности Земли составляет
примерно 0,1 МПа.
Термодинамическая
температура
,
называемая также абсолютной, измеряется
в кельвинах (К). Связь между ней и
температурой
![]() ,
единицей которой является градус Цельсия
(
,
единицей которой является градус Цельсия
(![]() ),
имеет вид
),
имеет вид
![]()
Объем измеряется в м3.
Идеальным газом называется газ, параметры которого подчиняется уравнению Клапейрона—Менделеева:
![]() .
.
Здесь
—
масса газа,![]() —
универсальная газовая постоянная. Это
уравнение может быть преобразовано к
некоторым другим видам. Наиболее важный
получится, если обе уравнения разделить
на объем и представить отношение число
молей
—
универсальная газовая постоянная. Это
уравнение может быть преобразовано к
некоторым другим видам. Наиболее важный
получится, если обе уравнения разделить
на объем и представить отношение число
молей
![]() в
виде
в
виде
![]() ,
где
—
число молекул в газе. Определим теперь
концентрацию
,
где
—
число молекул в газе. Определим теперь
концентрацию
![]() и
уравнение преобразуется к виду
и
уравнение преобразуется к виду
![]() .
.
Отношение
![]() называется
постоянной Больцмана. Уравнение состояния
еще более упрощается
называется
постоянной Больцмана. Уравнение состояния
еще более упрощается
![]() .
.
Если рассматривать смесь различных идеальных газов (например, воздух), то надо сформулировать закон Дальтона. Пусть несколько идеальных газов занимают один и тот же объем (молекулы перемешиваются). Для каждого газа можно ввести свое отдельное давление, которое будет в этом газе, если бы всех остальных не было в объеме. Оно называется парциальным и в соответствии с уравнением идеального газа равно
![]() ,
,
где
![]() —
номер газа.
—
номер газа.
Дальтон экспериментально установил, что полное давление смеси равно сумме парциальных давлений
.
Кроме выше данного определения, ничего не говорящего о свойствах молекул газа, можно ввести физическое определение идеального газа. Идеальным газом называется газ, молекулы которого не взаимодействуют на расстоянии и при столкновении ведут себя абсолютно упруго. А суммарный объем всех молекул данного газа пренебрежимо мал по сравнению с объемом газа.
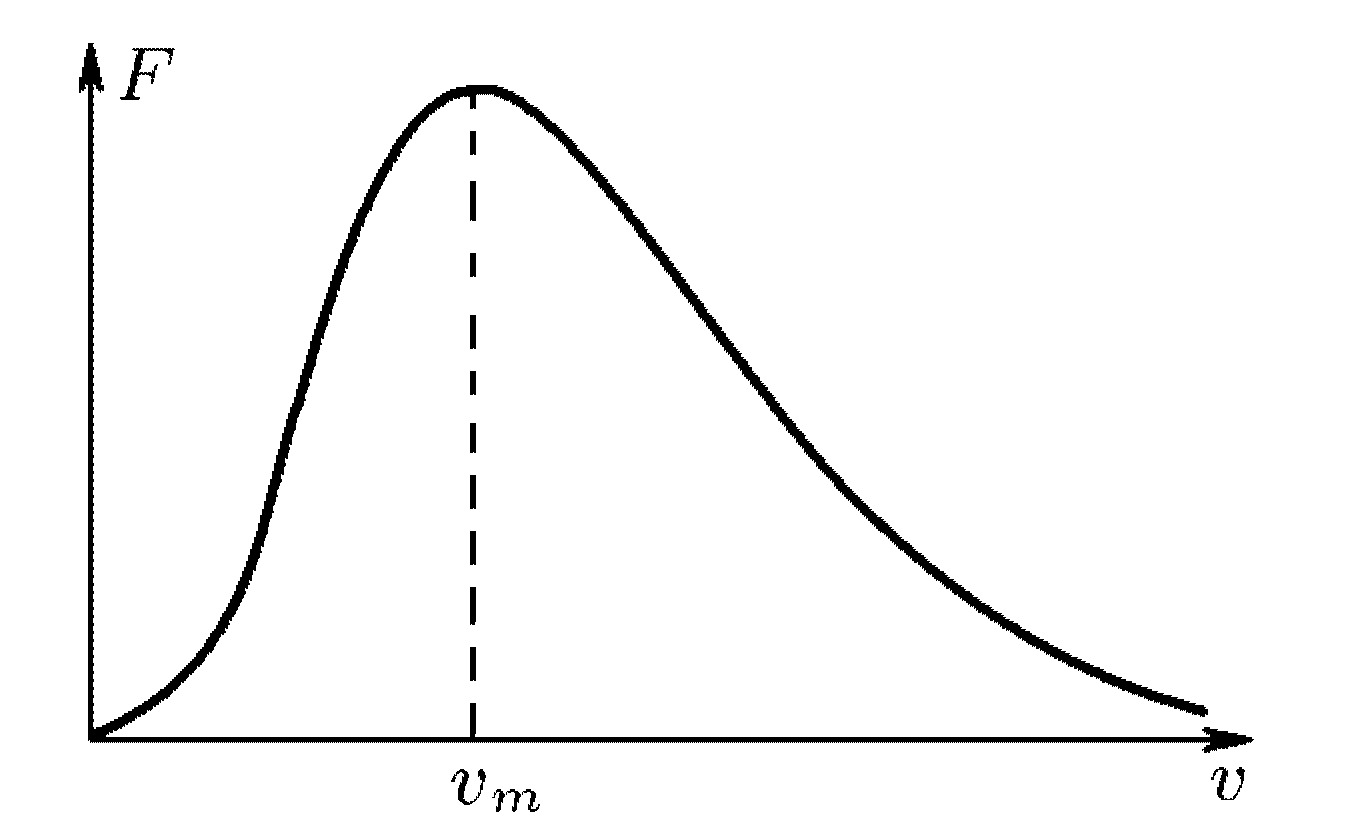
31 Распределение молекул по скоростям в идеальном газе.
Это распределение для идеального газа нашел теоретически Максвелл.
 Мы
рассмотрим только распределение молекул
по модулю их скорости.
Мы
рассмотрим только распределение молекул
по модулю их скорости.
Число
молекул
![]() ,
имеющих модуль скорости (в дальнейшем
просто скорости) в диапазоне от
до
,
имеющих модуль скорости (в дальнейшем
просто скорости) в диапазоне от
до
![]() может
быть записано в виде
может
быть записано в виде
![]() .
.
Здесь
—
общее число молекул газа. Функция
![]() называется
функцией распределения молекул по
скоростям. Эта по Максвеллу равна
называется
функцией распределения молекул по
скоростям. Эта по Максвеллу равна
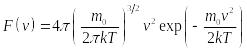 .
.
Здесь
![]() —
масса молекулы газа.
—
масса молекулы газа.
Из
рисунка видно, что функция имеет максимум
в точке
![]() (обычно
называемой наиболее вероятностной
скоростью) и стремится к нулю на
бесконечности. Эта функция может быть
применена к газу, у которого очень много
молекул. Величина
(обычно
называемой наиболее вероятностной
скоростью) и стремится к нулю на
бесконечности. Эта функция может быть
применена к газу, у которого очень много
молекул. Величина
![]() считается
бесконечно малой. Для того, чтобы узнать
количество молекул, имеющих скорость
в не бесконечно малом диапазоне скоростей,
надо воспользоваться интегральным
исчислением:
считается
бесконечно малой. Для того, чтобы узнать
количество молекул, имеющих скорость
в не бесконечно малом диапазоне скоростей,
надо воспользоваться интегральным
исчислением:
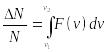 ,
,
где и — нижняя и верхняя границы скоростного диапазона.
Пользуясь этим распределением, можно получить необходимые для физиков величины средней, среднеквадратичной и наиболее вероятной скоростей.
Наиболее вероятная скорость получается, если взять производную от и приравнять ее нулю. Получившееся уравнение приводит к
 .
.
Любые средние величины вычисляются с помощью интегралов:
![]() .
.
Вычисления приводят к следующим результатам:
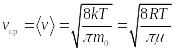 ,
,
 .
.
Скорости хаотического движения молекул при обычных температурах велики. Например, для молекулы азота (азот главная составляющая воздуха), квадратичная скорость при 200 С равна
![]() .
.
