
Билет 9
Для растворения 16,8 г металла потребовалось 14.7 г серной кислоты. Определите эквивалентную массу металла и объем выделившегося водорода при 17 С и давлении 740 мм.рт.ст.
Вычислите массу одного атома кальция в граммах.
На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме: As2S3 + HСlO3 H3 АsO4 + H2SO4 + HCl В необходимых случаях добавить воду. Укажите окислитель и восстановитель.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений: Н2 (Г) +
 О2
(Г)
= Н2
О
(Ж);
Н = –285,84 кДж;
С
(К)
+ О2
(Г)
= СО2
(Г);
Н = –393,51 кДж;
СН4
(Г)
+ 2О2
(Г)
= 2Н2
О
(Ж)
+ СО2
(Г);
Н = –890,31 кДж.
О2
(Г)
= Н2
О
(Ж);
Н = –285,84 кДж;
С
(К)
+ О2
(Г)
= СО2
(Г);
Н = –393,51 кДж;
СН4
(Г)
+ 2О2
(Г)
= 2Н2
О
(Ж)
+ СО2
(Г);
Н = –890,31 кДж.Константа скорости реакции 2SO2 + O2 2SO3 при некоторой температуре равна 0,0015 л/моль сек. Определите скорость реакции в момент, когда концентрации диоксида серы и кислорода соответственно равны 0,06 и 0,045 моль/л.
В гомогенной системе А + 2В С равновесные концентрации реагирующих газов:
[А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислить константу равновесия системы и исходные концентрации веществ.
Вычислите массовую долю HNO3 в растворе и моляльность 8 н раствора HNO3, плотность которого равна 1,246 г см--3.
Вычислите, на сколько градусов понизится температура замерзания бензола, если в 100 г его растворить 4 г нафталина С10Н8. Криоскопическая константа бензола 5,120С
Сколько граммов глюкозы С6Н12О6 содержится в 200 мл раствора, осмотическое давление которого при 370С составляет 8 атм.?
Вычислите рН раствора азотной кислоты (
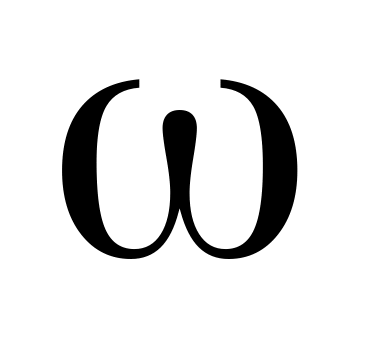 =
0,0005). Плотность раствора и степень
диссоциации НNO3
считать равным единице.
=
0,0005). Плотность раствора и степень
диссоциации НNO3
считать равным единице.Для нейтрализации 10 мл раствора, содержащего 5,3 г Na2CO3 на 1 л потребовалось 50 мл раствора HСl. Определить нормальность раствора соляной кислоты.
Для гальванического элемента (Pt) Sn+2, Sn+4//Fe+3, Fe+2(Pt) составьте уравнения электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д.С. элемента.
Какова была сила тока при электролизе водного раствора AgNO3 если в течение 15 мин был выделен весь металл из 300 мл 0,5 н раствора. Напишите уравнения реакций, происходящих на электродах.
Ti склепан с Cu. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему. Если будет, то записать схему коррозии.
Билет 10
При нагревании 21,4 г металла было получено 23,4 г оксида. Определите эквивалент металла.
Найдите, сколько молекул содержится в 2 молях воды и какой объем они займут при 40С и 105 Па.
Используя метод электронного баланса, расставьте коэффициенты, укажите окислитель и восстановитель. As2S3 + H2O2 + NH4OH (NH4)3AsO4 + (NH4)2SO4 + H2O
Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия?
Химическая реакция протекает в растворе согласно уравнению А + В С, исходные концентрации: [А] = 0,80 моль/л; [В] = 1,60 моль/л. Спустя 20 мин. концентрация [А] снизилась до 0,78 моль/л. Какова стала концентрация вещества [В]? С какой средней скоростью за это время протекает реакция, если о скорости судить по убыли вещества [А], вещества [В]?
Исходные концентрации [NO] и [Cl2] в гомогенной системе 2NО + Cl2 2NОCl составляют соответственно 0,5 и 0,2 моль/л. Вычислить константу равновесия, если к моменту наступления прореагировало 20% NO.
Какой объем раствора гидроксида калия с массовой долей КОН 24% (p=1,218 г см--3) можно приготовить из 125 л раствора гидроксида калия с массовой долей КОН 0,48 (p=1,510 г см--3)?
В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,1040С. Эбуллиоскопическая константа воды 0,5120С.
Осмотическое давление раствора, в 250 мл которого содержится 0,66 г мочевины, равно 836 мм рт.ст. при 330С. Вычислите относительную молекулярную массу мочевины.
Какое количество гидроксида натрия растворено в 200 мл раствора NaOH, если рН этого раствора 12.
В 500 мл воды растворено 100 г Na2CO3 (р= 1,02 г/см3). Определить нормальность, молярность и моляльность полученного раствора.
Вычислите Э.Д.С. гальванического элемента, который образован электродами Zn/Zn+2 при C(Zn2+) = 0,1 г–ион/л и Cu/Cu+2 при C(Cu+2)=0,01 г–ион/л и сравните Э.Д.С. гальванического элемента, образованного нормальными электродами тех же металлов.
Составьте уравнения реакций электролиза водного раствора Pb(NO3)2 . Какой объем 0,5 М раствора был взят, если для полного превращения электролита потребовалось 1,5 часа ? Сила тока равна 4 А.
Никель покрыт серебром. Система работает в кислом водном растворе. Будет ли протекать коррозия в системе, если нарушена целостность покрытия ? Ответ мотивируйте.
