
Билет 1
При нормальных условиях 1 г воздуха занимает объем 733 мл. Какой объем займет та же масса воздуха при 0 С0 и давлении, равном 93,3 кПа (700 мм.рт.ст.)?
Расчетным путем покажите, одинаковое ли количество молекул содержится в 1 эквиваленте диоксида серы SO2 и триоксида серы SO3 , взятых при одинаковых условиях.
Используя метод электронного баланса, составить схемы процессов окисления и восстановления, полное уравнение реакции в данной схеме: MoS2 + HNO3 + PbO2
 H2MoO4
+ PbSO4
+ Pb(NO3)2
Если необходимо, впишите недостающие
молекулы воды. Укажите окислитель и
восстановитель.
H2MoO4
+ PbSO4
+ Pb(NO3)2
Если необходимо, впишите недостающие
молекулы воды. Укажите окислитель и
восстановитель.Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению:
Fe3O4 (K) + CO (Г) = 3FeO (K) + CO2 (Г); = +34,55 кДж; S = 146,2 Дж/моль К.
Вычислить, как и во сколько раз уменьшится скорость реакции N2 + O2 = 2NO при уменьшении давления в 100 раз.
Константа равновесия гомогенной системы N2 + 3H2 2NH3 при температуре, равной 3000С равна 0,1. Равновесные концентрации водорода и аммиака равны 0,4 моль/л и 0,16 моль/л. Вычислить равновесную и начальную концентрацию азота.
Кристаллическая сода Na2СO3
 10Н2О
какой массы потребуется для приготовления
раствора объемом 1,2 л, если его: а)
молярная концентрация равна 0,2 моль/л;
б) эквивалентная концентрация равна
0,2 моль/л?
10Н2О
какой массы потребуется для приготовления
раствора объемом 1,2 л, если его: а)
молярная концентрация равна 0,2 моль/л;
б) эквивалентная концентрация равна
0,2 моль/л?
Требуется вычислить давление пара раствора, содержащего 0,2 моля сахара в 450 г воды. Давление пара чистой воды при 200С равно 17,5 мм рт.ст.
Вычислите величину осмотического давления раствора, в 1 л которого содержится 0,2 моля неэлектролита, если температура раствора 170С.
Вычислите молярную концентрацию раствора муравьиной кислоты (рН=3, КД=2,1 10-4 ).
Определить нормальность, молярность и моляльность 48% -ного раствора Н2SO4 (р=1,38 г/мл).
Составьте гальванический элемент, в котором бы протекала следующая реакция: Hg2SO4 + 2Cl– = Hg2Cl2 +

Укажите знаки электродов, запишите электронные реакции, рассчитайте стандартную Э.Д.С. данного элемента.
Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора Fe2(SO4)3 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 5 ампер за время 2 часа при t=170С и р=99,75 кПа. Выход по току составил 90%.
Составьте схему атмосферной коррозии железа в контакте с медью. Ответ мотивируйте.
Билет 2
При восстановлении 1,8 г оксида металла израсходовано 833 мл водорода при н.у. Вычислить эквивалент оксида и металла.
Определите массу и объем 24,08*1023 молекул сероводорода H2S при 33 С и давлении 1,06кПа.
Используя метод электронного баланса составить схемы процессов окисления и восстановления, полное уравнение реакции в данной схеме: CuFeS2 + HNO3 Fe(NO3)3 + CuSO4 + H2SO4 + NO Если необходимо, впишите недостающие молекулы воды. Укажите окислитель и восстановитель.
На основании стандартных теплот образования и абсолютных стандартных энтропий веществ, вычислите Н реакции, протекающей по уравнению:
CO (Г) + Н2O (Ж) = CO2(Г) + Н2 (Г)
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л; [O2] = 0,02 моль/л. Вычислите начальную скорость реакции и скорость в момент, когда [NO] стала равной 0,005 моль/л.
Каким путем можно повысить выход NO2 при реакциях, идущих по уравнениям:
а) 2NO + O 2NO2 ¬– Н;
б) N2O4 2NO2 + Н
7. Медный купорос CuSO4 5H2O какой массы потребуется для приготовления раствора объемом 2 л, содержащего CuSO4 количеством вещества 0,5 моль? Какова молярная концентрация полученного раствора?
8. Давление пара воды при 200С составляет 17,54 мм рт.ст. Сколько граммов сахара С12Н22О11 следует растворить в 720 г воды для получения раствора, давление пара которого на 0,14 мм рт.ст. ниже давления пара воды?
Определите относительную молекулярную массу глюкозы, если осмотическое давление раствора, содержащего
Вычислите рН 0,01 %-ного раствора HCl (р=1 г см-3 ,
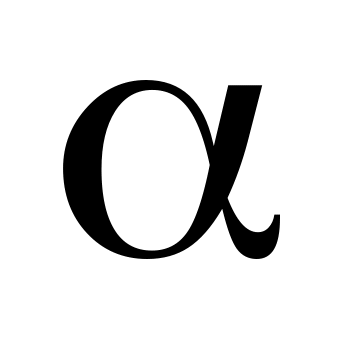 =1).
=1).Определить нормальность, молярность и моляльность 17%-ного раствора Н2SO4 (р=1,12 г/см3).
Составьте гальванический элемент, в котором бы протекала следующая реакция:
5Pb0
+ 5SO![]() +
2MnO
+
2MnO![]() + 16H+
= 2Mn2+
+ 8H2O
+ 5PbSO
+ 16H+
= 2Mn2+
+ 8H2O
+ 5PbSO
Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора CuCl2 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 4 ампер за время 1,5 часа при t=170С и Р=750 мм. рт. ст.
Составьте схему атмосферной коррозии Ag в контакте с Cd. Дать соответствующие пояснения.
