
Топливные элементы.
Топливные элементы могут работать в непрерывном режиме без простоев для перезарядки, так как их активный материал (водород, СО2, уголь, жидкие и газообразные углеводороды) подводится из внешнего источника. Их электролит в процессе работы не изменяется. В топливных элементах энергия химических реакций, выделяющаяся в процессе окисления топлива, непосредственно преобразуется в электричество. Их теоретический КПД близок к 100%. т.к. окислительно-восстановительная реакция горения топлива используется непосредственно для прямого получения электрического тока в топливном элементе.
Топливные элементы в будущем могут использоваться как автономные источники тока для автомобилей и катеров, электрогенераторы для индивидуальных домашних хозяйств, переносные силовые блоки для инструментов и другого оборудования.
Электрическую энергию получают непрерывно до тех пор, пока в анодное пространство элемента не прекратится подача топлива, а в катодное – кислорода (или воздуха). Схема записи низкотемпературного Н2/О2 топливного элемента:
А(-) Ni(H2)|H2SO4|(O2)C,Ag (+)K
![]()
Суммарная реакция: 2Н2О +О2 = 2Н2О(Ж)
Вторичные источники тока
Вторичные ЭХГ – это аккумуляторы, в которых проходят обратимые процессы. Аккумуляторы перезаряжаются пропусканием постоянного тока в направлении, противоположном направлению тока в режиме разрядки. При этом активные соединения в элементе восстанавливаются в результате обратной химической реакции.
Свинцовый аккумулятор. Свинцовый аккумулятор – самый распространенный в настоящее время. Он был изобретен Ж.Планте в 1860 г. Аккумулятор состоит из положительного электрода (катода) – свинцовой пластинки с ячейками, заполненными пастообразным оксидом свинца PbO2. и отрицательного электрода (анода) – решетчатой пластинки, заполненной пастой из губчатого свинца. Каждый аккумулятор состоит из нескольких пар таких пластин, погруженных в электролит – разбавленный раствор серной кислоты – и соединенных последовательно. Напряжение заряженного элемента аккумулятора составляет 2 В. Состояние свинцового аккумулятора оценивается путем измерения относительной плотности электролита. Непосредственно после зарядки она составляет примерно 1,26, а по мере разрядки понижается почти до 1,0 (это объясняется тем, что серная кислота образует химическое соединение с материалом пластин, давая в остатке воду).
В процессе разряда аккумулятора, т.е. при его работе, на электродах протекают реакции:

Для заряда аккумулятора используют внешний источник тока, подключая его к электродам. В результате на электродах протекают процессы в обратном направлении:
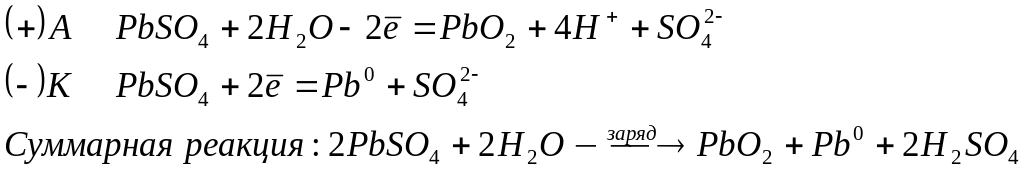
Преимуществами свинцового аккумулятора являются: большая электрическая емкость, устойчивость к работе, большое количество циклов разряда – заряда. К недостаткам относятся: большая масса, малая удельная емкость, выделение водорода при заряде, негерметичность при наличии концентрированного раствора серной кислоты.
Экспериментальная часть
Для измерения электродного потенциала металла необходимо составить гальванический элемент (рис. 7) из исследуемого электрода (ИЭ) и электрода сравнения (ЭС). Для этого опустить ИЭ в раствор соли этого же металла или в морскую воду, а ЭС – в раствор хлорида калия (KCl) Затем с помощью электролитических мостиков соединить эти электроды через промежуточный сосуд с раствором хлорида калия. Это обеспечивает контакт электролитов, но препятствует их смешиванию.

Рис. 7 Схема установки для измерения ЭДС гальванического элемента:
1 –исследуемый электрод (ИЭ); 2 – хлорсеребряный электрод (ЭС);
3 – сосуд с электролитом (раствором соли, морской водой и т.д.);
4 – промежуточный сосуд с насыщенным раствором KCl; 5 – солевые мостики; 6 – прибор для измерения ЭДС.
Электроды ИЭ и ЭС подключают к измерительному прибору таким образом, чтобы стрелка прибора отклонялась вправо. После измерения ЭДС (Е) гальванического элемента можно рассчитать электродный потенциал металла по формуле
![]()
В
качестве электрода сравнения в данной
работе используют хлорсеребряный
электрод (см. приложение 2). Потенциал
этого электрода, измеренный по отношению
к стандартному водородному электроду,
составляет
![]() .
.
Так как φиэ по отношению к φэс может быть как катодом, так и анодом, то φиэ рассчитывается, соответственно:
А) φИЭ= Е+ φэс = Е + 0,22
Б) φИЭ = φэс Е = 0,22 - Е
Опыт 1. Влияние природы металла и состава электролита на величину электродного потенциала
Для работы использовать следующие металлы: Fe, Zn, Al, Cu, Mg.
Собрать гальванические элементы, состоящие из электрода сравнения и предложенных металлов в 1М растворах их солей. Измерить Е, рассчитать потенциалы исследуемых электродов и сравнить их с табличными данными (см. приложение 1). Измерить Е и рассчитать величины электродных потенциалов исследуемых металлов, погруженных в искусственную морскую воду. Результаты измерений занести в таблицу.
Исследуемый металл |
Электролит |
Е,мВ |
φМе, мВ |
||
φр |
φнр |
φо |
|||
Fe |
FeSO4 |
|
|
- |
|
Морская вода |
|
- |
|
|
|
Zn |
ZnSO4 |
|
|
- |
|
Морская вода |
|
- |
|
|
|
Al |
Al2(SO4)3 |
|
|
- |
|
Морская вода |
|
- |
|
|
|
Cu |
CuSO4 |
|
|
- |
|
Морская вода |
|
- |
|
|
|
Mg |
MgSO4 |
|
|
- |
|
Морская вода |
|
- |
|
|
|
Опыт2. Влияние концентрации электролита на величину электродного потенциала.
Собрать гальванический элемент, состоящий из хлорсеребряного электрода сравнения и медного электрода.
Определить характер изменения потенциала медного электрода в зависимости от концентрации раствора сульфата меди. Для работы использовать растворы CuSO4 следующих концентраций:
1М; 0,1М; 0,01М; 0,001М.
Записать в таблицу результаты измерений Е, рассчитать величины потенциалов медных электродов и сравнить полученные данные с теоретическими значениями потенциалов (по формуле Нернста) при тех же концентрациях растворов.
Исследуемый электрод (ИЭ) |
Концентрация CuSO4 (моль/л) |
Е, мВ |
φиэ, мВ |
|
Экспериментальная величина |
Теоретическая |
|||
Cu |
1M |
|
|
|
0,1M |
|
|
|
|
0,01M |
|
|
|
|
0,001M |
|
|
|
|
По полученным данным построить график экспериментальной и теоретической зависимости потенциала φр от концентрации [Cu2+]. Сделать вывод.
Опыт 3. Определение концентрации раствора соли.
Соберите гальванический элемент в соответствии с предложенной схемой записи:
A () Ag | AgCl, KCl║ MeA | Me (+) K
CX
Измерьте
с помощью высокоомного вольтметра
величину ЭДС элемента. Рассчитайте
величину равновесного потенциала
исследуемого электрода
![]() .
Затем, используя формулу Нернста, оцените
концентрацию раствора соли металла
CX=[MeA].
.
Затем, используя формулу Нернста, оцените
концентрацию раствора соли металла
CX=[MeA].
