
- •1. Законы поглощения света. Закон Ламберта–Бугера–Бера.
- •2. Фотоколориметрия. Методы фотоколориметрии: сущность, достоинства, предел обнаружения, применение для анализа силикатных материалов.
- •3. Титриметрический анализ: сущность, предел обнаружения, достоинства. Основные понятия: аналитическая реакция, титрант, точка эквивалентности, конечная точка титрования.
- •4. Титриметрический анализ. Сущность анализа, точность, достоинства. Способы выражения состава раствора в титриметрии.
- •6. Титриметрический анализ. Основные понятия и определения. Сущность метода. Классификация титриметрических методов по типу аналитической реакции. Индикаторы.
- •7. Титриметрия. Кислотно–основное титрование. Сущность метода. Аналитическая реакция кислотно–основного титрования. Индикаторы. Применение метода для анализа силикатных материалов.
- •8. Титриметрия. Окислительно–восстановительное титрование. Сущность метода. Титранты. Аналитическая реакция. Применение метода для анализа силикатных материалов.
- •9. Титриметрия. Комплексонометрическое титрование. Сущность метода. Титрант. Аналитическая реакция. Индикаторы. Применение метода для анализа строительных материалов.
- •10. Титриметрия. Приемы титрования: прямое, обратное. Принцип эквивалентности. Расчёт массы определяемого вещества.
- •11. Гравиметрический анализ. Сущность, предел обнаружения, достоинства. Основные понятия и определения. Классификация гравиметрических методов.
- •12. Гравиметрия. Метод выделения, метод отгонки. Сущность, предел обнаружения, достоинства. Применение для анализа строительных материалов.
- •13. Гравиметрия. Метод осаждения. Сущность, предел обнаружения, достоинства. Схема анализа. Осадитель, осаждаемая форма. Основные требования к форме осаждения. Определение объёма осадителя.
- •14. Гравиметрия. Метод осаждения. Сущность, схема анализа. Определяемое вещество, гравиметрическая форма. Гравиметрический фактор. Определение количества определяемого вещества.
- •15. Произведение растворимости. Условие выпадение осадка.
- •16. Произведение растворимости. Условие растворения малорастворимых соединений.
- •17. Произведение растворимости. Влияние одноименных ионов на растворимость малорастворимых соединений.
- •18. Произведение активностей. Коэффициент активности.
- •19. Хроматография. Сущность, предел обнаружения, достоинства метода. Классификация хроматографических методов по агрегатному состоянию фаз.
- •20. Хроматография. Сущность метода. Основные понятия: сорбция, сорбент, порядок сорбции, энергия сорбции.
- •21. Хроматография. Основные положения газовой хроматографии.
- •23. Ионообменная хроматография. Сущность метода. Катиониты. Аниониты. Реакции ионного обмена. Определение содержания гипса в цементе методом ионообменной хроматографии.
- •24. Рфа. Природа и свойства рентгеновских лучей. Сущность метода. Применение для анализа строительных материалов.
- •25. Рфа. Основные понятия: элементарная ячейка, сингония кристалла, межплоскостное расстояние. Угол скольжения, порядок отражения ртг лучей. Уравнение дифракции.
- •26. Рфа. Сущность метода, предел обнаружения, применение метода для анализа силикатных материалов. Уравнение Брегга–Вульфа.
- •27. Рфа. Основные кристаллические системы (сингонии). Примеры.
- •28. Рфа. Методы съёмки рентгенограмм. Рентгенотехника.
- •29 . Рфа. Метод Лауэ, метод Брегга. Сущность, достоинства, применение.
- •30. Рфа. Метод Дебая–Шерера. Сущность, достоинства, применение для анализа строительных материалов.
- •31. Рфа. Уравнение Брегга–Вульфа. Расчёт дифрактограмм. Идентификация.
- •32. Термический анализ. Сущность, предел обнаружения, возможности. Анализ гетерогенного химического процесса.
- •33. Термический анализ. Термограмма. Метод дта. Экзо– и эндотермические химические процессы. Определение Сn, n, скорости реакции при Ts.
- •34. Метод дта. Определение содержания химически связанной воды в цементном камне.
- •35. Метод тг, дта. Анализ известняков, доломитов.
- •43. Химический анализ силикатов. Особенности вскрытия (растворения в воде, кислотах) силикатов.
- •45. Определение содержания кальция в известняке, доломите методом кислотно-основного титрования.
- •46. Определение гигроскопической влаги, п.П.П. В цементе, гипсе гравиметрическим методом.
- •47. Определение содержания СаО, МgO гравиметрическим методом. Расчёт.
- •48. Определение содержания СаО, МgO, Fe2o3 в портландцементе.
- •49. Определение содержания Fe2o3 фотоколориметрическим методом.
21. Хроматография. Основные положения газовой хроматографии.
Хроматография–физический метод разделения веществ. Основан на использовании сорбционных процессов в динамических условиях, возникающих при прохождении газов, паров или жидкостей через слой зернённого сорбента.
Основные положения:
1. Сорбция–процесс поглощения твёрдой или жидкой фазой газа или раствора. Обратный процесс–вымывание вещества из сорбента–десорбция. Сорбент–вещество–поглотитель–это природный или искусственно синтезированный материал, способный поглощать вещества из газообразной или жидкой фазы.
2. Сорбируемость–способность молекул удерживаться на поверхности сорбента. Энергия сорбции–сила, с помощью которой молекулы удерживаются на поверхности сорбента. Зависит от типа сорбента. Для полярного Е прямопропорциональна степени ненасыщенности соединения. Для неполяряного Е прямопропорциональна молярной массе вещества.
3) Суть хроматографии–разделение вещества.
Метод определения и идентификации сложных смесей. Метод применим к любым жидким и газообразным смесям. Метод отличает универсальность, высокая чувствительность, простота. В основе этого метода лежит явление сорбции (поглощении).
Суть метода–распределение компонентов между 2мя фазами, одна–неподвижная, другая представляет поток, фильтрующийся через неподвижный. слой. Газотвердофазная, газо-жидкостная, газовая хроматография–метод разделения, анализа и исследования летучих компонентов. Подвижная фаза–инертный газ, т.к не взаимодействует с сорбентом и парами исследуемого вещества(жидкий азот, аргон). Неподвижная–твёрдые частицы с большой удельной поверхностью. (S=10–700м2/г). Процессы сорбции–десорбции. Проходят в хроматографе. Применяется для анализа нефтепродуктов, воздуха на вредные примеси, в лесохимии, для анализа микропримесей и нелетучих соединений.
22. Хроматографирование. Хроматограмма. Хроматографические параметры: время удерживания. Определение количественного состава по хроматограмме.
Хроматография–физический метод разделения веществ. Основан на использовании сорбционных процессов в динамических условиях, возникающих при прохождении газов, паров или жидкостей через слой зернённого сорбента. Хроматограмма–графическое изображение процесса хроматографирования. Время удерживания–время от ввода пробы до регистрации max пика. Удерживаемый объём V подвижной фазы, который нужно пропустить через колонку. 0-t-время удерживания молекул на поверхности сорбента(мин)
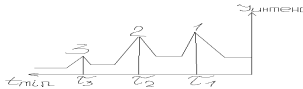
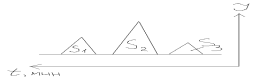
Количество компонентов определяют двояко:
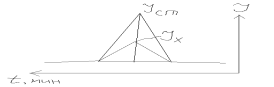
1. по S: Сумма(S1+S2+S3)=100%. Массовая доля i го компонента: %i=Si*100/суммаS, суммаS=100%, S=1/2*в*h-площадь треугольника
2. Для определения количества неизвестного компонента хроматографируют смесь с известным количеством компонентов, а затем хроматографируют смесь с неизвестной концентрацией Iст—Сст, Iх–Сх, Сх=Сст*Ix/Iст
23. Ионообменная хроматография. Сущность метода. Катиониты. Аниониты. Реакции ионного обмена. Определение содержания гипса в цементе методом ионообменной хроматографии.
Ионообменная хроматография основана на явлении обмена ионов, находящихся в растворе и ионов в твердом сорбенте. В качестве твердых адсорбентов применяют ионообменные смолы, или иониты: иониты делятся на катиониты и аниониты. Катиониты обменивают свои катионы (чаще всего ионы водорода) на катиониты солей, находящиеся в омывающем растворе. Катиониты содержат активные кислотные группы(–SQ3H; –CH2SO3H; –СООН; –ОН). Механизм взаимодействия катионитов с основанием или солью может быть изображен следующими схематическими уравнениями: 2RH+Са(ОН)2RaCa+2Н2О; 2RH+CaSO4 <=> R2Ca+H2SO4, где R–сложный радикал катионита, выполняющий функцию аниона.
Смолы–аниониты обменивают анионы (гидроксильные ионы) на анионы солей, присутствующие в растворе. Аниониты содержат активные основные группы: –NH2; =NH; =N+R3. Обменными анионами здесь являются ионы гидроксила, образующиеся на поверхности смолы в процессе ее гидратации: –NH2(H3O)+ОH; =NH(H3O)+OH; =N(H3O)+OH- . Между гидратированной смолой и кислотой или солью протекают следующие реакции обмена: RaOH+НС1=RaCl+Н2О; RaOH+NaCl=RaCl+NaOH, где Ra–сложный радикал анионита, выполняющий функцию катиона.
В химическом анализе наиболее широко используют смолы–катиониты типа сульфокислот в водородной форме (Н–катионит). Их применяют для анализа растворов, содержащих такие анионы, как сульфаты, фосфаты, ацетаты, а также для определения сульфатов в силикатах, например, в цементах. Для определения % содержания CaSO4.2H2O в цементе количество SO3=(V*T(NaOH/SO3)*100%)/a умножают на фактор пересчета f=(MСаSO4*2H2O)/MSO3
