
- •1. Законы поглощения света. Закон Ламберта–Бугера–Бера.
- •2. Фотоколориметрия. Методы фотоколориметрии: сущность, достоинства, предел обнаружения, применение для анализа силикатных материалов.
- •3. Титриметрический анализ: сущность, предел обнаружения, достоинства. Основные понятия: аналитическая реакция, титрант, точка эквивалентности, конечная точка титрования.
- •4. Титриметрический анализ. Сущность анализа, точность, достоинства. Способы выражения состава раствора в титриметрии.
- •6. Титриметрический анализ. Основные понятия и определения. Сущность метода. Классификация титриметрических методов по типу аналитической реакции. Индикаторы.
- •7. Титриметрия. Кислотно–основное титрование. Сущность метода. Аналитическая реакция кислотно–основного титрования. Индикаторы. Применение метода для анализа силикатных материалов.
- •8. Титриметрия. Окислительно–восстановительное титрование. Сущность метода. Титранты. Аналитическая реакция. Применение метода для анализа силикатных материалов.
- •9. Титриметрия. Комплексонометрическое титрование. Сущность метода. Титрант. Аналитическая реакция. Индикаторы. Применение метода для анализа строительных материалов.
- •10. Титриметрия. Приемы титрования: прямое, обратное. Принцип эквивалентности. Расчёт массы определяемого вещества.
- •11. Гравиметрический анализ. Сущность, предел обнаружения, достоинства. Основные понятия и определения. Классификация гравиметрических методов.
- •12. Гравиметрия. Метод выделения, метод отгонки. Сущность, предел обнаружения, достоинства. Применение для анализа строительных материалов.
- •13. Гравиметрия. Метод осаждения. Сущность, предел обнаружения, достоинства. Схема анализа. Осадитель, осаждаемая форма. Основные требования к форме осаждения. Определение объёма осадителя.
- •14. Гравиметрия. Метод осаждения. Сущность, схема анализа. Определяемое вещество, гравиметрическая форма. Гравиметрический фактор. Определение количества определяемого вещества.
- •15. Произведение растворимости. Условие выпадение осадка.
- •16. Произведение растворимости. Условие растворения малорастворимых соединений.
- •17. Произведение растворимости. Влияние одноименных ионов на растворимость малорастворимых соединений.
- •18. Произведение активностей. Коэффициент активности.
- •19. Хроматография. Сущность, предел обнаружения, достоинства метода. Классификация хроматографических методов по агрегатному состоянию фаз.
- •20. Хроматография. Сущность метода. Основные понятия: сорбция, сорбент, порядок сорбции, энергия сорбции.
- •21. Хроматография. Основные положения газовой хроматографии.
- •23. Ионообменная хроматография. Сущность метода. Катиониты. Аниониты. Реакции ионного обмена. Определение содержания гипса в цементе методом ионообменной хроматографии.
- •24. Рфа. Природа и свойства рентгеновских лучей. Сущность метода. Применение для анализа строительных материалов.
- •25. Рфа. Основные понятия: элементарная ячейка, сингония кристалла, межплоскостное расстояние. Угол скольжения, порядок отражения ртг лучей. Уравнение дифракции.
- •26. Рфа. Сущность метода, предел обнаружения, применение метода для анализа силикатных материалов. Уравнение Брегга–Вульфа.
- •27. Рфа. Основные кристаллические системы (сингонии). Примеры.
- •28. Рфа. Методы съёмки рентгенограмм. Рентгенотехника.
- •29 . Рфа. Метод Лауэ, метод Брегга. Сущность, достоинства, применение.
- •30. Рфа. Метод Дебая–Шерера. Сущность, достоинства, применение для анализа строительных материалов.
- •31. Рфа. Уравнение Брегга–Вульфа. Расчёт дифрактограмм. Идентификация.
- •32. Термический анализ. Сущность, предел обнаружения, возможности. Анализ гетерогенного химического процесса.
- •33. Термический анализ. Термограмма. Метод дта. Экзо– и эндотермические химические процессы. Определение Сn, n, скорости реакции при Ts.
- •34. Метод дта. Определение содержания химически связанной воды в цементном камне.
- •35. Метод тг, дта. Анализ известняков, доломитов.
- •43. Химический анализ силикатов. Особенности вскрытия (растворения в воде, кислотах) силикатов.
- •45. Определение содержания кальция в известняке, доломите методом кислотно-основного титрования.
- •46. Определение гигроскопической влаги, п.П.П. В цементе, гипсе гравиметрическим методом.
- •47. Определение содержания СаО, МgO гравиметрическим методом. Расчёт.
- •48. Определение содержания СаО, МgO, Fe2o3 в портландцементе.
- •49. Определение содержания Fe2o3 фотоколориметрическим методом.
33. Термический анализ. Термограмма. Метод дта. Экзо– и эндотермические химические процессы. Определение Сn, n, скорости реакции при Ts.
Термический анализ–анализ, основанный на термохимии, позволяющий фиксировать изменение энергетического состояния вещества при постоянной или изменяющейся температуре. Термограмма–графическое изображение изменений физических свойств образца при нагревании.
Указывается:
–m пробы=0,5г;
–Тнач–Тконеч= 20–1000ºС;
–скорость подъема температуры N=dT/dτ=10ºС/мин.
Температура регистрируется в виде дифференциальной (ΔТ=f(τ)) и интегральной (Т=f(τ)) кривой в системе координат Т–τ.
Метод ДТА–дифференциально–термический анализ–основан на сравнении термических свойств образца с эталоном. Регистрируемым параметром служит разность температур. ΔТ=Тобр–Тэталона
а) ΔН=0
интегральная кривая Дифференциальная кривая


б) Δ Н>0(поглощение тепла)–экзотермические химические процессы


(.)А–начало термоэффекта, (.)В–конец термоэффекта, (.)S–max развитие реакции, площадь под кривой=ΔН
1.фазовый переход, 2.окисление
в) Δ Н<0 (выделение тепла)- эндотермические химические процессы
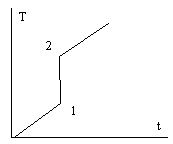

1.процессы дегидратации, 2.термическое разрушение с выделением газообразной фазы
34. Метод дта. Определение содержания химически связанной воды в цементном камне.
Метод ДТА–дифференциально–термический анализ–основан на сравнении термических свойств образца с эталоном. Регистрируемым параметром служит разность температур. ΔТ=Тобр-Тэталона ; ΔТ=f(τ) –функция по времени. Определение содержания химически связанной воды в цементном камне.
Зная химическую формулу, тепловой эффект можно определить содержание химически связанной воды.
Дано: m навески, Wo, Ws, Wf, AS2H2→AS2+2H,
1. определяют Δm как разность в конечной и начальной точке эндоэффекта Δm= Wf–Wo;
2. определяют массу воды практическую, определяют экспериментально по кривой ТГ X=Δm пр=Δm*М(AS2H2)/m(навески);
3. определяем количество моль химически связанной воды: n(H2O)=Δm(пр)/М(H2O), AS2H3 % погрешности=(n(H2O)теор–n(H2O)пр)*100%/ n(H2O)теор
35. Метод тг, дта. Анализ известняков, доломитов.
ДТА основан на сравнении термических свойств образца с эталоном. Регистрируемым параметром служит разность температур. По кривым Т и ДТА определяют температуры эффекта, по ТГ и ДТГ–потери массы. Определяются точки начала, конца и максимального развития реакции. CaCO3→(T)CaO+CO2, Доломит–СаСО3+MgCO3→CaO+MgO+2CO2.
Процессы идут с изменением массы пробы (улетучивается СО2) и изменением энтальпии (декорбанизация–эндоэффект, Энтальпия реаакции>0).
36. Метод ДТА. Анализ продуктов гидратации С2S.
С2S+nH2O→C2SHn–гидратация; Дегидратация проходит ступенчато C2SHn→С2S+nH2O
37. Метод ДТА. Анализ продуктов гидратации С3S.
С3S+nH2O→C3SHn–гидратация; C3SHn→(380–700)С2SH(n-1)+Ca(OH)2, C2SHn-1→С2S+(n–1)H2O
38. Метод ДТА. Анализ продуктов гидратации С4AF.
C4AF+12H2O→C4AFH12→C3AH6+CFH6,
C3AH6→(T, –4,5H)C3AH1,5→(T, –1,5H)C3A,
CFH6→CFH4→CFH2→CF
39. Метод ДТА. Анализ продуктов гидратации С3A.
C3A+6H2O→C3AH6, C3AH6→(T, –4,5H)C3AH1,5→(T, –1,5H)C3A
40. Метод ДТА. Анализ продуктов гидратации СaSO4*0.5H2O.
CaSO4*0,5H2O+1,5H2O=CaSO4*2H2O.
Двуводный гипс при нагревании обезвоживается:
CaSO4*2H2O→(104–120°С)→βCaSO4*0,5H2O→(180–200°С)→CaSO4.
В дальнейшем не происходит изменения массы образца.
41. Метод ДТА. Определение термической устойчивости минералов (кальцита, магнезита), В/Т отношения.
ДТА основан на сравнении термических свойств образца с эталоном. Регистрируемым параметром служит разность температур.
Определение В/Т:
1. ∆m=Wf –W0, Wf–масса, соответствующая концу эффекта, Wо–масса, соответствующая началу эффекта;
2. Определение процентного содержания воды: ∆m→x, а→100%, отсюда х=%Н2О=∆m*100/а; 3. %-е содержание твёрдой фазы: 100%-(% Н2О).
4. Определение числа молей воды и твёрдой фазы: n=% Н2О/М(Н2О), nтв.ф.=%тв.ф./М(ТВ.ф.) 5. В/Т=(Wf –W0 )/(а–(Wf-–W0))
42. Химический анализ. Общая схема аналитического определения. Классификация количественных химических анализов по массе, по свойству определяемого вещества. Метод исследования, основанный на разложении данного вещества на более простые составляющие называется анализом. Химический анализ может быть качественным и количественным. Качественный позволяет установить из каких элементов, ионов, групп атомов или молекул состоит вещество. Количественный позволяет установить количественное соотношение частей вещества, определить количественное соотношение компонентов или общее содержание вещества в продукте. В зависимости от природы определяемого компонента различают элементный, функциональный, молекулярный, изотопный, фазовый либо вещественный анализ.
По массе исследуемого вещества различают:
1. макрометод, а=0,1г;
2. полумикрометод, а=0,1–0,01г;
3. микрометод, а=0,01–0,001г;
4. ультрамикрометод, а=10-6г;
5. субмикрометод, а= 10-7–10-10г.
По свойству определяемого вещества:
1. гравиметрический (масса);
2. фотометрический (I/I0–интенсивность спектра);
3. потинциометрический (Э.Д.С.)
Схема аналитического определения:
1) отбор и усреднение пробы, взятие пробы;
2) вскрытие пробы;
3) выделение определяемого компонента;
4) количественное измерение;
5) расчет
