
- •Термодинамиканың негізгі түсініктері мен анықтамалары.
- •Термодинамиканың бірінші заңы, оның анықтамалары мен аналитикалық өрнектері.
- •Гесс заңы , оның термодинамикалық негізделуі.
- •Ішкі энергия және энтальпия, олардың өзара байланысы.
- •9. Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеу жолдады.
- •10. Идеал газдар қатысымен өтетін әр түрлі процестер үшін термодинамиканың бірінші заңы.
- •11)Термод-ң 2ші заңы.Оның анықтамалары ж/е матем-қ өрнектері. Қайтымды ж/е қайтымсыз процестердің энтропиясының өзгерісі.
- •13) Тұрақты қысым кезде процес жылуының темп-ға тәуелділігін қарастырамыз.
- •14. Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеу жолдады.
- •15. Идеал газдар қатысымен өтетін әр түрлі процестер үшін термодинамиканың бірінші заңы.
- •20.Қайтымды ж/е қайтымсыз процестердің энтропиясының өзгерісі.
- •21.Энтропияны процесс бағытының критериі (белгісі) ретінде қолдану.
- •23) Идеал газдар қатысымен өтетін әр түрлі процестер энтропиясының өзгерісін есептеу жолдары.
- •24) Заттың абсолютті энтропиясының температураға тәуелділігі.
20.Қайтымды ж/е қайтымсыз процестердің энтропиясының өзгерісі.
Қайтымсыз
процестер үшін энтропияның өзгерісі
процестің жылуымен мына теңсіздіктер
арқ
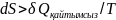 н/е
н/е
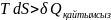 (1)
(1)
 (2)
(2)
 ж/е
T
ж/е
T (3)
(3)
байланысқан.Сондықтан мәліметтер б-ша қайтымсыз процестердің энтропиясын есептеуге болмайды.Бірақ қайтымды ж/е қайтымсыз процестерде энтропия өзгерісі бірдей б/ды,өйт энтропия күй функциясы. Сонда реал қайтымсыз процестің энтрописын есептеу үшін процесті ойша қайтымды етіп жүргізіп,қайтымды процес үшін энтропия теңдеуімен оның өзгерісін есептеуге б-ды.Әртүрлі процестер үшін энтропия өзгерісін есептеу:
1.Кез-келген
заттың изотермиялық процесі
үшін(Т=const).Ойша изотермиялық процесті
қайтымды етіп жүргізіп,энтропия
өзгерісін мына теңдікпен есептейміз:
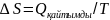
2.Тұрақты
көлемде кез келген затты Т1
темп-дан Т2
темп-ға
қыздырған кезде.Бұл жағдайда процестің
жылуы күй функциясының қасиеттеріне
ие б/ды ж/е процес жолына тәуелсіз б/ды. теңдігендегі
теңдігендегі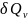 шамасын
шамасын
 теңдігіне қойсақ мына теңдік шығады:
теңдігіне қойсақ мына теңдік шығады:
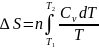
Егер
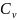 =
const деп жуықтасақ,онда
=
const деп жуықтасақ,онда
 тең болады.
тең болады.
3.Тұрақты
қысым кезде(p=const):
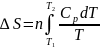
Егер
=
const
б/са,онда
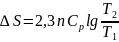
4.Идеал газдарға арналған әртүрлі процестер үшін энтропия өзгерісі мына теңдіктерден шығады: ж/е
Сонда:
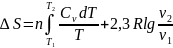
Егер
=
const
б/са,онда
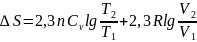
Идеал
газ үшін
=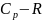 ж/е
ж/е
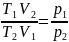 екенін ескере отырып теңдікті былай
жазуға да болады:
екенін ескере отырып теңдікті былай
жазуға да болады: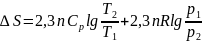
Изотермиялық
процесте
 =
const ж/е
=
const ж/е
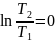 екенін ескере отырып, мына формуланы
қорытамыз:
екенін ескере отырып, мына формуланы
қорытамыз: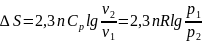
Изохоралық
процесте
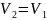 =
const
ж/е
=
const
ж/е
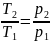 ,сонда
,сонда
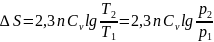
Изобаралық
процесте
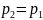 =
const
ж/е
=
const
ж/е
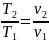 болғандықтан,
болғандықтан,
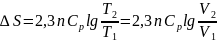
Тұрақты қысым мен темп-да өтетін қайтымсыз химиялық р-яның энтропия өзгерісін анықтау үшін ойша сол р-яны қайтымды етіп жүргізу керек.Сонда
δQ=dU+δA ж/е δAқайтымды=δА’m+pdV теңдіктерінен шығады:
δQқайтымды=dU+ δА’m+pdV
T=const пен p=const болғанда:
δQқайтымды=dH+ δА’m бұдан
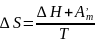 ,мұндағы
-
хим-қ р-яның жылулық эффектісі;
,мұндағы
-
хим-қ р-яның жылулық эффектісі; - хим-қ р-яның максимал пайдалы жұмысы.
- хим-қ р-яның максимал пайдалы жұмысы.
21.Энтропияны процесс бағытының критериі (белгісі) ретінде қолдану.
Энтропия басты қасиеттерінің бірі процесс бағытын көрсететін функция.Оқшауланған жүйеде d S > 0 болса,процесс өздігінен өтеді.Ал егер d S < 0 болса,онда процесс өздігінен өтпейді.Өздігінен өтетін процесстің нәтижесінде жүйе тепе теңдікке ұмтылады.Жүйе тепе теңдікке келгенде S=0 процестер тоқтап энтропия өзінің максимал мәніне ие болады.S=Smax .Сөйтіп оқшауланған жүйенің тепе теңдік күйде дегеніміз энтропия мәні максималға жетіп,одан әрі өзгермеуі болып табылады.Егер жүйе айналадағы ортамен жылу немесе жұмыс алмасу арқылы әсерленетін болса,онда өтетін процестердің нәтижесінде энтропия өсуі де ,кемауі де мүмкін.Сондықтан процестің өту мүмкіндігі мен оның бағыты туралы мәліметтер алу үшін барлық қатысатын денелерді жүйеге кіргізу керек(оның ішінде жылу көзі де) яғни жүйені оқшауланған күйде алу қажет.
Екінші заңның негізгі функциясы – энтропия. Энтропия жүйе күй функциясы, оның қасиеті, олай болса энтропия өзгерісі процестің өту жолына тәуелсіз, тек алғашқы және соңғы күйіне байланысты. Жүйе қасиеті интенсивті және экстенсивті болып екі топқа бөлінетінін білеміз. Ол экстенсивті қасиетке жатады, яғни қосылатын шама. Ол мына теңдеуден түсінікті.
dS=ᵟQ/T Ол Карно циклінде өтетін қайтымды процесс үшін табылған теңдеу. Оны түрлендіріп жазсақ:
 =TdS
=TdS
Мұндағы сол жақтағы шама жылу энергиясының аз мөлшердегі өзгерісі, олай болса оң жақтағы көбейтінді өлшемі де энергия өлшемімен алынады. Абсолюттік температура интенсивті қасиет көрсетеді, ал энтропия экстенсивті қасиетті көрсетеді.
Энтропияның бұл қасиеттерінен бөлек, ол оқшауланған жүйедегі термодинамикалық тепе теңдік күйін анықтайды және энтропия көмегімен процесстің бағытын анықтайды. Егер оқшауланған жүйеде қайтымсыз процесс өздігімен жүрсе, онда мына теңдікке сәйкес
dS>0 және дельта S>0 энтропия шамасы ұлғаяды. Энтропиясы төмендейтін процесстер үшін бұл шарт орындалмайды. Егер процесс тура және кері бағытта да жүретін болса, онда оқшауланған жүйеде энтропия ұлғаятын жаққа қарай бағытталады.Процесс оқшауланған жүйеде өткенде жүйе энтропиясы ұлғаяды да жүйе тепе теңдік күйге ауысады. Жүйеде тепе теңдік күй орнағанда бүкіл процесс тоқтап, энтропия максимал мәнге ие болады. Бұдан оқшауланған жүйедегі тепе теңдік күй бұл максимальды энтропиялы күй болып есептелінеді.
