
- •Термодинамиканың негізгі түсініктері мен анықтамалары.
- •Термодинамиканың бірінші заңы, оның анықтамалары мен аналитикалық өрнектері.
- •Гесс заңы , оның термодинамикалық негізделуі.
- •Ішкі энергия және энтальпия, олардың өзара байланысы.
- •9. Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеу жолдады.
- •10. Идеал газдар қатысымен өтетін әр түрлі процестер үшін термодинамиканың бірінші заңы.
- •11)Термод-ң 2ші заңы.Оның анықтамалары ж/е матем-қ өрнектері. Қайтымды ж/е қайтымсыз процестердің энтропиясының өзгерісі.
- •13) Тұрақты қысым кезде процес жылуының темп-ға тәуелділігін қарастырамыз.
- •14. Әр түрлі температурада химиялық процестің және фазалық ауысулардың жылу эффектілерін есептеу жолдады.
- •15. Идеал газдар қатысымен өтетін әр түрлі процестер үшін термодинамиканың бірінші заңы.
- •20.Қайтымды ж/е қайтымсыз процестердің энтропиясының өзгерісі.
- •21.Энтропияны процесс бағытының критериі (белгісі) ретінде қолдану.
- •23) Идеал газдар қатысымен өтетін әр түрлі процестер энтропиясының өзгерісін есептеу жолдары.
- •24) Заттың абсолютті энтропиясының температураға тәуелділігі.
Гесс заңы , оның термодинамикалық негізделуі.
Гесс заңы химиялық реакцияның жылу эффектісін сипаттайды. Реакцияның жылу эффектісі – жүйенің онда болған химиялық өзгерістер нәтижесінде сіңірген н/е бөліп шығарған жылу энергиясының мөлшері. Жылу эффектісі Q н/е ΔH пен белгіленеді (Q= - ΔH) . Жылу бөлінетін реакциялар (Q>0, ΔH<0) – экзотермиялық, ал сіңіретін реакциялар (Q<0, ΔH>0) – эндотермиялық зеакцияларға жатады. Жылу эффектісі көрсетілген реакция теңдеуі термохимиялық болып табылады: CH4 + 2O2 = CO2 +2H2O + Q (-ΔH)
Термохимиялық
есептеулердің негізінде Гесстің жылу
мөлшерінің тұрақтылығы заңы жатыр:
Процестің жылу эффектісі процестің
өту жолына тәуелсіз, ол тек жүйенің
бастапқы ж/е соңғы күйлерімен анықталады.
Бұл заң термодинамиканың бірінші
заңының тікелей салдары болып табылады.
Бұл заңға сәйкес химиялық реакция жылуы
реакция өнімдерінің түзілу жылуларының
қосындысы мен бастапқы заттардың түзілу
жылуларының қосындысының айырымына
тең: Q реакц
=
 Q
түз.
өнім
-
Qтүз.б.з.
Q
түз.
өнім
-
Qтүз.б.з.
Мұндағы Q түз – 1 моль қосылыстың стандартты жағдайларда ( T =298K, p = 1атм.) жай заттардан түзілу жылуы. Q түз= -ΔН0 дегеніміз заттың стандартты молярлық түзілу жылуы. Тұрақты модификациалы жай заттардың стандартты түзілу жылуы нөлге тең.
Гесс заңының орындалуы мынадай екі шартпен байланысты: 1- жүйеде тек көлем ұлғаю жұмысы жасалуы керек, ол сыртқы қысымға қарсы жұмсалатын жұмыс; 2 – процесс не қысым не көлем тұрақты жағдайда өтуі керек. Гесс заңына мысал ретінде аммоний хлоридінің судағы ерітіндісін алудың жолын қарастырайық. Бұл ерітіндіні екі жолмен алуға болады. Бірінші жол:
NH3
(газ)
+ aq
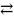 NH.3*aq
+ ΔH1
NH.3*aq
+ ΔH1
HCl (газ) + aq HCl*aq + ΔH2
NH.3*aq + HCl*aq NH4Cl*aq + ΔH3
Екінші жол: NH3 (газ) + HCl (газ) NH4Cl (қатты)+ ΔH4
NH4Cl (қатты) + aq NH4Cl*aq + ΔH5
Гесс заңы бойынша ΔH1 + ΔH2 + ΔH3 = ΔH4 + ΔH5. Гессзаңынан мынадай қорытындылар алуға болады:
Заттың түзілу жылуының мәні оның алғашқы заттардан алыну жолына тәуелді емес;
Заттың алғашқы заттарға ыдрайу жылуы оның осы заттардан түзілу жылуына тең, тек таңбалары қарама-қарсы.
Екі түрлі жүйедегі өтетін процестердің нәтижесінде бірдей заттар түзілетін болса бұл процесстер жылуларының айырымдары біреуінің екінші күйге ауысу жылуына тің болады.
Ішкі энергия және энтальпия, олардың өзара байланысы.
Ішкі энерия – денені құратын бөлшектердің кинетикалық және потенциалдық энергияларының қосындысы. Кинетикалық энергия бөлшектердің хаосты жылу қозғалысының нәтижесі. Жылу қозғалысы температурамен байланысты. Дененің потенциалдық энергиясы бөлшектердің бір-бірімен әрекеттесуіне байланысты. Бөлшектер арасында тартылу ж/е тебісу күштері болады. Құрамы бір текті денелердің ішкі энергиясы оның массасына, бөлшектердің жалпы санына пропорционалды, яғни дененің энергиясы аддитивті шама. Толық әшкә энергияны беретін энергия түрлері молекула, атом, электрон, протон, т.б. элементарлы бөлщектердің өзара әсерлесуімен байланысты. Сондықтан дененің ішкі энергиясының абсолютті мәнін табуға болмайды.
Энтальпия н/е жылу эффектісі - жүйенің онда болған химиялық өзгерістер нәтижесінде сіңірген н/е бөліп шығарған жылу энергиясының мөлшері. Энтальпия Qр н/е ΔH пен белгіленеді (Qр = - ΔH) .Жылу бөлінетін реакциялар ( ΔH<0) – экзотермиялық, ал сіңіретін реакциялар ( ΔH>0) – эндотермиялық зеакцияларға жатады. Жылу эффектісі көрсетілген реакция теңдеуі термохимиялық болып табылады:
CH4 + 2O2 = CO2 +2H2O + -ΔH.
Химиялық заттардың түзілу жылулары стандартты жағдайларда алынады. Стандартты түзілу энтальпиясы - стандартты жағдайда 1 атм. Қысымда, жай заттардан бір моль затты алу кеткен жылу мөлшері.
Енді оның ішкі энергиямен байланысын көрсету үшін термодинамиканың бірінші заңының өрнегін пайдаланымыз: Q = ΔU - pΔV → Q = UT1 – UT2 + p V2 –рV1→ Q =(UT2 + p V2) – ( UT1 +рV1 )
Бұндағы p ж/е V жүйені сипаттайтын параметрлер, ал U жүйенің күй функциясы. Олай болса, U+рV шамасы да күй функциясы, ал оның өзгеруі процестің жолына тәуелсіз болады, ол тек процестің бастапқы ж/е соңғы күйімен байланысты. Бұл Н =U + p V теңдігі энтальпияға тең.
H2 – H1 = ΔH = QP ж/е U2 – U1 =ΔU = QV. Яғни энтальпия ΔH = QP тұрақты қысым кезіндегі жылу эффектісі, ал ішкі энергия ΔU = QV тұрақты көлем кезіндегі жылу эффектісі.
Энтальпия өзгерісі тәжірибе жолымен оңай анықталады. Сол себепті бұл функцияны термодинамикада жиі қолданады. Ішкі энергияның да, энтальпияның да абсолют мәні табылмайды, оның тек соңғы өзгерісін ғана анықтауға болады. Екеуі де экстенсивті қасиеттерге жатады, яғни қосылады.
Гесс заңының салдары бойынша химиялық реакция жылу эффектісін есептеу. Гесс заңы - процестің жылу эффектісі процестің өту жолына тәуелсіз, ол тек жүйенің бастапқы ж/е соңғы күйлерімен анықталады. Бұл заңға сәйкес химиялық реакция жылуы реакция өнімдерінің түзілу жылуларының қосындысы мен бастапқы заттардың түзілу жылуларының қосындысының айырымына тең: Q реакц = Q түз. өнім - Qтүз.б.з.. Ал бұл заңнан шығатын салдар: 1- Заттың түзілу жылуының мәні оның алғашқы заттардан алыну жолына тәуелді емес;2-Заттың алғашқы заттарға ыдрайу жылуы оның осы заттардан түзілу жылуына тең, тек таңбалары қарама-қарсы. 3- Екі түрлі жүйедегі өтетін процестердің нәтижесінде бірдей заттар түзілетін болса бұл процесстер жылуларының айырымдары біреуінің екінші күйге ауысу жылуына тең болады.
Гесс заңына негізделіп белгісіз реакциялардың, тіпті іс жүзінде жүрмейтін реакциялардың жылу эффектілерін есептеуге болады. Ол үшін келесі әдістерді пайдалануға болады:
а. Химиялық реакцияларды үйлестіру арқылы керекті реакцияның жылу эффектісін табу әдісі. Мысал қарастырайық. Берілген реакциялардың жылу эффектісі берілген дейік:
1. С (графит) + О2(газ) = СО2 (газ) + ΔН1
2. СО(газ) +1/2 О2 = СО2 + ΔН2
Осы екі реакция арқылы
. С (графит) + 1/2О2(газ) = СО (газ) реакциясының жылу эффектісін табуға болады, ол үшін бірінші теңдеуден екінші теңдеуді алып тастаймыз: . С (графит) + О2(газ) - СО(газ) - 1/2 О2 = СО2 - СО2
С (графит) + 1/2О2(газ) - СО(газ) = 0
С (графит) + 1/2О2(газ) = СО(газ) Сонда бұл реакцияның жылу эффектісі ΔН3 =ΔН1 – ΔН2
ә. Реакцияға қатысқан заттардың жану жылуларының көмегімен реакцияның жылу эффектісін табу әдісі. Гесс заңынан шығатын салдар бойынша реакцияның жылу эффектісі реакцияға қатысатын заттардың жану жылуларының алгебралық қосындысына тең. Заттың жану жылуы деп осы заттың оттегімен әрекеттесіп жоғарғы оксидтер бергендегі реакцияның жылуы. Жану жылуы 1 моль затқа келтіріледі. Реакцияның жылу эффектісі реакцияға түскен заттардың ж/е реакция өнімдерінің жану жылуларының қосындысының айырымына тең.: ΔHro = ΣΔ HС0,298, (түскен зат) – ΣΔНС0,298, (шыққын зат ). Мысал қарастырайық: ацителеннен 298К де бензолдың түзілу реакциясының жылу эффектісін табу керек. Ол үшін ацителеннің ж/е бензолдың жану жылуларын білу керек 3С2Н2 (газ) = С6Н6 (сұйық) Осы жерде ΔНr0,298, = 3 ΔНС0,298, (С2Н2) - ΔНС0,298 (С6Н6)
б. Реакцияға қатысатын заттардың түзілу жылуларының көмегімен реакцияның жылу эффектісін табу әдісі. Гесс заңынан шығатын тағы да бір салдар бойынша реакцияның жылу эффектісі реакцияға қатысатын заттардың түзілу жылуларының алгебралық қосындысына тең. Заттың түзілу жылуы деп жай заттардан 1 моль зат түзілгендегі жылуды аламыз. Анықтамалықтарда келтірілген заттардың түзілу жылулары стандартты жағдайларда алынады. Стандартты жағдайда ол ΔНf0,298 деп белгіленеді. . Реакцияның жылу эффектісі реакция өнімдерінің ж/е реакцияға түскен заттардың жану жылуларының қосындысының айырымына тең.: ΔHro = ΣΔ Hf0,298, (шыққын зат) – ΣΔНС0,298, (түскен зат). Мысал қарастырайық С2Н4(газ) + Н2О (газ) =С2Н5ОН (газ), Осыдан этанолдың түзілу реакциясының жылу эффектісі ΔНr0,298, = ΔНf0,298, (С2Н5ОН) – {ΔНf0,298 (С2Н4) + ΔНf0,298 (Н2О) }
6.
Заттың жылусыйымдылығы, белгіленуі,
өлшем бірлігі және әртүрлі факторларға
тәуелділігі. Заттың
бір грамының не бір молінің температурасын
бір градусқа көтеру үшін жұмсалатын
жылу мөлшерін жылу сыйымдылық деп
атайды. Заттардың жылу сыйымдылығы
температураға тәуелді , сондықтан жылу
сыйымдылықтың мәні нақтылы және ор
таша болып екіге бөлінеді. Нақтылы ж.
деп берілген температурудағы жүйенің
жылу сыйымдылғын айтады.: С=ᵟQ/dT. Орташа
ж. деп берілген екі температура аралығында
оның мәнін айтады:
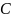 =
Q/(
=
Q/( )=Q/дельтаT
)=Q/дельтаT
Q
 қыздыру үшін қажетті жылу мөлшері.
қыздыру үшін қажетті жылу мөлшері.
Заттың
бір грамына тиісті жылусыйымдылық
меншікті ж. ал бір моліне тиісті мольдік
жылусыйымдылық деп аталады. Термодинамикалық
жүйелер үшермодинамикалық жүйелер
үшін жылусыйымдылықтың шамасы жүйеде
өтетін процестің түріне байланысты.
Изохоралық процесс жылусыйымдылығы
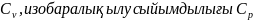 деп белгілейді. Жалпы, тұрақты қысым
не көлемдегі жылусыйымдылық жүйе
қасиеті болып, оның күй функциясына
айналады. Ж.қа температура үлкен әсер
етеді. Бірақ температураның әсерін
термодинамика заңдары тұрғысынан
анықтауға болмайды. Ол тек тәжірибе
арқылы табылады. Ж.тың температураға
тәуелділігі дәрежелік қатарлармен
беріледі. Мысалы: нақтылы және орташа
жылусыйымдылықтардың температураға
тәуелділігі былай жазылады:
деп белгілейді. Жалпы, тұрақты қысым
не көлемдегі жылусыйымдылық жүйе
қасиеті болып, оның күй функциясына
айналады. Ж.қа температура үлкен әсер
етеді. Бірақ температураның әсерін
термодинамика заңдары тұрғысынан
анықтауға болмайды. Ол тек тәжірибе
арқылы табылады. Ж.тың температураға
тәуелділігі дәрежелік қатарлармен
беріледі. Мысалы: нақтылы және орташа
жылусыйымдылықтардың температураға
тәуелділігі былай жазылады: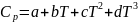
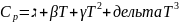
a,b,c,d заттардың табиғатына байланысты коэффициенттер.
7.Меншікті және нақты жылусыйымдылықтар, олардың өзара байланысы. Заттың бір грамының не бір молінің температурасын бір градусқа көтеру үшін жұмсалатын жылу мөлшерін жылу сыйымдылық деп атайды. Заттардың жылу сыйымдылығы температураға тәуелді , сондықтан жылу сыйымдылықтың мәні нақтылы және ор таша болып екіге бөлінеді. Нақтылы ж. деп берілген температурудағы жүйенің жылу сыйымдылғын айтады.: С=ᵟQ/dT. Орташа ж. деп берілген екі температура аралығында оның мәнін айтады: = Q/( )=Q/дельтаT
Q қыздыру үшін қажетті жылу мөлшері Заттың бір грамына тиісті жылусыйымдылық меншікті ж. ал бір моліне тиісті мольдік жылусыйымдылық деп аталады. Термодинамикалық жүйелер үшермодинамикалық жүйелер үшін жылусыйымдылықтың шамасы жүйеде өтетін процестің түріне байланысты. Изохоралық процесс жылусыйымдылығы деп белгілейді. Жалпы, тұрақты қысым не көлемдегі жылусыйымдылық жүйе
