
- •Введение
- •Часть I клиническая физиология главных синдромов критических состояний
- •Глава 1
- •Физиологические эффекты гиповолемии
- •Функциональные критерии
- •Глава 2 острая дыхательная недостаточность
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Свертывание крови и фибринолиз
- •Первичная адгезия и агрегация
- •Реакция освобождения и вторичная агрегация
- •Принципы интенсивной терапии
- •Глава 4 гепаторенальный синдром
- •Физиологические механизмы
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Глава 5 острая церебральная недостаточность
- •Физиологические механизмы
- •Функциональные критерии
- •Прогноз неврологического статуса
- •Принципы интенсивной терапии
- •Глава 6 болевой синдром
- •Физиологические механизмы
- •Принципы интенсивной терапии
- •Глава 7 операционный стресс
- •Функциональные критерии
- •Принципы физиологической защиты
- •Глава 8 нарушение метаболизма
- •Пути управления метаболизмом
- •Нарушение осмол яркости и водно-электролитного баланса
- •Часть II клиническая физиология методов интенсивной терапии, анестезии и реанимации
- •Реанимация при остановке сердца и дыхания
- •Г л а в а 11 инфузионная и трансфузионная терапия
- •Инфузия медикаментов
- •Парентеральное питание
- •Методы инфузионной терапии
- •Глава 12 вспомогательное кровообращение
- •Метод контрпульсации
- •Шунтирование желудочков
- •Функциональные эффекты
- •Глава 13 респираторная терапия
- •Оптимизация естественных механизмов дренирования мокроты
- •Глава 14 антигипоксическая терапия (ингаляционная, трансфузионная и медикаментозная)
- •Ингаляционная оксигенотерапия
- •Гипербарическая оксигенация
- •Энтеральная оксигенация
- •Трансфузионая оксигенация
- •Искусственная вентиляция легких
- •Клинико-физиологические аспекты процедуры искусственной вентиляции легких
- •Объективные критерии
- •Глава 16 искусственная миоплегия
- •Миорелаксанты и мышечная система
- •Глава 17 детоксикационная терапия
- •Стимуляция естественной детоксикации
- •Искусственная детоксикация
- •Синдроматическая терапия
- •Глава 18 мониторизация
- •Принципы мониторизации
- •Методы и цели
- •Параметры мониторизации
- •Часть III клинико-физиологический анализ итар в повседневной практике
- •Глава 19 акушерство
- •Амниотическая эмболия
- •Эклампсия
- •Глава 20 неонатология и педиатрия
- •Реанимация новорожденных
- •Бронхиолит
- •Синдром внезапной смерти младенца
- •Глава 21 пульмонология Влияние анестезиологического пособия на дыхание
- •Тромбоэмболия легочной артерии
- •Бронхоастматический статус
- •Отек легких
- •Синдром шокового легкого
- •Глава 22 кардиология
- •Внезапная кардиальная смерть
- •Кардиогенный шок
- •Глава 23 гепатология
- •Острая печеночная недостаточность
- •Нефрология Влияние анестезии на функции почек
- •Острая почечная недостаточность
- •Глава 25 гематология
- •Геморрагический шок
- •Глава 26 неврология и нейрохирургия
- •Эпилептический статус
- •Столбняк
- •Поражение головного мозга
- •Поражение спинного мозга
- •Глава 27 гастроэнтерология
- •Острейший гастроэнтерит
- •Травматология
- •Травматический шок
- •Синдром жировой эмболии
- •Газовая эмболия
- •Глава 29 иммунологические аспекты практики итар
- •Аллергия в практике итар
- •Анафилактический шок
- •Септический шоковый синдром
- •Список литературы
- •Оглавление
- •Часть I. Клиническая физиология главных синдромов критических состояний ..........……………………………………….. 12
- •Глава 1. Нарушение реологии крови и острая гиповолемия .…………….. 12
- •Глава 2. Острая дыхательная недостаточность ...…………………………... 30
- •Глава 11. Инфузионная и трансфузионная терапия ....……………………… 141
- •Глава 21. Пульмонология ...........………………………………………………….. 250
- •Глава 28. Травматология . . . .......………………………………………………….. 341
- •Глава 29. Иммунологические аспекты практики итар ..…………………….. 351
Геморрагический шок
Физиологические механизмы. Мы перечислим функции крови для того, чтобы осмыслить механизмы танатогенеза и меры интенсивной терапии при геморрагическом шоке.
1. Транспортная функция крови — важнейшая, но далеко не единственная среди многих задач, которые выполняет кровь. Благодаря транспортной функции крови совокупность тесно сколоченных, органов превращается в организм, качественно новую форму. Кровь транспортирует: а) газы между легкими и прочими органами и тканями; б) энергетические вещества и продукты метаболизма клеток, подлежащие передаче в другие органы, чтобы поддерживать функции этих органов или подвергнуться, в них деструкции; в) гормоны, ферменты, кинины, простагландины и другие биологически активные вещества, предназначенные для регуляции метаболизма в каком-либо органе или уже выполнившие свою регуляторную функцию и подлежащие удалению из тканей.
2. Буферная функция крови нередко приравнивается к транспортной, хотя в действительности это не совсем так. Кровь имеет в своем: составе мощные буферные системы поддержания кислотно-щелочного состояния, электролитного и осмотического баланса. Не просто передача кислых или щелочных продуктов и различных ионов из одного места в другое, но активное изменение рН среды (белковый, гемоглобиновый и другие буферы), смещение электролитов между плазмой, тканевой жидкостью и клетками, обеспечивающее возможность передачи информации в организме методом деполяризации и реполяризации клеток, поддержание осмотического баланса немедленной продукцией или, наоборот, деструкцией осмотически активных ионов — вот схематическое, далеко не полное изложение буферирующей функции крови.
3. Иммунная функция крови заключается в продукции антител, фагоцитов, биофизической блокаде инородных микроорганизмов. Надо ли удивляться, чтосептическое состояние может оказаться закономерным следствием геморрагического шока?
4. Самоеохраняющая функция крови предназначена для поддержания крови в жидком состоянии, чтобы она могла выполнять свои остальные функции и вместе с тем не вытечь из сосудистого русла, если его целость где-то нарушится. Самосохраняющая функция крови обеспечивается системами гемостаза и фибринолиза, а их нарушение ведет к коагулопатии — частому завершению геморрагического синдрома.
Рассмотрев эти важнейшие функции крови, мы можем оценить те физиологические сдвиги и их клинические проявления, которые произойдут в организме при кровопотере.
Во-первых, возникает гиповолемия с нарушением реологических свойств крови и ее секвестрацией в капиллярных системах. Из-за секвестрации крови исходный ОЦК 5 л после кровопотери 1 л окажется равным не 4 л, а лишь 3—3,5 л, потому что какой-то объем крови секвестрируется в капиллярных системах.
Во-вторых, развиваются генерализованные расстройства метаболизма — нарушаются окислительно-восстановительные процессы, появляется метаболический ацидоз, изменяется электролитный состав тканей, онкотическое давление и т. д.
В-третьих, ишемия органов приводит к органным расстройствам— почечной, печеночной, легочной (подчеркиваем, легочной, а не просто дыхательной недостаточности!), нарушению функций миокарда, кишечника и т. д.
В-четвертых, обостряются или появляются вновь инфекционные болезни и гнойно-септические поражения и, наконец, в-пятых, возникает коагулопатия по типу синдрома рассеянного внутрисосудистого свертывания.
Часть этих патологических эффектов дает некоторое представление о сложности танатогенеза геморрагического шока (рис. 47).
Принципы интенсивной терапии. Геморрагический шок — это следствие невозмещенной или несвоевременно возмещенной кровопотери, следовательно, своевременное возмещение кровопотери — лучшее средство профилактики геморрагического шока, но не интенсивной терапии, когда он уже развился. В этом случае приходится не только возмещать кровопотерю, но и лечить расстройства, связанные с нарушением функций организма, возникшие в тот опасный момент, пока кровопотеря не была возмещена.
Мерами интенсивной терапии геморрагического шока являются восполнение ОЦК, коррекция метаболизма, лечение или профилактика органных расстройств, коагулопатии и септических осложнении.
Восполнение ОЦК. Геморрагический шок есть следствие острой кровопотери, потому что при хронической кровопотере возникает анемия с сопутствующими ей осложнениями, а не геморрагический шок. При восполнении острой кровопотери первостепенная задача — нормализация объема, а затем уже и качества крови. Рассматривая этот раздел интенсивной терапии геморрагического шока, мы должны ответить на три вопроса: что вливать, сколько вливать и куда вливать.
Что вливать. Инфузию удобнее начинать с реополиглюкина. Во-первых, он всегда годен к немедленному употреблению, во-вторых, является удовлетворительным плазмонаполнителем и, в-третьих, обладает дезагрегационными свойствами и возвращает в сосудистое русло часть собственной крови больного, секвестрированной в системах микроциркуляции.
Пока вливают реополиглкжин, для переливания готовят кровь, инфузия которой чередуется с другими жидкостями, так что в общей сложности при восполнении ОЦК в связи с геморрагическим шоком переливаемый объем состоит приблизительно на 60% из крови и на 40% — из других жидкостей.
К прочим жидкостям, помимо уже упомянутого реополиглюкина, относятся кристаллоидные растворы, содержащие дозы электролитов, необходимые для восполнения тканевой жидкости по количеству и составу: лактасол, раствор Гартмана и др.
Учитывая низкое онкотическое давление крови при геморрагическом шоке, необходимо к инфузируемым растворам добавить белки, в первую очередь альбумин. О переливании крови, методах и режимах см. главу 11.
Сколько вливать. Вопрос об объеме трансфузий при интенсивной терапии геморрагического шока должен был бы решаться с учетом объема кровопотери, секвестрации, метаболических изменений. Но всегда ли можно определить объем кровопотери и тем более секвестрации? Да и зачем их определять, если главный принцип управления — наличие обратной связи с управляемым объектом: сделав что-то и получив информацию об эффекте, мы продолжаем воздействие или меняем его режим. Так и должно быть при определении объема трансфузий: его можно запрограммировать лишь очень приблизительно. Точное определение объема зависит от исходной величины и изменения по ходу трансфузии ЦВД, артериального давления, содержания гемоглобина, гематокрита и ОЦК.
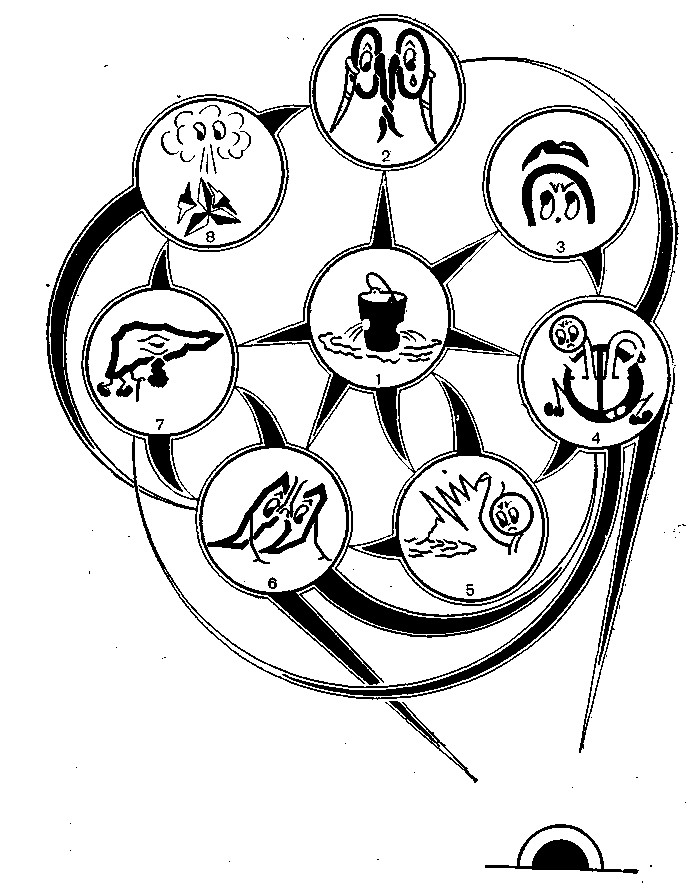
Рис. 47. Физиологические механизмы геморрагического шока.
В результате кровопотери (1) возникают острая почечная (2), надпочечниковая (3), миокардиальная (4) недостаточность, коагулопатия (5), острая дыхательная недостаточность по типу синдрома шокового легкого (6), острая печеночная недостаточность (7) и иммуносептические расстройства (8).
Невозможно нормализовать ОЦК при геморрагическом шоке одномоментным действием. Как правило, это многочасовая или многодневная процедура, включающая не только трансфузию, но также и воздействие на миокард, коррекцию метаболизма, многое другое.
Куда вливать. Переливание должно проводиться через катетеры, введенные в периферические или центральные вены. В. А. Неговский и представители его школы рекомендуют при острой кровопотере внутриартериальное нагнетание крови, хотя оно и более сложно и чревато дополнительными осложнениями. А. Ф. Николаев (1981) анализировал результаты реанимации при смертельной кровопотере в клинике и подтвердил экспериментальные исследования В. А. Неговского о преимуществе в подобной ситуации внутриартериального пути перед внутривенным.
Коррекция метаболизма. Для геморрагического шока характерны гипопротеинемия, электролитные и кислотно-щелочные нарушения. Чаще наблюдается метаболический ацидоз, но бывает и метаболический алкалоз, связанный с пассажем нитрата натрия через здоровую печень и превращением его в лактат натрия. Кроме того, метаболический алкалоз может быть следствием гиперальдостеронизма из-за гиповолемии. Коррекция метаболизма при геморрагическом шоке должна проводиться при тщательном исходном и текущем контроле биохимических показателей крови.
Лечение органных расстройств. Чаще всего при геморрагическом шоке поражаются легкие, почки, печень, миокард, надпочечники. Возникающая патология органов может быть связана не только с самим геморрагическим шоком, но и с массивным крововозмещением, к которому приходится прибегать.
Если не считать осложнений, относящихся к технике трансфузий (флебиты, воздушная эмболия, пневмоторакс при катетеризации подключичной вены и др.), то наиболее частые осложнения и следствия геморрагического шока или его интенсивной терапии таковы: СШЛ, ОПН, острая печеночная недостаточность, синдром РВС, СМК, СШС. Все эти синдромы рассмотрены в соответствующих главах руководства. Необходимо отметить, что антибиотики, глюкокортикоидные гормоны, форсированный диурез, специальная респираторная терапия показаны почти во всех случаях тяжелого геморрагического шока и не следует опаздывать с их применением; надо чтобы геморрагический синдром уже исчез, а новый еще не возник.
Синдром массивного крововозмещения
В практике ИТАР есть две наиболее частые ситуации, при которых может возникнуть синдром массивного крововозмещения (СМК): 1) инфузионная терапия геморрагического шока при большой кровопотере; 2) операция замещения крови, для которой мы сегодня находим одно единственное показание: выраженный гемолиз при уже не работающих почках.
Не существует четкой градации, позволяющей решить, какой объем перелитой крови подходит под определение массивное крововозмещение. Мы считаем тайим критическим объемом крововозмещение, превышающее половину нормального. ОЦК. Мы проводили несколько десятков крововозмещений свыше 10— 15 л, максимальный объем крововозмещения с благоприятным исходом был 23 л крови (не считая прочих жидкостей).
Физиологические механизмы. Все опасности, возникающие при массивном крововозмещений и схематически представленные на рис. 48, можно разделить на четыре взаимосвязанные группы явлений: действие патологических факторов трансфузируемой крови, непосредственные реакции организма на кровь, развитие главных синдромов, возникновение органных расстройств.
Многообразное переплетение этих эффектов массивной гемотрансфузии создает несколько наиболее частых клинико-физиологических ситуаций, опасных для жизни больного.
Первая (по крайней мере, по времени наступления) опасность — это несовместимость крови. Можно утверждать, что при массивном крововозмещении эта опасность почти всегда превращается в осложнение, потому что мы проверяем совместимость крови донора и реципиента, но не доноров друг с другом. А их при массивном крововозмещении может быть более 10—15 человек.
Физиологические следствия несовместимости крови могут быть определены достаточно четко: 1) нарушаются реологические свойства крови, и в результате агрегации клеток происходит секвестрация крови в системах микроциркуляции. Все это ведет к гиповолемии, метаболическому ацидозу, органным расстройствам; 2) развивается внутрисосудистый гемолиз как результат цитолитической реакции антиген — антитело. Последствия гемолиза укладываются в синдромы РВС, острой печеночной и почечной недостаточности, нарушения электролитного баланса и кислотно-щелочного состояния.
В названные два физиологических следствия несовместимости крови при массивном крововозмещении можно уложить все клинические варианты, встречающиеся в практике: озноб, лихорадку, гемотрансфузионный шок, коагулопатические кровотечения, острую почечную недостаточность и др. При смертельном исходе из-за переливания несовместимой крови, наступившем в первые часы, главными механизмами танатогенеза являются гемолиз и коагулопатическое кровотечение, а не ОПН.
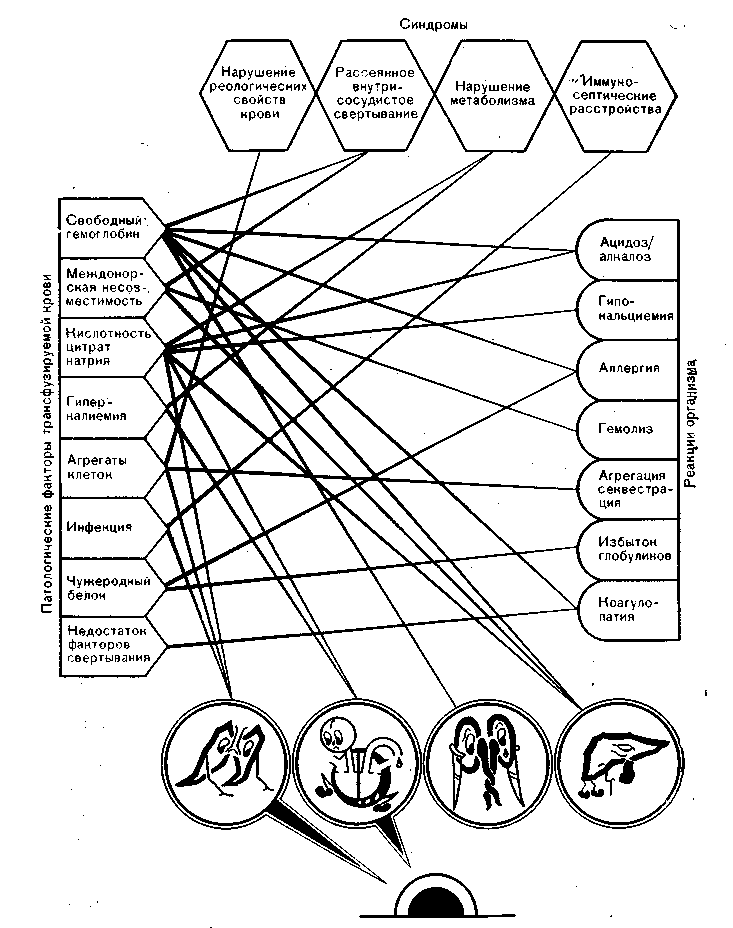
Рис. 48. Функциональные расстройства при синдроме массивного крововозмещения.
Л. А. Сумбатов и соавт. (1980) вообще считают, что особого синдрома массивного крововозмещения не бывает, а возникает просто синдром гемотрансфузионной несовместимости. Такой взгляд представляется слишком категоричным, хотя действительно несовместимость — главный механизм СМК.
Н. А, Федоров и соавт. (1980) ставят вопрос шире: дело не только в несовместимости эритроцитарных факторов крови, но и белковой несовместимости вообще. Они полагают, что в результате белковой несовместимости меняется структура белковых макромолекул и перенос ими различных биологически активных веществ, и нарушается вся система гуморальной регуляции.
Вторая опасность массивного крововозмещения — цитратная интоксикация, поскольку консервированная кровь содержит обычно в качестве консерванта цитрат натрия. При массивном крововозмещении большие дозы цитрата вызывают гипокальциемию, снижают возбудимость миокарда и его сократительную способность, повышают легочное сосудистое сопротивление, способствуя возникновению синдрома шокового легкого. При нормальной функции печени цитрат натрия преобразуется в лактат натрия, вызывая ощелачивание крови и метаболический алкалоз.
Третья опасность — метаболическое несовершенство консервированной крови,в которой при длительном хранении повышена кислотность. При массивном крозовозмещении это может привести к метаболическому ацидозу, особенно если функция печени нарушена, а цитрат натрия не преобразуется в лактат. Гиперкалиемия в связи с эффузией калия из эритроцитов при длительном хранении крови может угнетать возбудимость и сократимость миокарда. К+ плазмы в консервированной крови трехнедельного хранения может достигать 25 ммоль/л, т. е. быть в 5—6 раз выше нормы.
Свободный гемоглобин консервированной крови при массивном крововозмещении оказывает такой же патологический эффект, как при внутрисосудистом гемолизе. Поскольку массивное крововозмещение всегда производится срочно, нередко прибегают к введению крови под давлением, а при внутриартериальном нагнетании это делают всегда. Существует прямо пропорциональная зависимость между давлением, при котором вводится кровь, и степенью гемолиза.
Коагулопатические свойства консервированной крови, ее ограниченная способность к транспорту кислорода и роль температурных различий рассмотрены в главе 11.
Массивное крововозмещение неизбежно повреждает легкие, потому что консервированная кровь содержит большие количества агрегатов клеток и сгустков фибрина, задерживаемых легочным капиллярным фильтром. Физиологическая и морфологическая характеристика легкого при СМК не отличается от синдрома шокового легкого.
В нашей практике не было случаев, чтобы легкие в той или иной степени не повреждались при крововозмещениях свыше 1 л. Именно поэтому ставится вопрос о том, чтобы при переливании консервированной крови всегда использовались специальные микрофильтры, предупреждающие повреждение легких.
Патологические эффекты массивного крововозмещения можно свести к двум физиологическим механизмам и шести взаимосвязанным клиническим последствиям. Механизмы: 1) нарушение реологических свойств и микроциркуляции крови; 2) гемолиз и внутрисосудистое свертывание крови. Клинические последствия: 1) коагулопатическое кровотечение; 2) гиповолемия; 3) острая дыхательная; 4) миокардиальная; 5) печеночно-почечная недостаточность; 6) генерализованное поражение метаболизма.
Принципы интенсивной терапии. Интенсивная терапия СМК должна быть ранней, чтобы успеть предупредить многие опасные физиологические механизмы. Поскольку в начале развития синдрома самые опасные проявления — это внутрисосудистый гемолиз и острая дыхательная недостаточность, начинать надо с двух действий — стимуляции диуреза и респираторной терапии.
Стимуляция диуреза преследует три цели: вывести через почки свободный гемоглобин, снизить интерстициальный отек, в первую очередь легких, и предупредить острую почечную недостаточность.
Респираторная терапия должна начинаться с аэрозольных ингаляций муколитических препаратов, стимуляции кашля и прочих методов улучшения дренажной функции дыхательных путей, поскольку при СМК резко повышается продукция мокроты. Спонтанная вентиляция должна осуществляться в режиме ПДКВ, но во многих случаях приходится применять раннюю ИВЛ, которая необходима для увеличения объема вентиляции, ликвидации отека легких и облегчения туалета дыхательных путей.
Улучщение; реологических и коагулологических свойств крови — важный компонент интенсивной терапии СМК. Оно достигается применением реополиглюкина, ацетилсалициловой кислоты, гепарина. Подобная рискованная терапия не может быть бесконтрольной: специальные методы исследования гемостаза и:фибринолиза являются необходимой составной частью интенсивной терапии СМК.
Массивный внутрисосудистый гемолиз
Массивный внутрисосудистый гемолиз в практике ИТАР может быть вызван двумя механизмами: токсическим действием какого-либо яда или цитолитической реакцией антиген — антитело. С острым внутрисосудистым гемолизом такого рода мы чаще всего всртечаемся при следующих клинических ситуациях: 1) переливании несовместимой крови или массивном крововозмещении; 2) искусственном кровообращении или применении методов интенсивной терапии с перфузией крови через аппараты (гемосорбция, мембранная оксигенация, шунтирование желудочков и др.); 3) оперативном вмешательстве у больных с патологией системы крови (гиперспленизм, серповидноклеточная анемия и др.); 4) септическом шоковом синдроме; 5) отравлении гемолитическими ядами (уксусная эссенция, змеиный и грибной яд, сапонин, фосфор, мышьяковистый водород и др.).
Физиологические механизмы. Если исключить специфические факторы, вызвавшие гемолиз, то дальнейшие физиологические изменения при гемолизе единообразны и зависят лишь от его степени.
Свободный гемоглобин — активный повреждающий фактор для организма. Он захватывается всеми участками ретикулоэндотелиальной системы, которые стремятся трансформировать его в билирубин. Гемоглобин активно выводится печенью и почками. Однако нормальная фильтрация и выделение гемоглобина почками происходят только в щелочной среде. Солянокислый гематин и ферритин в силу своей нефротоксичности очень быстро нарушают диурез.
Физиологические эффекты гемолиза (рис.49): 1. В связи с освобождением из эритроцитов тромбопластина — фактора, быстро активирующего реакцию протромбин — тромбин, начинается рассеянное внутрисосудистое свертывание. Эритроцитарный тромбопластин значительно активнее тромбоцитарного. Кроме того, при гемолизе из эритроцита освобождается ряд других веществ, активно действующих на свертывающую систему крови — серотонин, кинины и др. Перечисленные факторы вызывают синдром РВС. Если его своевременно не пресечь, возникают коагулопатия потребления и кровотечение.
2. Попытка вывести с мочой большие массы свободного гемоглобина, ферритина, и кислого гематина оказывает на почки местное повреждающее действие, усиливаемое расстройствами кислотно-щелочного состояния и гемодинамики.
3. Свободный гемоглобин повреждает гепатоциты и вызывает острую печеночную недостаточность. Желтуха при гемолизе может быть и результатом гипербилирубинемии, связанной с прямой трансформацией гемоглобина, но токсическое воздействие свободного гемоглобина на печень от сочетания с гипербилирубинемией не становится меньшим.
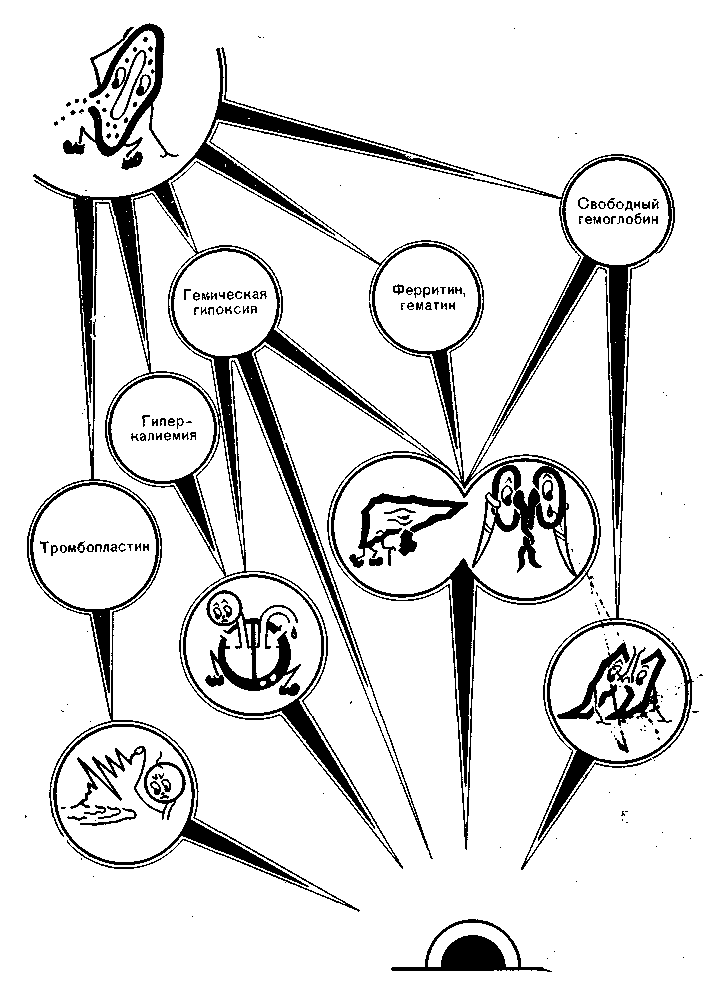
Рис. 49. Физиологические механизмы острого внутрисосудистого гемолиза, заканчивающегося коагулопатией, острой миокардиальной недостаточностью, гепаторенальным синдромом и поражением легких.
4. Освобождение из эритроцитов внутриклеточных ионов приводит к значительным изменениям кислотно-щелочного состояния и электролитного баланса: всегда возникает метаболический ацидоз, гиперкалиемия и другие расстройства.
5. Разрушение большого количества эритроцитов ведет к гемической гипоксии, которая прибавляется к острой дыхательной недостаточности из-за повреждения легких свободным гемоглобином, вызывающим состояние, похожее на синдром шокового лёгкого.
Каждый из перечисленных повреждающих факторов гемолиза может стать главным механизмом танатогенеза. Если же они действуют в совокупности (чаще всего бывает именно так), нежелательная развязка наступает очень скоро. Все же следует иметь в виду, что если больной погибает от внутрисосудистого гемолиза в первые часы, главной причиной смерти чаще всего бывает коагулопатическое кровотечение.
Принципы интенсивной терапии. При внутрисосудистом гемолизе возникают три задачи: прекращение распада эритроцитов, выведение продуктов гемолиза, коррекция органных расстройств и метаболизма.
Прекратить распад эритроцитов — значит ликвидировать условия, вызвавшие гемолиз, т. е. вылечить СШС, извлечь перелитую несовместимую кровь или выпитую уксусную эссенцию. Выполнить все это несколько сложнее, чем рекомендовать.
С целью быстрого в ы в е д е н и я продуктов гемолиза и для профилактики острой почечной недостаточности и коагулопатии надо немедленно стимулировать диурез маннитолом и фуросемидом на фоне гемодилюции реополиглюкином, кристаллоидными растворами и алкалинизации крови и мочи. Маннитол увеличивает почечный кровоток и клубочковую фильтрацию, благодаря чему достигаются два эффекта: удаляется свободный гемоглобин и предупреждается нефронекроз. Подчеркиваем, что достаточное выделение гемоглобина через почки возможно только в щелочной среде. Немедленное введение бикарбоната натрия с первых шагов интенсивной терапии острого гемолиза предпринимается не только для коррекции метаболического ацидоза, но и для удаления свободного гемоглобина из плазмы.
Введение глюкокортикоидных и анаболических гормонов может уменьшить гемолиз и действие свободного гемоглобина на органы и ткани.
При осложненном течении внутрисрсудистого гемолиза требуются дополнительные методы интенсивной терапии. На фоне уже развившейся острой почечной недостаточности, когда содержание свободного гемоглобина плазмы превышает 2 г/л, необходима операция замещения крови, которую иногда приходится повторять несколько раз. Для замещения крови надо использовать одномоментно не менее 3 л одногруппной крови. Продолжающийся внутрисосудистый гемолиз при неспособности почек удалять гемоглобин — это единственное показание к операции замещения крови, которая и сама по себе способна вызвать гемолиз в результате массивного введения крови.
Для замещения кровь удаляют из лучевой или бедренной артерии, пунктируя ее толстой иглой. Вводить свежую кровь надо в центральные вены. Оптимальным является следующий режим кровезамещения: ввести 0,5 л полиглюкина, затем быстро удалить 0,5 л крови, после чего быстро осуществить трансфузию 0,5 л крови. Цикл (без добавления полиглюкина) повторяют 6— 7 раз, чтобы заменить не менее 3 л крови. Если состояние больного позволяет (об этом судят по показателям гемрдинамики), то лучше заменять не по 0,5, а по 1 л крови.
Операция замещения крови требует тщательной непрерывной метаболической коррекции — добавления хлорида кальция, бикарбоната натрия, преднизолона и т. д., поскольку чревата опасностями синдрома массивного крововозмещения. По этой же причине дыхание должно проходить в режиме ПДК.В.
Коррекция органных расстройств: первый жизненно важный орган, функции которого следует нормализовать, это сама кровь. Речь идет отнюдь не о компенсации распавшегося объема эритроцитов: надо немедленно остановить РВС, используя для этого гепарин и применяя все другие меры (см. главу 3).
При неостановленном гемолизе с самого начала может потребоваться ИВЛ с полным комплексом респираторной терапии, потому что синдром шокового легкого присоединяется к гемолитическому синдрому с самого начала.
Если мы не сумеем стимулировать диурез и заставить почки работать в первые десятки минут от начала гемолиза, то позже едва ли справимся с этим: в ближайшие часы наступит нефронекроз. Само по себе присоединение острой почечной недостаточности — достаточно плохое следствие гемолиза. Но еще хуже то, что мы не сможем удалять через почки свободный гемоглобин, а будем вынуждены прибегать к операции замещения крови, эффективность которой в лечении острого гемолиза оставляет желать лучшего.
