
- •Введение
- •Часть I клиническая физиология главных синдромов критических состояний
- •Глава 1
- •Физиологические эффекты гиповолемии
- •Функциональные критерии
- •Глава 2 острая дыхательная недостаточность
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Свертывание крови и фибринолиз
- •Первичная адгезия и агрегация
- •Реакция освобождения и вторичная агрегация
- •Принципы интенсивной терапии
- •Глава 4 гепаторенальный синдром
- •Физиологические механизмы
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Глава 5 острая церебральная недостаточность
- •Физиологические механизмы
- •Функциональные критерии
- •Прогноз неврологического статуса
- •Принципы интенсивной терапии
- •Глава 6 болевой синдром
- •Физиологические механизмы
- •Принципы интенсивной терапии
- •Глава 7 операционный стресс
- •Функциональные критерии
- •Принципы физиологической защиты
- •Глава 8 нарушение метаболизма
- •Пути управления метаболизмом
- •Нарушение осмол яркости и водно-электролитного баланса
- •Часть II клиническая физиология методов интенсивной терапии, анестезии и реанимации
- •Реанимация при остановке сердца и дыхания
- •Г л а в а 11 инфузионная и трансфузионная терапия
- •Инфузия медикаментов
- •Парентеральное питание
- •Методы инфузионной терапии
- •Глава 12 вспомогательное кровообращение
- •Метод контрпульсации
- •Шунтирование желудочков
- •Функциональные эффекты
- •Глава 13 респираторная терапия
- •Оптимизация естественных механизмов дренирования мокроты
- •Глава 14 антигипоксическая терапия (ингаляционная, трансфузионная и медикаментозная)
- •Ингаляционная оксигенотерапия
- •Гипербарическая оксигенация
- •Энтеральная оксигенация
- •Трансфузионая оксигенация
- •Искусственная вентиляция легких
- •Клинико-физиологические аспекты процедуры искусственной вентиляции легких
- •Объективные критерии
- •Глава 16 искусственная миоплегия
- •Миорелаксанты и мышечная система
- •Глава 17 детоксикационная терапия
- •Стимуляция естественной детоксикации
- •Искусственная детоксикация
- •Синдроматическая терапия
- •Глава 18 мониторизация
- •Принципы мониторизации
- •Методы и цели
- •Параметры мониторизации
- •Часть III клинико-физиологический анализ итар в повседневной практике
- •Глава 19 акушерство
- •Амниотическая эмболия
- •Эклампсия
- •Глава 20 неонатология и педиатрия
- •Реанимация новорожденных
- •Бронхиолит
- •Синдром внезапной смерти младенца
- •Глава 21 пульмонология Влияние анестезиологического пособия на дыхание
- •Тромбоэмболия легочной артерии
- •Бронхоастматический статус
- •Отек легких
- •Синдром шокового легкого
- •Глава 22 кардиология
- •Внезапная кардиальная смерть
- •Кардиогенный шок
- •Глава 23 гепатология
- •Острая печеночная недостаточность
- •Нефрология Влияние анестезии на функции почек
- •Острая почечная недостаточность
- •Глава 25 гематология
- •Геморрагический шок
- •Глава 26 неврология и нейрохирургия
- •Эпилептический статус
- •Столбняк
- •Поражение головного мозга
- •Поражение спинного мозга
- •Глава 27 гастроэнтерология
- •Острейший гастроэнтерит
- •Травматология
- •Травматический шок
- •Синдром жировой эмболии
- •Газовая эмболия
- •Глава 29 иммунологические аспекты практики итар
- •Аллергия в практике итар
- •Анафилактический шок
- •Септический шоковый синдром
- •Список литературы
- •Оглавление
- •Часть I. Клиническая физиология главных синдромов критических состояний ..........……………………………………….. 12
- •Глава 1. Нарушение реологии крови и острая гиповолемия .…………….. 12
- •Глава 2. Острая дыхательная недостаточность ...…………………………... 30
- •Глава 11. Инфузионная и трансфузионная терапия ....……………………… 141
- •Глава 21. Пульмонология ...........………………………………………………….. 250
- •Глава 28. Травматология . . . .......………………………………………………….. 341
- •Глава 29. Иммунологические аспекты практики итар ..…………………….. 351
Острая печеночная недостаточность
Наиболее частыми причинами острой печеночной недостаточности в практике ИТАР являются вирусный гепатит, септический шоковый синдром, экзогенные интоксикации, все виды острой гиповолемии.
Функциональные и метаболические расстройства. Вначале мы систематизируем метаболические сдвиги, происходящие при острой печеночной недостаточности, а затем рассмотрим ее главные синдромы.
Meтaболическиe сдвиги. Нарушения белкового обмена заключаются в том, что возникает гипопротеинемия, в связке чем—появляются интерстициальные отеки, асцит, снижается онкотическое давление крови. Асцит и отеки связаны, видимо, не только с гипопротеинемией, но и с внутрипеченочным сосудистым блоком, повышающим давление в системе воротной вены, а также с увеличением содержания альдостерона, снижающего даурез и задерживающего в организме воду.
Особое значение в связи с гипопротеинемией имеет увеличение шунтирования венозной крови через легкие, нарушающее газовый состав артериальной крови и усиливающее гипоксию печени. Этот эффект связан с интерстициальным отеком мелких дыхательных путей, которые поэтому рано закрываются при выдохе (ЭЗДП), альвеолярный шунт возрастает.
Важным следствием нарушения белкового обмена является снижение продукций свертывающих факторов крови (II, V, VII, IХ): поэтому кровотечения, особенно в желудочно-кишечный тракт, характерны для печеночной недостаточности. Их возникновение облегчается весьма нередкой при хронической патологии печени портальной гипертензией, а также эрозиями слизистой оболочки и тромбоцитопенией, связанной с тремя факторами: синдромом РВС, угнетением костного мозга и гиперспленизмом.
Опасные кровотечения – это не только геморрагический синдром, ухудшающий питание печени, но также более выраженная гипопротеинемия, и увеличение продукции аммиака и других агрессивных метаболитов при микробном брожении крови в кишечнике.
К расстройствам белкового обмена относится ухудшение процесса тканевого окисления — гистотоксическая дизоксия. Это происходит из-за нарушения образования трикарбоновых и других кислот, обеспечивающих циклы биологического окисления. Естественно, что в связи с этим изменяется течение окислительно-восстановительных процессов в самой печени.
Важнейшим следствием патологии белкового обмена при печеночной недостаточности является нарушение в печени синтеза мочевины из аммиака.
80% аммиака образуются в кишечнике в результате микробного гидролиза белков. Клиника печеночной комы в определенной мере связана с аммиачной энцефалопатией. Уровень аммиака крови при печеночной недостаточности может увеличиваться в 5 раз. Основным путем удаления аммиака являются легкие, а также почки, где он после соединения с глутаминовой кислотой превращается в глутамин. При наличии портокавальных анастомозов, образовавшихся самопроизвольно или наложенных искусственно, аммиак минует печень, и его путь в мозг облегчается. У некоторой части больных с печеночной комой уровень аммиака не повышен, и это подтверждает, что аммиак — не единственный продукт, вызывающий энцефалопатию при острой печеночной недостаточности. Так же действуют фенолы, метаболиты некоторых аминокислот, да и просто нарушение биологического окисления, т. е. гистотоксическая дизоксия мозга.
В последние годы энцефалопатию при печеночной недостаточности все чаще связывают с образованием так называемых ложных нейромедиаторов — октопамина, β-фенилэтаноламина и некоторых других [Neurotransmitters in cerebral coma and stoke, 1978]. Вытесняя из синапсов ЦНС естественные медиаторы допамин и норадреналин, они нарушают мозговые функции. Какая-то часть этих «ложных нейромедиаторов» образуется при микробном гидролизе белка в кишечнике, но не детоксицируется поврежденной печенью.
Углеводный обмен. В любой момент печень должна быть способна превратить в глюкозу 100—200 г гликогена, чтобы дать энергию для утилизации кислорода. Только для обеспечения основного обмена необходимо, чтобы печень подавала в кровь 2 г глюкозы в час. При печеночной недостаточности эти процессы нарушены и, следовательно, возникают нарушения энергетического баланса и тканевого метаболизма. В нормальном состоянии печень контролирует уровень инсулина и глюкагона; при печеночной недостаточности этот контроль также нарушен. Кроме того, присоединение почечной недостаточности, почти всегда возникающее при тяжелой печеночной, повышает уровень инсулина, 40% которого должны разрушаться почками (см. главу 24). Вследствие этого гипогликемия при печеночной недостаточности встречается часто.
Жировой обмен. При печеночной недостаточности страдает синтез фосфолипидов, в связи с чем в печени откладывается нейтральный жир (его там должно быть не более 5% массы печени), накапливается уксусная кислота (из которой должен синтезироваться холестерин), желчные пигменты.
Кислотно-щелочное состояние и водно-электролитный баланс. В начале острой печеночной недостаточности развивается респираторный алкалоз из-за гипервентиляции, связанной с раздражением различных структур мозга аммиаком и другими метаболитами. Респираторный алкалоз имеет два нежелательных следствия. Во-первых, ухудшается мозговой кровоток, в связи с чем усиливаются центральные расстройства. Во-вторых, гипокапния изменяет диссоциацию оксигемоглобина, из-за чего кислород хуже связывается с гемоглобином в легких и еще хуже отделяется от него в тканях — нарастает тканевая гипоксия мозга, самой печени и остальных тканей.
Однако эти начальные изменения довольно быстро сменяются главными проявлениями острой печеночной недостаточности — метаболическим алкалозом и гипокалиемией, несомненно взаимосвязанными. К+ — внутриклеточный ион. При выходе его из клетки в нее поступает Н+, в связи с чем увеличивается реабсорбция почками бикарбоната. Меняется и дезаминирование в почке глутамина, вместе с которым выводился аммиак.
Нарушения электролитного и кислотно-щелочного состояния снова резко меняются, когда к печеночной недостаточности присоединяется почечная недостаточность, при которой в организме задерживаются К+ и кислые метаболиты. Выраженные расстройства микроциркуляции и рассеянное внутрисосудистое свертывание, присоединяющиеся на завершающем этапе острой печеночной недостаточности, также ведут к метаболическому ацидозу. Однако надо помнить, что метаболический алкалоз с гипокалиемией, определяемые в плазме, сочетаются с обратными внутриклеточными отношениями. А если при острой печеночной недостаточности будет накапливаться молочная кислота и другие продукты неполного биологического окисления, то и вне клетки может развиться метаболический ацидоз.
Резюмируя метаболические нарушения при острой печеночной недостаточности, надо добавить, что поражаются все специфические виды метаболизма уже хотя бы потому, что нарушается синтез многих ферментов и страдает дезинтоксикационная функция печени.
В итоге среди клинико-физиологических проявлений острой печеночной недостаточности можно выделить следующие главные синдромы.
Дыхательная недостаточность развивается по рестриктивному (интерстициальный отек), обструктивному (ЭЗДП) и диффузионному (утолщение альвеолокапиллярной мембраны) механизмам. Они завершаются альвеолярным шунтом, не поддающимся оксигенотерапии и усугубляющимся гемической, циркуляторной и гистотоксической гипоксией.
Возникают генединамические расстройства, связанные с несколькими механизмами. Во-первых, энцефалопатия нарушает регуляцию сосудистого тонуса, вызывая артериальную гипотензию. Имеется корреляция между степенью гипотензии и плазменным уровнем ложного нейромедиатора октопамина. Во-вторых, возникают нарушения сердечного ритма — экстрасистолия, признаки сердечного блока и др., связанные с гипоксией, расстройствами электролитного баланса и кислотно-щелочного состояния, а также с петехиальными кровоизлияниями и жировыми дистрофическими изменениями в миокарде. В-третьих, нередкие кровотечения, связанные с недостатком белковых факторов свертывания и тромбоцитопенией (результат РВС), ведут к гиповолемии. Оказалось, что у половины больных острой печеночной недостаточностью имеются выраженные эрозии слизистой оболочки верхнего отдела пищеварительного тракта.
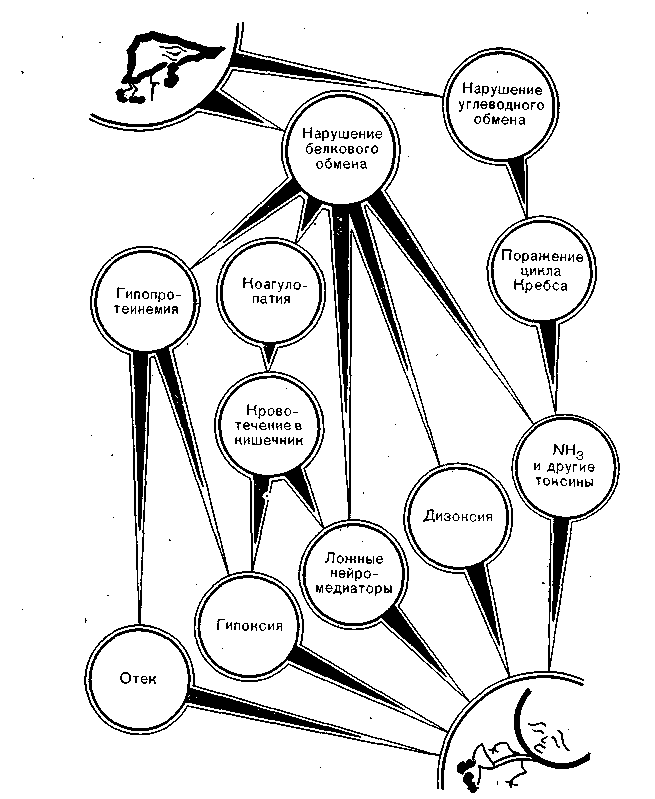
Рис. 43. Физиологические механизмы коматозного состояния при острой печеночной недостаточности.
Присоединяется почечная недостаточность и возникает гепаторенальный синдром, клиническая физиология которого рассмотрена в главе 4.
Коматозное состояние при острой печеночной недостаточности связано не только с действием ложных медиаторов или токсических продуктов неполного белкового катаболизма. Важным механизмом печеночной комы являются все упоминавшиеся виды гипоксии и отек мозга, выявленный гипопротеинемией, гипергидратацией и увеличением проницаемости мембран.
У половины больных, умерших от острой печеночной недостаточности, морфологически четко определяется отек мозга (рис. 43). Коматозное состояние сопровождается судорогами различной выраженности, которые истощают ЦНС, а также ограниченные энергетические и кислородные запасы организма. Разумеется, нарушение центральной регуляции сказывается на всех функциях организма, в том числе функции самой печени, и существенно ухудшает прогноз. Среди больных острой печеночной недостаточностью, у которых кома не была глубокой, выжило 66%, при глубокой коме — только 17,6% [Murray-Lyon I. M. et al., 1979].
Объективные критерии. Нередко острую печеночную недостаточность приравнивают к гепатоцеребральной и делят на три стадии в зависимости от психоневрологической симптоматики. Поскольку принципиально коматозное состояние при печеночной недостаточности не отличается от прочих коматозных состояний, рассмотренных в главе 5, оценивать глубину печеночной комы надо по приведенной там объективной шкале коматозных состояний. Такая шкала рекомендована Конференцией по молниеносной печеночной недостаточности [Berk P. D., Popper H., 1978].
Хотя коматозное состояние несомненно ухудшает прогноз, его объективизация имеет меньшее значение, чем характеристика тяжести морфологических и функциональных расстройств. В этом плане надо различать три степени тяжести, острой печеночной недостаточности: 1) легкая степень печеночной недостаточности, когда функциональную способность печени удается восстановить без специальных мер поддерживающей терапии, а лишь при ликвидации агрессивного фактора; 2) печеночная недостаточность средней тяжести, когда для обеспечения регенерации гепатоцитов и жизни больных требуются специальные меры метаболической коррекции и жизнеобеспечения; 3) тяжесть печеночной недостаточности столь велика, что препятствует регенерации гепатоцитов, и восстановление возможно лишь при использовании чужой печени.
Поскольку прогноз при острой печеночной недостаточности зависит от регенерации гепатоцитов, целесообразно прежде всего оценить ее.
Один из объективных методов, позволяющих судить о тяжести повреждения и прогнозе,— игольчатая биопсия печени с определением относительного объема гепатоцитов в пробе (норма 85±5%). Если фракция гепатоцитов составляет менее 35%, все больные погибают; фракция гепатоцитов выше этого критического уровня, выживает более 80% больных. Когда фракция гепатоцитов достигает 45%, сознание восстанавливается [Murray-Lyon I. M. et af., 1979].
Одним из критериев активности регенеративного процесса гепатоцитов является плазменный уровень α-фетопротеина, белка глобулиновой фракции, который в норме содержится в очень малой концентрации, но при регенерации гепатоцитов его количество резко возрастает [Murray-Lyon I. M. et al., 1979].
Полагают, что способность печени выделять введенную внутривенно галактозу соответствует функционирующей массе гепатоцитов, как и способность печени соединять желчные кислоты. Этот тест ставят с помощью х о лиевой кислоты, меченной 14С.
Важное значение в качестве объективного критерия при оценке тяжести острой печеночной недостаточности может иметь проба с вофавердином (уевиридин), которая применяется и для оценки печеночного кровотока.
Возможно, перспективным в этом плане окажется определение тяжести печеночной недостаточности с помощью различных тестов (около 20), которые Э. И. Гальперин и Ю. М. Дедерер (1978) разделяют на секреторные, экскреторные и метаболические. Аналогичные попытки суммировать результаты различных тестов и вывести средний критерий тяжести печеночной недостаточности делались и другими авторами.
Что касается методов функциональной оценки печени вообще, то их значительно больше, чем известных функций печени, в связи с чем даже перечислять их в этом руководстве мы не станем, отослав заинтересованных читателей к специальным изданиям по гепатологии.
При любом характере печеночной недостаточности целесообразно исследовать печеночный кровоток, так как от него в значительной степени зависят предупреждение гепатонекроза и регенерация гепатоцитов. Нарушается же печеночный кровоток при всех критических состояниях, и оксигенация печени, а также транспорт метаболитов страдают.
Измерение печеночного кровотока может быть осуществлено четырьмя методами:
1) реографией—измерением электрического сопротивления печени, меняющегося в зависимости от ее кровообращения;
2) радиологическими методами исследования, позволяющими не только оценить печеночный кровоток, но и получить представление о различных функциях печени;
3) измерением печеночного кровотока, для чего определяют поглощение печенью той же краски вофавердин, что и при оценке экскреторной функции печени, исходя из расчета:
-
Vпеч=
ОЦК·0,698
Т1/2
где: Vпеч — печеночный кровоток; ОЦК — объем циркулирующей крови; Т1/2, — полупериод очистки крови от вофаверидина. Используя этот метод, Р. И. Новикова и соавт. (1978) отметили снижение кровотока печени при токсической гепатаргии;
4) измерением печеночного кровотока с определением спланхникового и общего сосудистого сопротивления. Выполняется путем катетеризации бедренной артерии, печеночной вены и легочной артерии с термодилюционным датчиком [Wilkund L., 1977].
Принципы интенсивной терапии. Лечение острой печеночной недостаточности должно строиться на двух главных принципах: 1) если ликвидировать причины, вызвавшие гепатонекроз, то гепатоциты регенерируют в течение 10—15 дней, и в это время следует, насколько возможно, заместить их функции; 2) при острой печеночной недостаточности больной умирает не только от избытка токсических продуктов, как, в частности, при острой почечной недостаточности, но и от катастрофического недостатка необходимых и незаменимых веществ.
Исходя из этих двух принципов, интенсивную терапию острой печеночной недостаточности можно разделить на следующие компоненты (рис. 44): остановка гепатонекроза, улучшение функций собственной печени, использование чужой печени, биохимическая коррекция и ликвидация сопутствующих синдромов.
Остановка гепатонекроза. Достичь этой цели нелегко. Есть мнение о полезности глюкокортикоидных гормонов, хотя объективные доказательства этого нам неизвестны. Нет пока и убедительных данных об эффективности иммунных сывороток.
Рекомендовавшееся применение левадопа не способствует уменьшению гепатонекроза, хотя и снижает уровень некоторых ложных нейромедиаторов. То же самое можно сказать о различных аминокислотах.
Если печеночная кома развилась не в связи с вирусным гепатитом, а например, на фоне кровотечения в желудочно-кишечный тракт из-за цирроза печени, то цирроз мы, разумеется, не сумеем вылечить (для этого нет времени, если бы мы даже умели), но кровотечение остановить должны. Это достигается гемотрансфузиями, применением раздуваемого в пищеводе и кардиальном отделе желудка зонда Блэкмора, использованием локальной гипотермии и лишь в крайнем случае оперативным вмешательством, которое слишком часто бывает бесполезным. Ободряющие результаты при остановке и профилактике кровотечений у больных острой печеночной недостаточностью получены при внутривенном введении в дробных дозах 150 мг Н2-антагониста циметидина, применяемого с целью обеспечить рН желудочного сока на уровне выше 5,0 [McDougal В. R. et al., 1977]. Следует иметь в виду, что кровотечения в желудочно-кишечный тракт возникают у 70% больных с печеночной недостаточностью, причем у 30% они служат непосредственной причиной смерти [Rogers E. L., Rogers M. С., 1980].
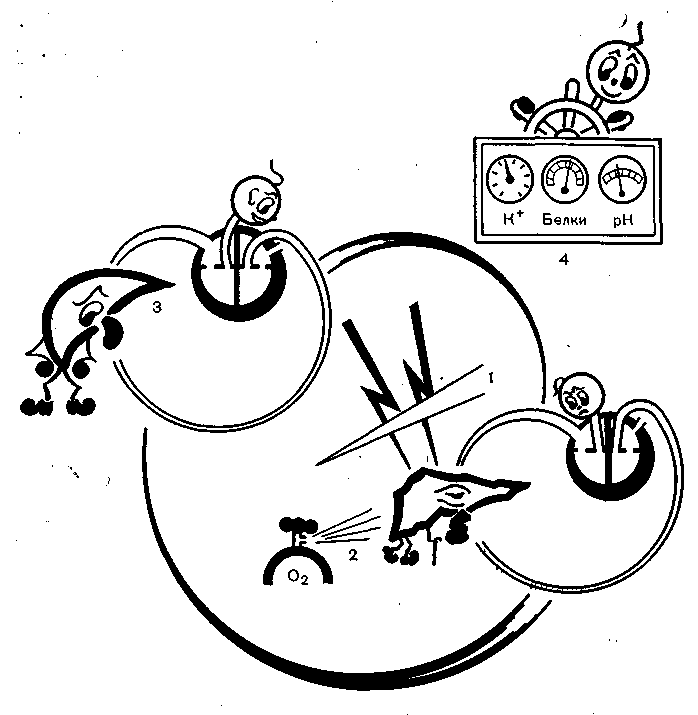
Рис. 44. Компоненты интенсивной терапии острой печеночной недостаточности.
1 — устранение причин, вызывающих гепатонекроз, включая удаление токсичных продуктов метаболизма стимуляцией диуреза и т. п.; 2 — улучшение функций собственной печени, в том числе нормализация печеночного кровотока, искусственная оксигенация е введением энергетических и ферментативных веществ, противоотечная декомпрессия и т. п.; 3 — использование чужой печени (экстракорпоральная перфузия, перекрестное кровообращение и др.); 4 — коррекция метаболизма и возникших синдромов — нарушения реологии крови, острой дыхательной недостаточности, острой почечной недостаточности, коагулопатии и т. д. Разумеется, провести четкую границу между этими компонентами невозможно.
Улучшение функций печени. Эти меры интенсивной терапии острой печеночной недостаточности можно сгруппировать следующим образом: улучшение печеночного кровотока, оксигенация печени различными способами, повышение утилизации печенью кислорода, введение энергетических веществ, противоотечная декомпрессия печени, снижение токсического эффекта на печень и другие органы.
Увеличение печеночного кровотока. Первая мера, вытекающая из наших рассуждений, — улучшение печеночного кровотока любыми средствами. Естественно, что устранение гиповолемии, с чем бы она ни была связана (кровотечение, перитонит, травма и т. п.), — первостепенная задача, без разрешения которой ни о какой серьезной физиологической терапии острой печеночной недостаточности не может быть и речи.
Ликвидация пареза кишечника, наличие в кишечнике пищи, повышающей его моторику, также улучшают печеночный кровоток, поскольку увеличивается объем крови, поступающей в печень из воротной вены.
Описанная ниже противоотечная декомпрессия печени с помощью форсированного диуреза и дренирования грудного лимфатического протока улучшает капиллярный печеночный кровоток. Так же действует увеличение сердечного выброса, снижающее давление в нижней полой вене, а следовательно, и в печеночной венах.
Любопытны попытки уменьшить сопротивление печеночному артериальному и портальному кровотоку. В этом направлении действует оксигенация, а в последнее время стали вводить простагландин E1. Первые результаты как будто ободряющие, хотя рассчитывать на широкое использование данного метода в клинической практике пока еще рано, тем более что гемодинамические отношения в печени весьма сложны. Давление в печеночной артерии составляет около 14,7—17,3 кПа (100—130 мм рт. ст.), в воротной вене —0,93— 1,33 кПа (7—10 мм рт. ст.) и в печеночной вене —около 0,40 кПа (3 мм рт. ст.), причем артериальный кровоток отличается значительным постоянством даже при колебаниях аортального давления в пределах 8—24 кПа (60—180 мм рт. ст.). Это объясняется очень подвижной регуляцией тонуса пресинусоидальных сосудов, реагирующих на метаболические потребности печени [Thiel H., 1979].
Интересно клинико-физиологическое исследование L. Wiklund (1977), который показал, что при внутривенном введении лидокаина в дозе 2 мг/мин печеночный кровоток благодаря снижению спланхникового сосудистого сопротивления возрастает на 25%. Правда, это исследование выполнено на здоровых добровольцах.
Оксигенация печени. Можно ли применить ингаляцию 100% кислорода? В общем-то, если не удается придумать что-нибудь более толковое, и это неплохо. Но, во-первых, даже при дыхании воздухом гемоглобин артериальной крови насыщен кислородом на 95—96%. Следовательно, максимальное увеличение, на которое мы можем рассчитывать, — это 4—5%, если не учитывать небольшого количества кислорода, физически растворенного в плазме. К тому же артериальное кровообращение печени составляет около 1/4 общего притока крови, а остальное — это портальная венозная кровь. Во-вторых, не следует обольщаться и возможностями обогащения крови кислородом в легких, если вспомнить об альвеолярном шунте, который при острой печеночной недостаточности почти всегда возрастает и не позволяет притекающей в легкие венозной крови войти в контакт с альвеолярным кислородом.
Более перспективно введение кислорода через зонд в кишечник, с целью артериализировать кровь воротной вены, хотя эффективность метода хуже ожидаемой, возможно из-за дизоксии.
Среди прочих методов, улучшающих оксигенацию печени, можно назвать инфузию оксигенированной крови в реканализованную пупочную вену, впадающую в воротную. Пытаются применять в клинике метод многодневного шунтирования лучевой артерии и пупочной вены, получая при этом благоприятный, хотя и меньший, чем можно было бы ожидать, реаультат [Гальперин Э. И. и соавт., 1978].
К улучшению кислородного снабжения печенш относится и метод гипербарической оксигенации, хотя часть исследователей рекомендует осторожно применять этот метод при острой печеночной недостаточности на фоне механический желтухи.
Увеличение оксигенации печени становится более эффективным, если к этому добавить вещества, улучшающие утилизацию кислорода печенью, особенно когда эти вещества вводятся через воротную вену. К таким веществам относятся пангамовая кислота (витамин В15), цитохром С, кокарбоксилаза, гутимин. Имеются сообщения о благоприятном эффекту L-глутамина, коэнзима А, альфа-липоевой кислоты и дифосфопиридин-нуклеотида как средств, улучшающих биологическое окисление.
Внутрипортальное введение растворов и медикаментов — важная мера в интенсивной терапии острой печеночной недостаточности. Она достигается реканализацией пупочной вены, впадающей в воротную, и значительно эффективнее, чем другие способы ферментативных препаратов, глюкозии и т. п.
Ввиду того что при острых и хронических поражениях печени воротный венозный кровоток через печень сокращается, Э. И. Гальперин и соавт. (1978) считают более целесообразным, хотя и труднее выполнимым введение медикаментов и растворов через печеночную артерию.
Введение глюкозы является важной мерой улучшения энергетических процессов, в частности утилизации кислорода.
Противоотечная декомпрессии печени. Стимуляция диуреза маннитолом уменьшает интерстициальный отек, улучшает вентиляцию легких, микроциркуляцию, питание гепатоцитов, способствует удалению желчных пигментов и других гепатотоксических веществ и предупреждает развитие острой почечной недостаточности.
Для нормализации лимфообращения и очистки кровотока от патологических продуктов, выделяемых печенью, предлагают дренирование грудного лимфатического протока. Рекомендация основана на двух доводах: 1) в лимфе содержится много токсических продуктов, удаление которых уменьшает эндогенную интоксикацию; 2) снижение высокого лимфатического давления уменьшает интерстициальный отек печени и улучшает ее кровоток. Обнажение и дренирование грудного лимфатического протока — не слишком сложная процедура. Применение этого метода для лечения печеночно-почечной недостаточности, его обоснование и техника впервые в СССР описаны нами [Зильбер А. П., Сильвестрова Г. С., 1964]. В настоящее время метод усложнен пропусканием лимфы через колонки, заполненные активированным углем и ионообменными смолами, с возвращением очищенной лимфы обрдтно в кровоток (лимфосорбция) [Панченков Р. Г. и др., 1977; Малхасян В. А., 1979]. Э. И. Гальперин и соавт. (1978) для разгрузки лимфатической системы печени накладывают лимфовенозный анастомоз.
Методы детоксикации. К методу лимфосорбции близок основанный на тех же предпосылках метод гемосорбции.
Суть метода состоит в экстракорпоральной перфузии крови аппаратом искусственного кровообращения, где вместо оксигенатора имеются колонки для выделения из крови токсических продуктов неполного печеночного метаболизма. Поскольку при этом возникает повреждение эритроцитов и тромбоцитов, пытаются применить предварительное отделение плазмы с возвратом форменных элементов в сосудистое русло — плазмосорбцию и плазмаферез [Лопухин Ю. М. и др., 1978]. Те же цели, что и путем лимфо-, гемо- и плазмосорбции, могут быть достигнуты гемодиализом и перитонеальным диализом.
Однако все упомянутые методы снижения интоксикации при острой печеночной недостаточности имеют один принципиальный дефект. Они позволяют очистить организм от вредных продуктов метаболизма, облегчить жизнь гепатоцитов, но при этом организм не получает полезных и необходимых веществ. Непоэтому ли все перечисленные методы оказались довольно эффективными в профилактике ранних стадий острой печеночной недостаточности, но почти не улучшили результаты при ведении настоящей печеночной комы?
В известной мере приблизиться к этой второй части проблемы позволяет комплекс мер с использованием чужой печени.
Использование чужой печени. Основная идея этих методов — не только очистить организм больного от токсических продуктов, но и дать ему полезные вещества, используя чужую печень. С этой целью применяют перфузию крови больного через гетеропечень свиньи, перфузию крови больного через трупную гомопечень, трансплантацию печени, заменное переливание крови, перекрестное кровообращение, культуры печеночных клеток.
Три первых метода пока не могут использоваться в повседневной практике ИТАР из-за их сложности, позволяющей изучать их только в специальных центрах. Эти методы не дают результатов лучших, чем все остальные. Их многообразные варианты с подробным изложением методики и результатов описаны Э. И. Гальпериным и соавт. (1978).
Тотальное замещение крови. Суждения относительно заменного переливания крови, когда у больного в несколько приемов удаляют часть его крови и вливают донорскую, противоречивы, но общее впечатление не слишком вдохновляющее, что связано, видимо, с аллергическим ударом, испытываемым больным при переливании крови многих доноров. Вариант этого метода—общее промывание тела, т. е. искусственное кровообращение в условиях гипотермии, когда в течение нескольких минут кровь больного удаляют и сосудистое русло отмывают перфузатом, не содержащим крови, а затем вводят 5—6 л донорской крови. В Советском Союзе метод впервые применен Э. И. Гальпериным и соавт. (1978). М. С. Маргулис и соавт, (1981) полагают, что основу эффективности этого метода составляет снижение токсических продуктов в организме.
По нашему мнению, гораздо перспективнее перекрестное кровообращение как метод интенсивной терапии острой печеночной недостаточности.
Суть метода состоит в соединении сосудов больного и донора таким образом, чтобы кровь больного постепенно проходила через печень донора, очищаясь в ней от вредных продуктов и получая полезные. Впервые метод применен в 1965 г. С тех пор десятки авторов опубликовали свои наблюдения, анализ которых свидетельствует о достаточно удовлетворительных результатах интенсивной терапии острой печеночной недостаточности методом перекрестного кровообращения [Rueff В. et al., 1974; Motin J. et al., 1974, и др.].
Главный вопрос, возникающий при использовании этого метода, каков будет ущерб, нанесенный здоровью донора. В литературе нам не встретилось описание каких-либо серьезных осложнений у доноров, участвовавших в перекрестном кровообращении с больным острой печеночной недостаточностью. Но потенциальный вред, наносимый донору хотя бы в силу антигенного удара, несомненен. Пытаются осуществить перекрестное кровообращение с павианом, а в последнее время морально-юридические сложности перекрестного кровообращения стараются обойти использованием донора с мозговой смертью вследствие черепно-мозговой травмы.
Материал еще не настолько велик, чтобы высказаться об эффективности метода, но, на наш взгляд, моральные трудности при его применении не уменьшаются, а, наоборот, возрастают.
Перфузия культуры клеток печени. Использование культуры печеночных клеток — новый этап в попытках продлить жизнь больных с гепатонекрозом, пока не регенерируют гепатоциты. Суть метода состоит в том, что на синтетических капиллярах выращивают культуру печеночных клеток, а затем перфузируют кровь больного через колонки, содержащие сорбенты для токсических продуктов, и капилляры с гепатоцитами для подачи в кровь полезных веществ [Чанг Т. М., 1980]. Пытаются использовать срезы печени и даже инъецировать культуру гепатоцитов в кровоток или селезенку. Все эти методы имеют принципиальное отличие от прочих: они предназначены для того, чтобы не только избавить организм от вредных продуктов, но и дать ему полезные. Хотя методы еще не вышли из стадии экспериментального изучения, они, по мнению P. D. Berk и Н. Popper (1978), имеют хорошую перспективу.
Возникают идеи о создании искусственной печени. Но давайте задумаемся над этим. Один гепатоцит производит около тысячи молекул белка в секунду, и каждая молекула состоит примерно из тысячи особо расположенных аминокислот (а в каждой аминокислоте расположены атомы!). В гепатоците есть сырье (коллоиды), машины (рибосомы), надсмотрщики (ферменты) и собственный ОТК. Чтобы все это делать, гепатоцит перерабатывает за 0,1 с такое количество информации, выраженной в битах, на которое современная ЭВМ тратит 1 ч! Если учесть все это, то как скоро можно ожидать появления эффективной искусственной печени?
Пожалуй, реальнее обратиться к последнему, не рассмотренному еще комплексу физиологической терапии острой печеночной недостаточности — биохимической коррекции и ликвидации сопутствующих синдромов.
Биохимическая коррекция и ликвидация синдромов. Биохимическая коррекция включает несколько групп мероприятий.
Борьба с аммиачной энцефалопатией заключается в снижении продукция аммиака, его утилизации, а также в устранении судорожного синдрома. Снижение продукции аммиака достигается очисткой кишечника, чтобы уменьшить микробный гидролиз в нем, введением энтерально антибиотиков с той же целью, исключением из диеты белков и жиров и профилактикой кровотечений в желудочно-кишечный тракт.
Утилизация аммиака может быть усилена введением глутаминовой кислоты, которая, присоединяя к себе аммиак, образует глутамин, экскретируемый почками. Так же действует другая аминокислота — аргинин. Следует иметь в виду, что гипотиазид и другие препараты этой группы нарушают образование глутамина и тем самым препятствуют утилизации аммиака. Необходимо также помнить, что энцефалопатию вызывает не один лишь аммиак.
Из седативных и противосудорожных препаратов наименее вредно действует на печень оксибутират натрия, который, помимо противосудорожного эффекта, усиливает диурез и снижает свойственную печеночной недостаточности гипергидратацию, а также улучшает окислительно-восстановительные процессы. При икоте, часто сопровождающей аммиачную энцефалопатию, подавление этого патологического рефлекса сравнительно легко достигается введением катетера через нос до уровня мягкого неба, что вызывает контррефлекс. Не менее эффективно закапывание в нос нескольких капель этилового эфира или ледяной воды — мера, также действующая рефлекторно.
Нормализация водно-электролитного баланса и кислотно-щелочного состояния также входит в комплекс биохимической коррекции при печеночной недостаточности. В большинстве случаев до того, как к печеночной присоединяется почечная недостаточность, у больных наблюдаются гипокалиемия и метаболический алкалоз. Для их устранения вводят растворы хлорида калия, обладающего кислыми свойствами. Нельзя применять другой кислый раствор — хлорид аммония, так как он увеличивает поступление аммиака в организм. При неэффективности хлорида калия для ликвидации метаболического алкалоза используют раствор соляной кислоты.
Присоединение к острой печеночной недостаточности синдрома РВС — достаточно частая ситуация. Коррекция этого синдрома выполняется по правилам, изложенным в главе 3.
Коррекция острой почечной недостаточности, присоединяющейся к несвоевременно или неправильно леченной острой печеночной недостаточности, выполняется по правилам, указанным в главе 24.
Поражение ретикулоэндотелиальной системы при острой печеночной недостаточности бывает всегда, поэтому септические осложнения неизбежны. Антибиотикотерапия этих осложнений — необходимый компонент интенсивной терапии острой печеночной недостаточности, несмотря на гепатотоксичность всех известных антибиотиков.
Терапия острой дыхательной недостаточности заключается в применении режима ПДКВ с целью устранения шунта и стимуляции диуреза для. уменьшения интерстициального отека, а также в использовании различных методов антигипоксической терапии, описанных выше.
С помощью перечисленных комплексов интенсивной терапии не удается снизить уровень летальности при тяжелых формах острой печеночной недостаточности ниже отметки 40%. Необходимы активные усилия анестезиологов-реаниматологов в двух направлениях — в шнеке новых или модернизации старых методов лечения и в возможно более ранней профилактике печеночной недостаточности и ее активном лечении до того,, шак гепатонекроз перешел зловещую границу— 45% гепатоцитарного объема.
Не менее чем у 75% больных с критическими состояниями любой этиологии поражение печеночных функций четко выявляется функциональными тестами. Если в практике ИТАР станут правилом функциональная оценка печени при каждом критическом состоянии и применение профилактических комплексов, предупреждающих развитие тяжелых форм печеночной недостаточности летальность при острых формах печеночной недостаточности не будет столь, высокой.
Г л а в а 24
