
- •Введение
- •Часть I клиническая физиология главных синдромов критических состояний
- •Глава 1
- •Физиологические эффекты гиповолемии
- •Функциональные критерии
- •Глава 2 острая дыхательная недостаточность
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Свертывание крови и фибринолиз
- •Первичная адгезия и агрегация
- •Реакция освобождения и вторичная агрегация
- •Принципы интенсивной терапии
- •Глава 4 гепаторенальный синдром
- •Физиологические механизмы
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Глава 5 острая церебральная недостаточность
- •Физиологические механизмы
- •Функциональные критерии
- •Прогноз неврологического статуса
- •Принципы интенсивной терапии
- •Глава 6 болевой синдром
- •Физиологические механизмы
- •Принципы интенсивной терапии
- •Глава 7 операционный стресс
- •Функциональные критерии
- •Принципы физиологической защиты
- •Глава 8 нарушение метаболизма
- •Пути управления метаболизмом
- •Нарушение осмол яркости и водно-электролитного баланса
- •Часть II клиническая физиология методов интенсивной терапии, анестезии и реанимации
- •Реанимация при остановке сердца и дыхания
- •Г л а в а 11 инфузионная и трансфузионная терапия
- •Инфузия медикаментов
- •Парентеральное питание
- •Методы инфузионной терапии
- •Глава 12 вспомогательное кровообращение
- •Метод контрпульсации
- •Шунтирование желудочков
- •Функциональные эффекты
- •Глава 13 респираторная терапия
- •Оптимизация естественных механизмов дренирования мокроты
- •Глава 14 антигипоксическая терапия (ингаляционная, трансфузионная и медикаментозная)
- •Ингаляционная оксигенотерапия
- •Гипербарическая оксигенация
- •Энтеральная оксигенация
- •Трансфузионая оксигенация
- •Искусственная вентиляция легких
- •Клинико-физиологические аспекты процедуры искусственной вентиляции легких
- •Объективные критерии
- •Глава 16 искусственная миоплегия
- •Миорелаксанты и мышечная система
- •Глава 17 детоксикационная терапия
- •Стимуляция естественной детоксикации
- •Искусственная детоксикация
- •Синдроматическая терапия
- •Глава 18 мониторизация
- •Принципы мониторизации
- •Методы и цели
- •Параметры мониторизации
- •Часть III клинико-физиологический анализ итар в повседневной практике
- •Глава 19 акушерство
- •Амниотическая эмболия
- •Эклампсия
- •Глава 20 неонатология и педиатрия
- •Реанимация новорожденных
- •Бронхиолит
- •Синдром внезапной смерти младенца
- •Глава 21 пульмонология Влияние анестезиологического пособия на дыхание
- •Тромбоэмболия легочной артерии
- •Бронхоастматический статус
- •Отек легких
- •Синдром шокового легкого
- •Глава 22 кардиология
- •Внезапная кардиальная смерть
- •Кардиогенный шок
- •Глава 23 гепатология
- •Острая печеночная недостаточность
- •Нефрология Влияние анестезии на функции почек
- •Острая почечная недостаточность
- •Глава 25 гематология
- •Геморрагический шок
- •Глава 26 неврология и нейрохирургия
- •Эпилептический статус
- •Столбняк
- •Поражение головного мозга
- •Поражение спинного мозга
- •Глава 27 гастроэнтерология
- •Острейший гастроэнтерит
- •Травматология
- •Травматический шок
- •Синдром жировой эмболии
- •Газовая эмболия
- •Глава 29 иммунологические аспекты практики итар
- •Аллергия в практике итар
- •Анафилактический шок
- •Септический шоковый синдром
- •Список литературы
- •Оглавление
- •Часть I. Клиническая физиология главных синдромов критических состояний ..........……………………………………….. 12
- •Глава 1. Нарушение реологии крови и острая гиповолемия .…………….. 12
- •Глава 2. Острая дыхательная недостаточность ...…………………………... 30
- •Глава 11. Инфузионная и трансфузионная терапия ....……………………… 141
- •Глава 21. Пульмонология ...........………………………………………………….. 250
- •Глава 28. Травматология . . . .......………………………………………………….. 341
- •Глава 29. Иммунологические аспекты практики итар ..…………………….. 351
Глава 21 пульмонология Влияние анестезиологического пособия на дыхание
Первое звено, на которое действует общая анестезия, — это изменение центральной регуляции дыхания, которое влияет на газообмен и механику дыхания. Уменьшается чувствительность дыхательного центра к Рсо2 и Ро2 и меняется режим работы дыхательных мышц — снижается грудной компонент вентиляции. Эти сдвиги не зависят ни от характера анестетика, ни от пути его введения, но возрастают у пожилых людей и больных хроническими заболеваниями легких.
Следующее звено в цепи дыхательных изменений при общей анестезии — снижение функциональной остаточной емкости легких (ФОБ), резервного объема выдоха и растяжимости легких. В связи с этим возникает иное вентиляционно-перфузионное соотношение: уменьшается эффективный альвеолярный объем, а альвеолярный шунт и альвеолярное мертвое пространство увеличиваются. Кроме того, снижается резерв ФОБ, т. е. различие между емкостью закрытия легких вследствие ЭЗДП и ФОБ (см. главу 2).
Этот эффект анестезии связан не только с иной центральной регуляцией дыхания и новым соотношением грудного и диафрагмального компонентов, но и с влиянием анестетика н а бронхиальный и сосудистый тонус легких, поэтому одинаково направленные изменения трех компонентов альвеолярного объема могут иметь разное количественное выражение.
Одновременно меняется регионарное распределение вентиляции и кровотока, причем кровотока существенно больше, чем вентиляции, в связи с чем нарушается и распределение вентиляционно-перфузионных соотношений. Изучению вентиляционно-перфузионных соотношений в связи с анестезией посвящена специальная монография [Зильбер А. П., 1971], в которой изложены история вопроса и методы исследований, приведены результаты и дана оценка их клинико-физиологического значения. В дальнейшем изучение этой проблемы такими же и другими методами [Render К. et al., 1975; Dueck R. et al., 1980, и др.] позволило подтвердить полученные данные.
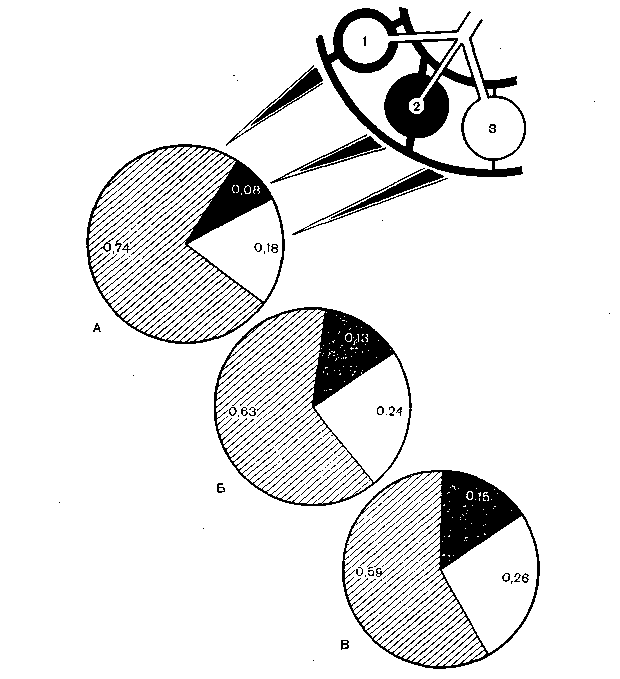
Рис. 37. Изменение вентиляционно-перфузионных соотношений во время анестезии.
А— до анестезии: 1 — эффективный альвеолярный объем с нормальным соотношением вентиляции и кровотока, 2 — невентилируемый объем (альвеолярный шунт), 3 — неперфузируемый объем (альвеолярное дыхательное мертвое пространство); Б — 10 мин анестезии; В — 60 мин анестезии.
Особо следует отметить, что все эти изменения вентиляционно-перфузионных соотношений зависят от времени: они минимальны в начале анестезии и увеличиваются по мере ее продолжительности (рис. 37). Мы объясняем это постепенно нарастающим абсорбционным ателектазированием в зонах с низким соотношением вентиляция/кровоток. Следовательно, чем дольше анестезия, тем вероятнее возникновение послеоперационных легочных осложнений типа ателектаза и пневмонии.
Положение тела во время операции и анестезии имеет четкое влияние на легкие: в располагающихся внизу зонах кровоток резко преобладает над вентиляцией в связи с действием ЭЗДП, подробно рассмотренного в главе 2.
Надежно доказано, что отсасывание содержимого из дыхательных путей повышает дыхательное сопротивление благодаря рефлекторной бронхоконстрикции.
Влияние прочих компонентов анестезиологического пособия на дыхание рассмотрено в других главах.
Анестезиологическое пособие при патологии легких
Основные клинико-физиологические требования к проведению анестезиологического пособия у больных с легочной патологией можно сформулировать следующим образом:
1) должно быть исследовано функциональное состояние дыхания в предоперационном периоде, чтобы определить физиологические механизмы дыхательной патологии;
2) надо попытаться увеличить функциональные резервы дыхания в предоперационном периоде;
3) оперативное вмешательство на легких должно проводиться с максимальным сохранением функционирующей легочной ткани;
4) необходим скрупулезный подход к трансфузиям во время и после анестезии и операции;
5) требуются тщательное обезболивание и специальная респираторная терапия в послеоперационном периоде.
Ни анестетик, ни метод анестезии не имеет большого значения в профилактике дыхательных расстройств у больных с патологией легких.
Хронические обструктивные заболевания легких. С этой патологией анестезиологи сталкиваются все чаще из-за увеличения числа оперативных вмешательств у пожилых, распространения курения, аллергических болезней легких и т. д.
Основные функциональные сдвиги: увеличенное сопротивление дыхательных путей, сниженная растяжимость легких, раннее ЭЗДП, повышенный альвеолярный шунт, высокая цена работы дыхания, наклонность к правожелудочковой недостаточности.
Обычно наблюдается умеренная гипервентиляция, и реакция дыхательного центра на СО2 снижена. У таких больных при введении анестетиков и наркотических анальгетиков легко возникает центральная депрессия дыхания.
Операционный период у таких больных не имеет какой-либо специфики, за исключением внимания к возможной депрессии дыхания и к экономной трансфузии.
В послеоперационном периоде требуются режим ПДКВ, тщательный контроль дренирования мокроты и анальгезия. Если операция выполняется на ортанах грудной клетки и живота, то паравертебральная блокада является обязательным действием, без которого хирург не должен зашивать операционную рану.
Бронхиальная астма. При аллергической астме необходима предварительная проверка на чувствительность ко всем препаратам, которые предполагается использовать в ходе анестезиологического пособия и число которых необходимо сократить до разумного предела. Тубарин как препарат, освобождающий гистамин, лучше исключить.
В предоперационном периоде надо с помощью объективных методов выявить реакцию больного на бронходилататоры — антигистаминные, адреномиметические, холинолитические и др., чтобы в нужный момент воспользоваться лучшим средством.
У многих больных бронхиальной астмой имеется обструктивная эмфизема легких, и тогда анестезиологическое пособие должно быть таким же, как у больных хроническими обструктивными заболеваниями легких.
Острые респираторные заболевания. Плановая операция не должна выполняться на фоне острого респираторного заболевания. В случае срочной операции при определении анестезиологического пособия надо учесть два обстоятельства: вероятность большей реактивности гортани и трахеи на интубационную трубку и необходимость особо тщательного туалета дыхательных путей в послеоперационном периоде.
Операции на легких и грудной клетке. Первая клинико-физиологическая проблема — оценка функциональной операбельности больных. Предлагается множество критериев такой оценки [Королев Б. А., Шмерельсон М. Б., 1975,. и др.]. Простейший критерий — индекс вентиляции — является результатом умножения процентов должных величин ЖЕЛ на максимальную вентиляцию легких [Репин Ю. М. и др., 1981]. С этой проблемой связана другая — предоперационная санация легких, если патология требует того и время позволяет. Больной не должен быть в таком состоянии, чтобы перед ее началом или в ходе ее требовалась туалетная бронхоскопия.
Вторая проблема — пневмоторакс, который исключает выполнение операции со спонтанной вентиляцией легких из-за сокращения дыхательной поверхности и парадоксального дыхания с резким увеличением дыхательного мертвого пространства и флотированием средостения.
Третья проблема — операционная позиция, при которой возможно затекание содержимого из больного легкого в здоровое. Различными способами раздельной интубации и направленной бронхоблокады можно устранить эту опасность. В послеоперационном периоде та сторона тела, на которой проводилось вмешательство, должна находиться в возвышенном положении; при этом меньше действует механизм ЭЗДП.
Еще одна задача — обеспечение спокойного операционного поля хирургу, оперирующему на легком. Различные варианты блокады бронхов позволяют не только выключать легкое из дыхания, но и уменьшать кровопотерю из выключенной зоны. Нами показано [Зильбер А. П., 1971] и впоследствии другими исследователями подтверждено, что кровоток в зоне легкого, где создана искусственная гипоксия, резко сокращен.
Важная проблема — послеоперационная анальгезия. Она начинается с паравертебральной блокады, которую должен сделать хирург со стороны плевральной полости. В послеоперационном периоде паравертебральную блокаду можно повторять. В любом случае должна быть достигнута анальгезия такого качества, чтобы объем дыхания на оперированной стороне не снижался.
Негерметичность легкого. Негерметичность легкого и бронхоплевральные или бронхокожные свищи всегда были только хирургической проблемой. Ее решали сравнительно легко дренированием плевральной полости с водным затвором и пассивным или активным удалением газа и жидкости из плевральной полости. Однако развитие методов респираторной терапии сделало эту проблему анестезиологической. Трудности возникают в трех ситуациях: 1) при слишком большом свище, в который уходит значительная часть вентилируемого объема легких; 2) при спонтанной вентиляции в режиме ПДКВ, который либо неосуществим, либо увеличивает поток газа через свищи; 3) при ИВЛ любого режима.
Проблема может быть решена следующими путями:
а) использованием высокочастотной ИВЛ (см. главу 15) как при наличии, так и при отсутствии спонтанной вентиляции легких. При этом внутриальвеолярное давление повышается незначительно, а газообмен существенно улучшается;
б) дополнительным замыканием маски, интубационной или трахеостомической трубки при спонтанной вентиляции в режиме ПДКВ со свободным концом емкости водного затвора; тогда при вдохе режим газотока между легкими и затвором не меняется, но при выдохе избыточное давление перед клапаном ПДКВ перекрывает и выход из затвора: непораженные зоны легких раскрываются, а дополнительной утечки через свищ нет;
в) соединением канала вдоха с емкостью водного затвора при ИВЛ любого режима: его перекрывает высокое давление вдоха и утечка через свищ при искусственном вдохе также устраняется.
Послеоперационная дыхательная недостаточность
Несмотря на значительные успехи клинической физиологии дыхания, различные формы послеоперационной дыхательной недостаточности (пневмония, ателектаз, синдром шокового легкого, тромбоэмболия легочной артерии) остаются наиболее частым осложнением. Такое положение можно связать с совокупностью предоперационных, операционных и послеоперационных факторов, обрушивающихся на легкие больного.
Факторы, предрасполагающие к развитию дыхательной недостаточности. Предоперационные факторы. На первом месте следует поставить пожилой возраст: это связано с потерей эластичности легких, ранним ЭЗДП — одним из главных физиологических механизмов дыхательной недостаточности.
Наличие предшествующей патологии легких в послеоперационном периоде может привести к острой дыхательной недостаточности, связанной с повышенным образованием мокроты, инфицированием легких. Ожирение всегда сопровождается гиповентиляцией и ранним ЭЗДП, Курение нарушает мукоцилиарный механизм дренирования мокроты, снижает количество сурфактанта, увеличивает вероятность тромбоэмболических осложнений.
Операционные факторы. Вредная операционная позиция создает условия для ателектазирования легких. Об этом свидетельствуют результаты измерения статических объемов легких, ЭЗДП и альвеолярного шунта (рис. 38). Характер операции отражается на частоте послеоперационной дыхательной недостаточности: чем ближе к диафрагме располагается зона операции, тем выраженнее послеоперационная гиповентиляция. Продолжительность операции: показано, что при операциях, длящихся свыше 4 ч, послеоперационная дыхательная недостаточность возникает в 3 раза чаще, чем после операций продолжительностью менее 2 ч [Risser N. L., 1980, и др.]. Большое значение имеют объем и характер трансфузионной терапии во время операции. Закупорка легочного капиллярного фильтра микросгустками или снижение онкотического давления при избыточном введении кристаллоидных растворов может иметь большое значение в возникновении послеоперационной дыхательной недостаточности.
Послеоперационные факторы. Ко всем факторам двух предыдущих групп добавляются еще два — боль и неподвижность.
Различные физиологические механизмы нарушения дыхания у специально обследованных нами в послеоперационном периоде больных встречались со следующей частотой:
% от числа обследованных больных
Смещение регионарной вентиляции из нижних зон в расположенные выше 49
Снижение растяжимости легких — грудной клетки 72
Рост общего дыхательного сопротивления 66
Увеличение альвеолярного мертвого пространства 59
Увеличение альвеолярного шунта 63
Снижение резерва функциональной остаточной емкости (следствие ЭЗДП) 86
Не все перечисленные расстройства доходят до клинически выявляемой пневмонии или ателектаза, но совершенно очевидно, что подходящая база для них имеется.
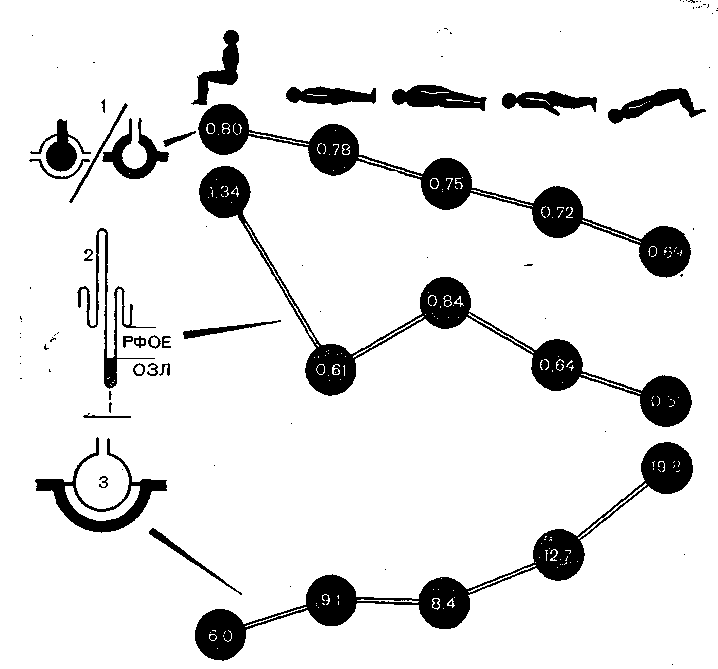
Рис. 38. Вентиляционно-перфузионное соотношение, экспираторное закрытие дыхательных путей (ЭЗДП) и альвеолярный шунт при разных операционных позициях.
1 — индекс вентиляционно-перфузионного соотношения в нижних для данного положения тела зонах легких; 2 — резерв функциональной остаточной емкости легких (РФОЕ, л); 3 — альвеолярный шунт (% минутного объема кровообращения). Как следует из этого сопоставления, чем выраженное ЭЗДП, тем ниже вентиляционно-перфузионное соотношение и тем больше альвеолярный шунт.
Влияние предшествующей легочной патологии, инфекции, ожирения, пожилого возраста на дыхательные расстройства послеоперационного периода вполне понятны без клинико-физиологических рассуждений. Постуральные эффекты операционной позиции описаны выше. Здесь же целесообразно рассмотреть физиологические механизмы послеоперационной дыхательной недостаточности, относящиеся к двум взаимосвязанным факторам, — боли и неподвижности.
Физиологические механизмы. Физиологические механизмы, которыми послеоперационная боль влияет на систему дыхания, можно разделить на две группы: 1) внешнее ограничение вентиляции болью при первично неизмененных легких и 2) первичное поражение легких механизмами боли.
В первую группу могут быть включены следующие механизмы.
Ограничение дыхательных экскурсий из-за боли. Естественно, что гиповентиляция при этом механизме чаще наблюдается после операций на органах грудной клетки и верхнем отделе живота, когда больной из-за болей не может сделать полного вдоха. Однако такое ограничение не привело бы к тяжелой дыхательной недостаточности, если бы не два его опасных последствия: нарушение кашлевого механизма очистки легких и ЭЗДП.
Нарушение кашля. Чтобы кашель способствовал удалению мокроты, необходим не только достаточный объем вдоха, но и мгновенное сокращение мышц брюшной стенки. Боль препятствует кашлевым толчкам, и достаточной очистки дыхательных путей от мокроты не происходит. Между тем после всех операций, независимо от их характера, образование мокроты повышено из-за напряжения недыхательных функций легких, в связи с чем возникает обструкция мелких дыхательных путей.
Анализ полученных в нашей лаборатории данных о кривой поток — объем максимального выдоха (Е. А. Зильбер) показывает, что на высоте послеоперационной боли поток при выдохе до 25% ЖЕЛ (П25), характеризующий проходимость мелких дыхательных путей, снижается с 1,96±0,31 л·с-1 (предопера: ционный уровень) до 0,86±0,16 л·с-1 (М±m), т. е. вдвое.
ЭЗДП. По нашим данным, ЭЗДП является главным механизмом нарушения дыхания в связи с послеоперационной болью.
В связи с регионарными различиями в легочных давлениях ЭЗДП начинается с нижних зон легких, где и возникает наклонность к ателектазированию. Поскольку послеоперационная боль делает больного неподвижным в постели, в нижних зонах легких быстро накапливается мокрота, так как если бы даже больной кашлял, ЭЗДП не позволило бы мокроте выделиться из нижних зон.
Механизм ЭЗДП в послеоперационном периоде зависит от характера операции: чем ближе к диафрагме располагается операционная зона, тем выраженнее ЭЗДП. Так, по данным И. Г. Хейфеца (1978), резерв ФОБ после гинекологических операций не изменился, после операций на почке и мочеточнике уменьшился с —5,5±2,2 до —10,3±3,7, а после операций на желудке, селезенке и желчном пузыре —с —5,0±3,1 до —15,9±2,4% ЖЭЛ.
В дальнейшем все механизмы нарушения дыхания под влиянием боли связаны с катехоламинемией — постоянным следствием каждой боли.
Парез кишечника. Катехоламинемия и адренергическая стимуляция подавляют парасимпатическую активность, которая обеспечивала мышечный тонус и перистальтику желудка и кишечника. Возникают парез желудка и кишечника, экскурсии диафрагмы резко ограничиваются, дыхательная недостаточность нарастает. Облегчаются рвота и возникновение аспирационного синдрома.
Другая группа механизмов послеоперационной дыхательной недостаточности ведет к первичному поражению легких под влиянием боли. Это происходит из-за активного вовлечения в процесс недыхательных функций легких. В болевой процесс вовлекаются прежде всего три функции: очистка легких от механических примесей, участие в свертывающей и фибринолитической системах, контроль биологически активных веществ.
Рассмотрим механизмы болевого воздействия на легкие.
Закупорка легочного капиллярного фильтра. Катехоламинемия нарушает реологические свойства крови, и образуются агрегаты, которые задерживаются легочным капиллярным фильтром. Возникают: 1) смещение кровотока из капилляров в анастомозы, благодаря чему растет альвеолярный шунт; 2) нарушение питания альвеолярной ткани, в связи с чем снижается продукция сурфактанта, уменьшается растяжимость легких и возрастает гиповентиляция; 3) возникает интерстициальный отек альвеол и бронхиол, вследствие чего ухудшается альвеолокапиллярная диффузия и усиливается ЭЗДП.
Действие биологически активных веществ. Связанный с болью артериолоспазм приводит к ишемии тканей, поэтому образование биологически активных веществ (кинины, простагландины, серотонин и др.) в них резко возрастает. Эти вещества также задерживаются и метаболизируются легкими, которые при этом повреждаются, в частности проницаемость тканей становится больше и возникает интерстициальный отек.
Обструкция мокротой. Напряжение недыхательных функций легких, связанное с болью, приводит к усилению высокоэнергетических процессов в легочной ткани и обильному образованию шлаков, т. е. мокроты. Чем выраженнее послеоперационная боль, тем больше образуется мокроты и тем вероятнее обструктивные расстройства, поскольку механизм кашля, как уже говорилось, также ограничен болью.
К задержке мокроты могут вести не только болевые механизмы, но и ряд других: 1) высушивающее действие атропина, нарушающего мукоцилиарный транспорт; 2) повреждение трахеальной стенки интубационной трубкой и отсасывающими катетерами; 3) недостаточное увлажнение дыхательных путей и газов во время операции и в послеоперационном периоде.
Рвота и аспирация. Известно, что рвотный центр, расположенный в стволе мозга, связан афферентными путями с хеморецепторной триггерной зоной в дне IV желудочка. Эта зона бурно реагирует на катехоламинемию, уровень которой под действием боли растет. Рвота на фоне выраженной послеоперационной боли возникает чаще, вероятность аспирационного пневмонита возрастает.
Не следует, разумеется, считать причиной послеоперационного нарушения дыхания только болевой синдром. Как уже отмечалось, послеоперационные дыхательные осложнения зависят от основной или сопутствующей патологии легких, вредного положения тела на операционном столе, операционного стресса, трансфузионной терапии и т. д. Однако вредная операционная позиция и предшествующая дыхательная патология могут отсутствовать, опасности операции могут своевременно устраняться настороженной анестезиологической бригадой, тогда как послеоперационная боль есть всегда и от ее многообразного патологического действия на дыхательную систему не спрятаться ни больному, ни врачу.
Функциональная диагностика и оценка физиологических механизмов дыхательной недостаточности изложены в главе 2.
Принципы интенсивной терапии. Управлять послеоперационными болевыми расстройствами дыхания можно на двух уровнях. Во-первых, необходимо своевременно обрывать все патологические влияния боли на дыхательную систему, пока функциональные нарушения не превратились в осложнения. Для этой цели мы располагаем большим комплексом средств респираторной терапии, которая заключается в очистке дыхательных путей, увлажнении и обработке мокроты, стимуляции и имитации кашля, борьбе с ЭЗДП дополнительным дыхательным сопротивлением выдоху, различными методами антигипоксической терапии.
Особое внимание надо обратить на следующие важные мероприятия.
1. Реологические свойства мокроты в послеоперационном периоде ухудшены, а продукция ее увеличена, в связи с этим аэрозольная ингаляция дистиллированной воды, изотонического раствора хлорида натрия и муколитических средств должна начинаться с первых минут послеоперационного периода,
2. Необходимо стимулировать кашель, но делать это в разных положениях больного в постели, чтобы поочередно очищались не только верхние, но и расположенные внизу зоны легких. Ранняя подвижность больного в постели при отсутствии боли существенно облегчает выполнение этого пункта профилактики и интенсивной терапии послеоперационной дыхательной недостаточности.
3. Поскольку одним из главных механизмов послеоперационной дыхательной недостаточности является ЭЗДП, для его устранения необходимо с самого начала применять дополнительное сопротивление выдоху, чтобы создать режим ПДКВ.
4. Положение тела имеет значение не только для оптимизации кашля. Известно, что зоны легких, склонные к ателектазированию, должны располагаться выше, поэтому положение на здоровом боку функционально выгоднее. Положение на животе с опорами под тазовым и плечевым поясом дает наибольшую функциональную остаточную емкость легких. Поскольку одним из механизмов, которым режим ПДКВ улучшает вентиляцию, является увеличение ФОБ, положение на животе также может иметь лечебное значение.
5. Дыхательная гимнастика с увеличением вдоха и пассивизацией выдоха способствует профилактике и лечению послеоперационной дыхательной недостаточности.
Но едва ли не главным средством профилактики послеоперационной дыхательной недостаточности остается послеоперационное болеутоление, которое осуществляется следующими методами (см. главу 6): 1) центральной анальгезией наркотическими и ненаркотическими анальгетиками (опасаться центральной депрессии дыхания!); 2) перидуральной блокадой местными анестетиками и наркотическими анальгетиками; 3) методами рефлексотерапии — чрескожной стимуляцией нервов, игло- и электроанальгезией и др.
Во-вторых, важное значение в профилактике и лечении послеоперационной дыхательной недостаточности имеет своевременная ликвидация пареза кишечника, инфекционных осложнений и метаболических расстройств.
