
- •Введение
- •Часть I клиническая физиология главных синдромов критических состояний
- •Глава 1
- •Физиологические эффекты гиповолемии
- •Функциональные критерии
- •Глава 2 острая дыхательная недостаточность
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Свертывание крови и фибринолиз
- •Первичная адгезия и агрегация
- •Реакция освобождения и вторичная агрегация
- •Принципы интенсивной терапии
- •Глава 4 гепаторенальный синдром
- •Физиологические механизмы
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Глава 5 острая церебральная недостаточность
- •Физиологические механизмы
- •Функциональные критерии
- •Прогноз неврологического статуса
- •Принципы интенсивной терапии
- •Глава 6 болевой синдром
- •Физиологические механизмы
- •Принципы интенсивной терапии
- •Глава 7 операционный стресс
- •Функциональные критерии
- •Принципы физиологической защиты
- •Глава 8 нарушение метаболизма
- •Пути управления метаболизмом
- •Нарушение осмол яркости и водно-электролитного баланса
- •Часть II клиническая физиология методов интенсивной терапии, анестезии и реанимации
- •Реанимация при остановке сердца и дыхания
- •Г л а в а 11 инфузионная и трансфузионная терапия
- •Инфузия медикаментов
- •Парентеральное питание
- •Методы инфузионной терапии
- •Глава 12 вспомогательное кровообращение
- •Метод контрпульсации
- •Шунтирование желудочков
- •Функциональные эффекты
- •Глава 13 респираторная терапия
- •Оптимизация естественных механизмов дренирования мокроты
- •Глава 14 антигипоксическая терапия (ингаляционная, трансфузионная и медикаментозная)
- •Ингаляционная оксигенотерапия
- •Гипербарическая оксигенация
- •Энтеральная оксигенация
- •Трансфузионая оксигенация
- •Искусственная вентиляция легких
- •Клинико-физиологические аспекты процедуры искусственной вентиляции легких
- •Объективные критерии
- •Глава 16 искусственная миоплегия
- •Миорелаксанты и мышечная система
- •Глава 17 детоксикационная терапия
- •Стимуляция естественной детоксикации
- •Искусственная детоксикация
- •Синдроматическая терапия
- •Глава 18 мониторизация
- •Принципы мониторизации
- •Методы и цели
- •Параметры мониторизации
- •Часть III клинико-физиологический анализ итар в повседневной практике
- •Глава 19 акушерство
- •Амниотическая эмболия
- •Эклампсия
- •Глава 20 неонатология и педиатрия
- •Реанимация новорожденных
- •Бронхиолит
- •Синдром внезапной смерти младенца
- •Глава 21 пульмонология Влияние анестезиологического пособия на дыхание
- •Тромбоэмболия легочной артерии
- •Бронхоастматический статус
- •Отек легких
- •Синдром шокового легкого
- •Глава 22 кардиология
- •Внезапная кардиальная смерть
- •Кардиогенный шок
- •Глава 23 гепатология
- •Острая печеночная недостаточность
- •Нефрология Влияние анестезии на функции почек
- •Острая почечная недостаточность
- •Глава 25 гематология
- •Геморрагический шок
- •Глава 26 неврология и нейрохирургия
- •Эпилептический статус
- •Столбняк
- •Поражение головного мозга
- •Поражение спинного мозга
- •Глава 27 гастроэнтерология
- •Острейший гастроэнтерит
- •Травматология
- •Травматический шок
- •Синдром жировой эмболии
- •Газовая эмболия
- •Глава 29 иммунологические аспекты практики итар
- •Аллергия в практике итар
- •Анафилактический шок
- •Септический шоковый синдром
- •Список литературы
- •Оглавление
- •Часть I. Клиническая физиология главных синдромов критических состояний ..........……………………………………….. 12
- •Глава 1. Нарушение реологии крови и острая гиповолемия .…………….. 12
- •Глава 2. Острая дыхательная недостаточность ...…………………………... 30
- •Глава 11. Инфузионная и трансфузионная терапия ....……………………… 141
- •Глава 21. Пульмонология ...........………………………………………………….. 250
- •Глава 28. Травматология . . . .......………………………………………………….. 341
- •Глава 29. Иммунологические аспекты практики итар ..…………………….. 351
Глава 2 острая дыхательная недостаточность
Острая дыхательная недостаточность является компонентом любого критического состояния, даже если первичного поражения легких не было. Чтобы доказать это, рассмотрим сначала участие легких в патологии различных систем организма, а затем уже физиологические механизмы острой дыхательной недостаточности (ОДН), клиническую физиологию гипоксии и гиперкапнии, объективные критерии ОДН и принципы ее интенсивной терапии.

Рис. 8. Недыхательные функции легких.
1 — очистка крови от механических примесей (агрегаты клеток, микроэмболы и т. п.); 2 — участие в водно-электролитном балансе; 3 — деструкция и синтез липопротеидов; 4 — участие в теплопродукции и теплоотдаче; 5 — поддержание гемодинамического равновесия между правой и левой половиной сердца; 6 —участие.в регуляции кислотно-щелочного состояния; 7 — контроль уровня биологически активных веществ (гормоны, кинины, простагландины и др.) и некоторых медикаментов; 8 — участие в свертывающей, антикоагулянтной и фибринолитической активности крови; 9 — иммунная защита организма (очистка воздуха и крови от инфекционных агентов).
Легкие в патологии различных систем организма
Отождествить дыхание и функции легких нельзя по двум главным соображениям: 1) в систему дыхания, воротами которой являются легкие, входят, помимо них, транспорт газов между легкими и тканями и тканевая утилизация кислорода; 2) легкие выполняют не только функцию газообмена между кровью и воздухом, но и многообразные недыхательные функции механического и метаболического характера, которые связывают легкие прямой зависимостью с прочими системами организма и делают этот орган соучастником самой разнообразной патологии других органов.
К важнейшим недыхательным функциям легких, которыми клиническая физиология заинтересовалась сравнительно недавно, относятся (рис. 8):
защитная функция: легкие задерживают вредные механические и токсические продукты, поступающие из окружающей атмосферы — 90% частиц диаметром больше 2 мкм задерживаются в легких и удаляются. Так действует слизь дыхательных путей, содержащая лизоцим и различные иммуноглобулины, макрофаги и альвеоциты I и II типа. Кстати, недавно появилась гипотеза о том, что защищая себя от канцерогенных продуктов, легкие удаляют их с мокротой, которая, заглатываясь больными способствует возникновению рака желудка;
2) очистительная (фильтрационная) функция: легкие очищают кровь от механических примесей— агрегатов клеток, капель жира, мелких тромбов, бактерий, крупных атипичных клеток; все это задерживается в легких и подвергается деструкции и метаболизму;
3) фибринолитическая и антикоагулянтная функция: лизис уловленных тромбов, поддержание фибринолитической и антикоагулянтной активности крови;
4) деструкция и синтез белков и жиров (легкие исключительно богаты протеолитическими и липолитическими ферментами); в легких продуцируется сурфактант — смесь липопротеидов, способствующая стабильности альвеолярной ткани;
5) участие в водном балансе: легкие удаляют около 500 мл воды в сутки, поддерживая нормальную осмолярность крови и тканей удалением углекислого газа и соответственным изменением уровня осмотически активных карбонатов (15—30 осмоль в сутки). Вместе с тем различные жидкости могут всасываться в легких мгновенно, что впервые отмечено С. Bernard еще в 1857 г. Это, кстати, можно использовать для срочного введения лекарств, когда внутривенный путь недоступен (например, адреналин, введенный через трахею, оказывается в крови через 30 с). Проблема участия легких в водном обмене тесно связана с проблемой внесосудистого объема воды в легких, который меняется при всех критических состояниях и находится в прямой связи с механизмами острой дыхательной недостаточности. В 1980 г. этой проблемой занималась специальная конференция [Staub N. С., Hogg J. С., 1980];
6) избирательная деструкция, продукция и хранение биологически активных веществ: серотонина, гистамина, медленно реагирующей субстанции анафилаксии (SRS-A), ангиотензина, ацетилхолина, норадреналина, кининов и простагландинов, выполнивших свою роль в тканях и подлежащих удалению из крови;
7) детоксикация некоторых лекарственных препаратов — аминазина, индерала, сульфаниламидов и др.;
8) теплопродукция и теплоотдача: суточный теплообмен легких в нормальных условиях около 350 ккал, а в условиях критического состояния может быть увеличен в несколько раз;
9) гемодинамическая функция: легкие являются резервуаром и одновременно прямым шунтом крови между правой и левой половинами сердца, благодаря чему поддерживается непрерывность кровотока, несмотря на противоположное воздействие вдоха и выдоха на большой и малый круг кровообращения (см. предыдущую главу).
Эти важнейшие для организма недыхательные функции легких не только делают их соучастником любой тяжелой патологии организма, но и требуют даже в условиях здоровья для высокого внутрилегочного метаболизма не ничтожных количеств кислорода, как полагали ранее на протяжении целого века, а не менее 10% общего поглощаемого организмом кислорода [Young S. L., Tierney D. F., 1977]. Что же говорить тогда о критическом состоянии, когда недыхательные функции легких неизбежно перенапрягаются!
Прошлое представление о питании легких от бронхиальных артерий также оказалось неверным: альвеолярная часть легких дистальнее респираторных бронхиол питается кровью легочных артерий, а дыхательные пути проксимальнее респираторных бронхиол кррвоснабжаются бронхиальными артериями. Как будет видно из дальнейших рассуждений, увеличивая кровоснабжение альвеолярной части легких по сравнению с возможностями бронхиального кровотока, при критических состояниях легочная артерия несет легким беду, которая нередко оказывается непоправимой.
Теперь становятся понятными многие клинические синдромы, которые раньше трудно было объяснить. Если легочный кровоток снижается настолько, что собственный метаболизм легких не обеспечивается, возникает ишемия легких, сопровождающаяся снижением образования веществ, которые легкие должны продуцировать, например сурфактанта. Страдает и деструкция веществ, разрушаемых легкими, например серотонина. Увеличивается также и проницаемость альвеолокапиллярной мембраны.
Что же такое острая дыхательная недостаточность? Острая дыхательная недостаточность—это неспособность легких превратить притекающую к ним венозную кровь в артериальную. Такое определение является условным в связи с двумя обстоятельствами:
1) мы искусственно ограничили дыхание только легочными процессами, сделав это сознательно, потому что поражение остальных компонентов дыхания требует принципиально иных методов интенсивной терапии. При этом мы подразумеваем, что неспособность легких может быть связана не только с сугубо легочной патологией, но и с поражением грудной стенки, дыхательных мышц, центральной регуляции дыхания и т. д.;
2) артериальная кровь отличается от венозной не только по газовому составу (О2 и СО2), но и по механическим примесям и биохимическому содержанию. Однако в силу традиции главными объективными критериями ОДН мы считаем количества О2 и СО2 в артериальной крови. Вместе с тем предшествующие рассуждения о недыхательных функциях легких не были высоким теоретизированием, не связанным с повседневной клинической практикой, поскольку недостаточность газообмена почти всегда бывает вторичной по отношению к поражению недыхательных функций. Это важнейшее обстоятельство делает ОДН постоянным компонентом любого критического состояния – от травматического шока до бронхоастматического статуса.
Представим себе кровотечение, потребовавшее массивного переливания крови. Легочный капиллярный фильтр очистит кровь от механических примесей и будет растворять микротромбы, выделяя много шлаков — мокроту. Если она хорошо дренируется, легкие справляются с этой задачей. А если больной без сознания? Или гипоксия подавила ферментативные механизмы самих легких?
При любой лихорадке высокий метаболизм тканей сопровождается повышенным поступлением в легкие агрессивных метаболитов, которые должны подвергаться деструкции. Хватит ли возможностей легких для такой детоксикации? Если гиповолемия (бывающая, как уже отмечалось, при л ю б о м критическом состоянии) будет сопровождаться ишемией легких, смогут ли они выработать сурфактант, чтобы нормально раскрываться при вдохе? А если имеется застой крови в легких, достаточно ли будет мышечных усилий, чтобы раскрыть жесткие легкие?
Можно поставить еще множество вопросов, но и без этого напрашивается важный клинический вывод: нет такого по-ражения в организме, при котором бы вторично не страдали легкие,и нет критического состояния, которое протекало бы без дыхательной недостаточности. Следовательно, профилактика и устранение острой дыхательной недостаточности — обязательный компонент интенсивной терапии любого критического состояния. Рассмотрев недыхательные функции легких, мы приходим к такому важнейшему заключению.
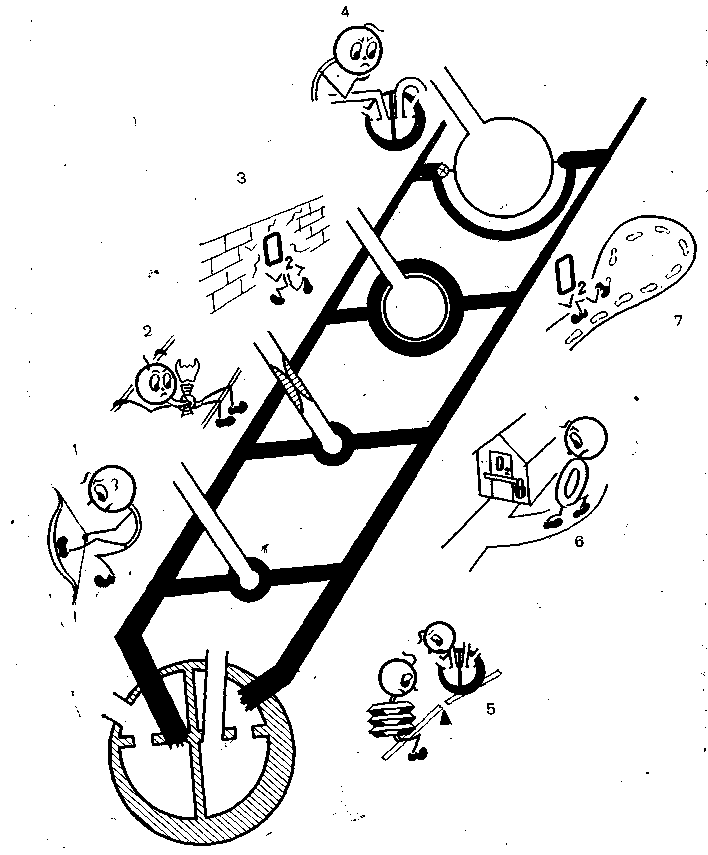
Рис. 9. Физиологические механизмы острой дыхательной недостаточности.
Первичные механизмы — рестрикция (1), обструкция (2), нарушение альвеолокапиллярной диффузии (3), перфузии (4) и следствия — нарушение вентиляционно-перфузионного соотношения (5), альвеолярный шунт (6), дыхательное мертвое пространство (7).
Физиологические механизмы острой дыхательной недостаточности
Каковы физиологические механизмы нарушения дыхательных функций легких, знание которых помогло бы обосновать меры интенсивной терапии?
Дыхательная функция легких осуществляется с помощью трех процессов, протекающих в них: вентиляции альвеол воздухом, перфузии легочных капилляров и диффузии газов через альвеолокапиллярную мембрану. Нарушение этих трех процессов приводит к главным механизмам ОДН (рис. 9).
Если у больного возникло апноэ, нет нужды в мудрых клинико-физиологических рассуждениях: надо немедленно начать искусственную вентиляцию легких, на фоне которой уже можно и поразмышлять. Естественно, в подобной ситуации прежде всего появляется мысль о нарушении вентиляции легких.
Нарушение вентиляции. Транспорт воздуха в легких обеспечивается изменением объема грудной клетки под действием дыхательных мышц. Адекватность вентиляции зависит от следующих взаимосвязанных факторов: 1) состояния центральной регуляции дыхания; 2) активности дыхательных мышц; 3) целости и подвижности грудной стенки; 4) проходимости дыхательных путей; 5) податливости (растяжимости) легочной ткани; 6) внутрилегочного распределения газа соответственно степени перфузии различных отделов легкого.
Нарушения вентиляции легких в виде гиповентиляции или апноэ могут быть связаны с каждым из перечисленных факторов в отдельности или их совокупностью. Три первых механизма патологии вентиляции можно объединить как внелегочные. Если при них и возникает поражение легких, то уже вторично. Три последних механизма ОДН можно назвать легочными, так как они связаны с поражением самих легких.
Нарушение проходимости дыхательных путей (обструктивные расстройства)—важнейший тип патологии вентиляции легких, которым начинается или заканчивается любая пшовентиляция. К обструктивным расстройствам могут вести различные причины:
1) обструкция дыхательных путей мокротой и инородными материалами. Обструкция мокротой возникает в результате трех обычно взаимосвязанных расстройств: ухудшения реологических свойств мокроты, нарушения мукоцилиарного транспорта и поражения кашлевого механизма. Ухудшение реологических свойств мокроты — постоянный спутник всех критических состояний. Реология мокроты и методы ее оценки рассмотрены в другой книге [Зильбер А. П., 1977];
2) спазм, отек и воспаление дыхательных путей на различных уровнях — от ротовой полости до бронхиол;
3) экспираторное закрытие дыхательных путей (ЭЗДП) возникает при бронхоастматическом состоянии, обструктивной эмфиземе легких, неправильном режиме искусственной вентиляции легких (в частности, при избыточном разрежении на выдохе).
Суть этой нередкой патологии состоит в следующем. При спокойном дыхании отдельные легочные зоны дышат неравномерно, слегка асинхронно, по у здоровых людей дыхательные пути остаются свободными как при вдохе. так и при выдохе. Если здоровый человек делает максимальный выдох до уровня остаточного объема легких, когда больше ничего уже выдохнуть нельзя, он внешним усилием сдавливает собственные дыхательные пути. В силу регионарных различий механических свойств легких вначале сдавливаются нижние, а затем расположенные выше дыхательные пути. Эластичность бронхиол и альвеол препятствует их сдавлению. Если эластичность теряется (эмфизема легких, пневмосклероз и т. п.), часть дыхательных путей закрывается не только при максимальном выдохе, но уже при спокойном дыхании. То же самое происходит при частичном сужении бронхов мокротой, так как воздушный поток в зоне сужения ускоряется. Те зоны легких, в которых произошло преждевременное закрытие дыхательных путей, гиповентилируются, но кровоток через них сохраняется. Следовательно, протекающая через эти зоны венозная кровь не может полностью артериализироваться к в большой круг кровообращения поступает кровь с плохим газовым составом (рис. 10).
Универсальное объяснение механизма ЭЗДП, пригодное как для нормальных, так и патологических условий, дает теория- нелинейной неравномерности функций легких. Регионарные различия механических свойств легких в сочетании с гравитационным фактором создают условия для нелинейного распределения вентиляции легких. В связи с этим различные по механическим характеристикам зоны легких при графическом изображении попадают в разные точки кривых зависимости давление — объем и давление — объемная скорость. Иначе говоря, различные зоны легких вентилируются асинхронно, с неодинаковой объемной скоростью и, следовательно, при разных градиентах плеврального (внутрибронхиального) давления. Транспульмональное давление также имеет регионарные различия. Этим можно объяснить, что в нижних зонах ЭЗДП проявляется раньше, чем в верхних, что вначале закрываются мелкие, а затем крупные дыхательные пути, что сужение и спадение (коллапс) дыхательных путей — разные стадии единого физиологического механизма (подробнее см.: А. П. Зильбер, 1977).
Патология податливости (растяжимости) альвеолярной ткани (рестриктивные расстройства)— следующий механизм нарушения вентиляции легких — встречается при различных острых и хронических поражениях.
К рестриктивным расстройствам приводят:
1) потеря эластических волокон;
2) отек интерстициальной ткани легких при старении, перерождении и т. п.;
3) недостаток сурфактанта — поверхностно-активного вещества, выстилающего внутреннюю стенку альвеол и облегчающего растяжение альвеолы при ее минимальном объеме (т. е. после выдоха) (подробнее о сурфактанте легких см. главу 20).
Пневмония, ателектаз, респираторный дистресс-синдром новорожденных, ожоговый или аспирационный пневмонит, колла-генозы легких— типичные поражения, при которых ведущим механизмом патологии вентиляции является снижение растяжимости легких.
Нарушение внутрилегочного распределения га з а соответственно степени перфузии отдельных легочных зон — последний фактор, ведущий к неадекватной вентиляции легких. Все перечисленные выше физиологические механизмы могут вызвать это несоответствие, и тогда вполне достаточная по объему вентиляция легких может быть неадекватной потребностям организма именно из-за нарушения внутрилегочного распределения.
Резюмируя патологические эффекты гиповентиляции и ее физиологические механизмы, следует отметить, что она дает начало одному из многих порочных кругов острой дыхательной недостаточности. При гиповентиляции (в том числе регионарной) сокращается легочный капиллярный кровоток, участвующий, помимо газообмена, в питании альвеолярной стенки (наклонность к отеку легких), что снижает продукцию сурфактанта (наклонность к ателектазу), вызывает отечность интерстициальной ткани и лимфостаз (повышение «жесткости» легкого и рост мышечной работы на фоне уже имеющейся гипоксии). Все вместе приводит к возникновению микро- и макроателектазов, т. е. к дальнейшему снижению вентиляции. Кровоток через ателектазированные зоны хотя и уменьшается, но не прекращается, и, следовательно, увеличивается шунт венозной крови, усугубляющий уже имеющуюся гипоксию.
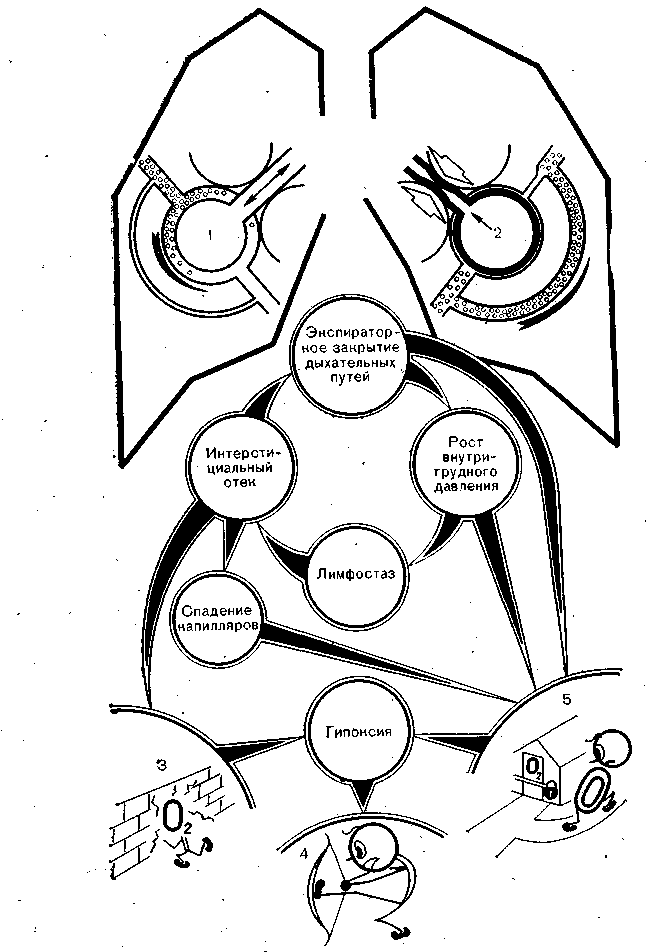
Рис. 10. Физиологические механизмы экспираторного закрытия дыхательных путей (ЭЗДП).
1 — нормально вентилируемая и перфузируемая альвеола; 2 — ЭЗДП: видны утолщение альвеолокапиллярной мембраны и шунтирование венозной крови; 3, 4, 5 — нарушение альвеолокапиллярной диффузии, рестриктивные расстройства и шунтирование крови как следствие (а также причина) ЭЗДП.
Нарушение альвеолокапиллярной диффузии. Главный механизм диффузии газов через альвеолокапиллярную мембрану — различие их парциальных давлений по обе стороны мембраны. На объем газа, проходящего через мембрану, влияет множество факторов.
Мембранное сопротивление связано со специфическими свойствами газа. Известно, например, что растворимость кислорода в ткани мембраны в 20 раз меньше, чем растворимость углекислого газа. Практически, рассуждая о патологии альвеолокапиллярной диффузии, мы говорим только о нарушении диффузии кислорода, так как углекислый газ почти всегда диффундирует в достаточных количествах. Установлено, что альвеолоартериальное различие Рсо2 возникает лишь в тех случаях, когда альвеолокапиллярная диффузия снижается более чем в 10 раз.
Скорость диффузии ограничивает общая толщина альвеолокапиллярной мембраны: чем длиннее путь от альвеолярного, газа до его носителя в капиллярной крови (эритроцит или плазма), тем медленнее протекает диффузионный процесс. Это наблюдается при интерстициальном отеке легких, пневмонии, лимфостазе.
Нарушение легочного кровотока. Движущей силой легочного кровотока (перфузии легких) является различие между давлением в правом желудочке и левом предсердии, а главным регулирующим механизмом — легочное сосудистое сопротивление. Суммировать факторы, влияющие на легочный кровоток, можно следующим образом: ОЦК, эффективность работы правого и левого жедудочков сердца, легочное сосудистое сопротивление (регулируемое баро- и хеморецепторами, газовым составом крови и воздуха и многочисленными метаболитами), внутриальвеолярное давление и действие силы тяжести. Все названные факторы тесно взаимосвязаны, и любой из них, за исключением разве только действия силы тяжести, в условиях критического состояния подвергается серьезным изменениям, которые могут стать основой острой дыхательной недостаточности.
Крайние степени нарушения легочного кровотока возникают при эмболии легочной артерии тромбом, жиром, воздухом, околоплодными водами, хотя сокращение перфузии легких является обычно лишь пусковым механизмом, но не главным фактором в танатогенезе этих терминальных состояний.
Рассуждая о легочном кровотоке как компоненте газообмена, обычно, не слишком задумываясь, подразумевают под этим легочный капиллярный кровоток. При этом ради упрощения забывают о том, что существует бронхиальный кровоток, у которого есть анастомозы с легочным кровотоком, что легочные капилляры в отличие от всех остальных капилляров организма получают венозную кровь и трансформируют ее в артериальную, что существуют анастомозы между легочными артериями (несущими венозную кровь из большого круга) и легочными венами (возвращающими большому кругу артериальную кровь).
В клинико-физиологическом аспекте представляет интерес не легочный кровоток в целом. Ясно, что объемы крови, проходящие через большой и малый круг, в конечном итоге одинаковы. Гораздо больше нас интересуют эффективный (участвующий в газообмене) капиллярный кровоток и так называемый альвеолярный (право-левый) шунт крови, или «венозная примесь». Под этим термином подразумевается объем крови, по тем или иным причинам не подвергшийся газообмену с альвеолярным воздухом. Механизмы шунтирования крови мимо альвеол разнообразны: прямые анастомозы между венами и артериями легких, впадение бронхиальных вен в легочную вену и патологические соустья в сердце или крупных сосудах, впадение в левую половину сердца тебезиевых вен, сохранение капиллярного кровотока через ателектаз, преобладание кровотока над вентиляцией и нарушение альвеолокапиллярной диффузии.
Можно с уверенностью заявить, что нет таких форм острой дыхательной недостаточности, при которых рост альвеолярного шунта крови не являлся бы ведущим или сопутствующим механизмом патологии.
Неравномерность легочных функций. Многообразные сочетания вентиляции и кровотока результируются в общей неравномерности функций легких. Можно заранее утверждать, что в связи с различным действием силы тяжести на вентиляцию (воздух) и перфузию (кровь) неравномерность легочных функций должна существовать как у здорового человека, так и при различных заболеваниях или несчастном случае. Может наблюдаться регионарная неравномерность вентиляционно-перфузионных соотношений, т. е. их различие в отдельных легочных зонах. Она имеет довольно четкую топографию, вызванную главным образом действием силы тяжести и различием механических свойств легких. Однако в каждой зоне с собственным соотношением вентиляции и кровотока существует так называемая послойная неравномерность вентиляции и кровотока, связанная с тем, что новый воздух и новая кровь поступают не в пустое место, а в пространства, содержащие отработанный газ и кровь. Следовательно, принципиально неравномерность вентиляции и кровотока сохраняется до самой последней альвеолы и самого крайнего капилляра.
Как уже было отмечено, дыхательная недостаточность — это неспособность легких превратить венозную кровь в артериальную: в конечном счете газовый состав артериальной крови зависит главным образом именно от внутрилегочного распределения соотношений вентиляции и кровотока.
Мерой неравномерности вентиляционно-перфузионных отношений в легких могут служить величины альвеолярного мертвого пространства и альвеолярного шунта, связанные между собой прямо пропорциональной зависимостью.
Все перечисленные механизмы острой дыхательной недостаточности ведут к нарушению газового состава артериальной крови, т. е. гипоксии и гиперкапнии, которые вовлекают в патологический процесс все системы организма.
Клиническая физиология гипоксии и гиперкапнии
Существует традиционное деление гипоксии на пять форм: легочную (гипоксическую, или дыхательную), циркуляторную, гемическую, гистотоксическую (тканевую) и смешанную.
Легочная гипоксия наблюдается при недостаточном поступлении кислорода в кровь легочных капилляров. Она может быть связана с низкой концентрацией кислорода во вдыхаемой смеси и со всеми перечисленными выше физиологическими механизмами острой дыхательной недостаточности: апноэ, обструкцией дыхательных путей, рестрикцией альвеолярной ткани, диффузионными расстройствами, альвеолярным шунтом и другими нарушениями вентиляционно-перфузионных соотношений.
Циркуляторная гипоксия возникает при нарушении транспорта кислорода к тканям из-за расстройств кровообращения. Наиболее частый вариант этого механизма гипоксии при острой дыхательной недостаточности — нарушение тканевой микроциркуляции и реологических свойств крови.
Гемическая гипоксия — это результат несостоятельности крови как газотранспортирующей среды. Такой механизм гипоксии наблюдается при острой и хронической анемии, отравлении окисью углерода, внутрисосудистом гемолизе. Частый вариант такой гипоксии при острой дыхательной недостаточности — неспособность гемоглобина связывать или отдавать кислород из-за резких нарушений кислотно-щелочного состояния крови и тканей с выраженными сдвигами рН, нарушающими диссоциацию оксигемоглобина.
Гистотоксическая гипоксия (дизоксия) — неспособность тканей усвоить поступающий к ним кислород — возникает при поражении ферментативных процессов. Такая гипоксия типична для отравлений цианидами и окисью углерода, резких сдвигов кислотно-щелочного состояния, острой печеночной недостаточности, кислородной интоксикации. Последний вариант гипоксии выглядит особенно обидным: ведь это по сути дела гипероксическая гипоксия, которая усугубляется еще и тем, что при ингаляции гипероксических смесей возрастает альвеолярный шунт. Фактически при гистотрксической гипоксии недостатка кислорода, т. е. гипоксии как таковой, нет. Мы обозначаем гистотоксическую гипоксию термином дизоксия, под которым подразумеваем неспособность тканей усваивать кислород, поступающий в них в достаточном количестве (подробнее см. главу 14).
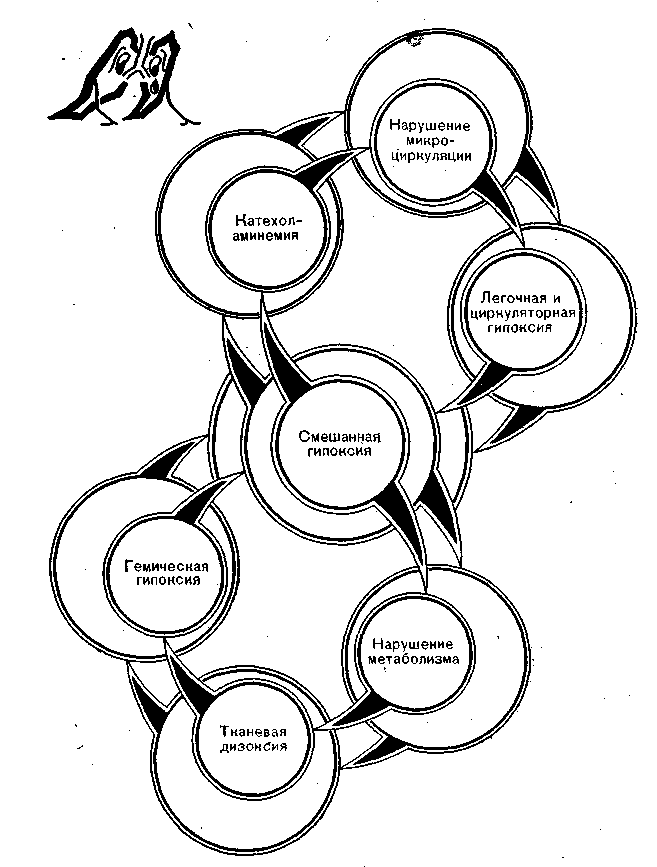
Рис. 11. Гипоксический порочный круг.
Смешанная форма гипоксии, видимо, наиболее частая. Даже если первичная гипоксия была легочной, то ее физиологические эффекты приводят к циркуляторной гипоксии, поскольку возникает артериолоспазм и нарушение реологии крови. Метаболические расстройства добавляют к уже имеющейся гипоксии гемический и гистотоксический (дизоксический) компоненты, и гипоксический порочный круг (рис. 11) замыкается, приближая печальный конец.
Меняется активность центральной нервной системы, увеличивается проницаемость мембран мозга, развивается отек, что может проявиться эйфорией, повышенной возбудимостью, судорогами, комой.
Стимулируется симпатико-адреналовая система. Возникает катехоламинемия, которая спазмирует артериояы и нарушает креветок в системах микроциркуляции. С этого момента начинается нарушение реологических свойств крови, рассмотренное в предыдущей главе. Возникает секвестрация крови, которая в масштабах целого организма значительно сокращает ОЦК. Развивающаяся гиповолемия уменьшает сердечный выброс, а в ответ на это сокращаются новые артериолы, замыкая порочный круг.
В миокарде 2/3 кислорода расходуется на сократимость, 1/3 — на остальной метаболизм. Гипоксия нарушает энергетику миокарда, возбудимость, проводимость и мышечный тонус. Возникают некробиозы и жировая дегенерация миокарда, что проявляется миокардиальной недостаточностью, тахикардией, а затем брадикардией, экстрасистолией и фибрилляцией сердца.
В легких наблюдаются вазоконстрикция, интерстициадьный отек, снижается продукция сурфактанта, падает растяжимость легочной ткани, растет обструкция из-за экспираторного закрытия дыхательных путей. Гипертензия в малом круге ведет к правожелудочковой недостаточности. Особую роль в повреждении легких при гипоксии играют реологические расстройства крови. Легочные капилляры являются механическим фильтром, задерживающим микроэмболы, агрегаты клеток и т. п. При реологических расстройствах в венозной крови резко возрастает количество клеточных агрегатов, эмульгированный жир собирается в достаточно крупные капли. Появляется множество фибринных микротромбов, потому что гипоксия и нарушение реологии дают начало рассеянному внутрисосудистому свертыванию крови. Все это задерживается в. легочных капиллярах, приводя к синдрому «шокового легкого», основу которого составляют блокада капиллярного фильтра, интерстициальный отек и снижение продукции сурфактанта.
В печени возникают центральные некрозы, выбрасывается ферритин, повышающий сопротивление портальному кровотоку, который из-за этого снижается и еще больше увеличивает гипоксию печени, поскольку она в значительной мере кормится кислородом воротной вены.
В почках гипоксия нарушает все функции по типу ишемического некронефроза.
При гипоксии как следствии острой дыхательной недостаточности может страдать система пищеварения. Катехоламинемия вызывает спазм артериол слизистой оболочки желудочно-кишечного тракта, а глюкокортикоидные гормоны снижают ее сопротивление переваривающему действию пищеварительных соков — возникают острые эрозии и язвы. В сочетании с гипоксической коагулопатией они ведут к кровотечениям, которые усиливают гемическую гипоксию. Преобладание в условиях гипоксии симпатикотонии вызывает парез кишечника, движения диафрагмы ограничиваются, гиповентиляция нарастает, усугубляется легочная гипоксия.
Неизбежно изменяется метаболизм: в связи с гипоксией и нарушением микроциркуляции в тканях накапливаются недоокисленные метаболиты, вызывая метаболический ацидоз. Это в свою очередь повышает проницаемость клеточных мембран, и ион К+ покидает клетку, вызывай на ранних стадиях гипоксии плазменную гиперкалиемию.
В тех случаях, когда гипоксия не связана с гиповентиляцией (диффузионные нарушения, альвеолярный шунт и др.), метаболический ацидоз возбуждает дыхательный центр, вызывает гипервентиляцию и как ее следствие — гипокапнию (респираторный алкалоз). Но если гипоксия оказалась результатом гиповентиляции, которую не удается компенсировать стимуляцией дыхательного центра (обструктивные и рестриктивные расстройства, нарушение центральной регуляции и мышечного тонуса и др.). то к гипоксии присоединяется гиперкапния, резко ухудшающая состояние больных, поскольку многие отрицательные эффекты гипоксии усугубляются респираторным ацидозом.
Прежде всего гиперкапния усиливает гипоксию, потому что избыток углекислоты действует на диссоциацию оксигемоглобина, нарушая его синтез в легких. Подобно гипоксии, гиперкапния повышает выброс катехоламинов, а катехоламинемия приводит к спазму артериол, росту периферического сопротивления и усилению реологических расстройств кровотока. Сократительная способность миокарда, усиливаясь вначале, постепенно сменяется угнетением. Возникает или усиливается экстрасистолия.
К нарушению вентиляции присоединяется бронхиолоспазм, увеличивается количество вязкого секрета бронхиального дерева и, следовательно, повышается бронхиальное сопротивление, а объем альвеолярной вентиляции снижается еще больше. Повышение сосудистого сопротивления в системе малого круга также способствует ухудшению газообмена.
Нарушения мозгового кровообращения обусловлены паралитическим расширением сосудов головного мозга под влиянием гиперкапнии. Это приводит к избыточной продукции ликвора и повышению внутричерепного давления, хотя наблюдается лишь при крайней степени респираторного ацидоза. Умеренная гиперкапния даже несколько улучшает мозговой кровоток.
Из-за спазма почечных сосудов страдает функция почек и нарушается мочеобразование, усугубляя электролитные нарушения, вызванные респираторным и метаболическим ацидозом.
Перечисленные физиологические механизмы вызывают довольно единообразную клинику острой дыхательной недостаточности, особенно если она достигла стадии терминального состояния, поскольку теперь клинику острой дыхательной недостаточности, независимо от ее этиологии, обусловливает сочетанный эффект гипоксии и гиперкапнии.
