
- •Введение
- •Часть I клиническая физиология главных синдромов критических состояний
- •Глава 1
- •Физиологические эффекты гиповолемии
- •Функциональные критерии
- •Глава 2 острая дыхательная недостаточность
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Свертывание крови и фибринолиз
- •Первичная адгезия и агрегация
- •Реакция освобождения и вторичная агрегация
- •Принципы интенсивной терапии
- •Глава 4 гепаторенальный синдром
- •Физиологические механизмы
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Глава 5 острая церебральная недостаточность
- •Физиологические механизмы
- •Функциональные критерии
- •Прогноз неврологического статуса
- •Принципы интенсивной терапии
- •Глава 6 болевой синдром
- •Физиологические механизмы
- •Принципы интенсивной терапии
- •Глава 7 операционный стресс
- •Функциональные критерии
- •Принципы физиологической защиты
- •Глава 8 нарушение метаболизма
- •Пути управления метаболизмом
- •Нарушение осмол яркости и водно-электролитного баланса
- •Часть II клиническая физиология методов интенсивной терапии, анестезии и реанимации
- •Реанимация при остановке сердца и дыхания
- •Г л а в а 11 инфузионная и трансфузионная терапия
- •Инфузия медикаментов
- •Парентеральное питание
- •Методы инфузионной терапии
- •Глава 12 вспомогательное кровообращение
- •Метод контрпульсации
- •Шунтирование желудочков
- •Функциональные эффекты
- •Глава 13 респираторная терапия
- •Оптимизация естественных механизмов дренирования мокроты
- •Глава 14 антигипоксическая терапия (ингаляционная, трансфузионная и медикаментозная)
- •Ингаляционная оксигенотерапия
- •Гипербарическая оксигенация
- •Энтеральная оксигенация
- •Трансфузионая оксигенация
- •Искусственная вентиляция легких
- •Клинико-физиологические аспекты процедуры искусственной вентиляции легких
- •Объективные критерии
- •Глава 16 искусственная миоплегия
- •Миорелаксанты и мышечная система
- •Глава 17 детоксикационная терапия
- •Стимуляция естественной детоксикации
- •Искусственная детоксикация
- •Синдроматическая терапия
- •Глава 18 мониторизация
- •Принципы мониторизации
- •Методы и цели
- •Параметры мониторизации
- •Часть III клинико-физиологический анализ итар в повседневной практике
- •Глава 19 акушерство
- •Амниотическая эмболия
- •Эклампсия
- •Глава 20 неонатология и педиатрия
- •Реанимация новорожденных
- •Бронхиолит
- •Синдром внезапной смерти младенца
- •Глава 21 пульмонология Влияние анестезиологического пособия на дыхание
- •Тромбоэмболия легочной артерии
- •Бронхоастматический статус
- •Отек легких
- •Синдром шокового легкого
- •Глава 22 кардиология
- •Внезапная кардиальная смерть
- •Кардиогенный шок
- •Глава 23 гепатология
- •Острая печеночная недостаточность
- •Нефрология Влияние анестезии на функции почек
- •Острая почечная недостаточность
- •Глава 25 гематология
- •Геморрагический шок
- •Глава 26 неврология и нейрохирургия
- •Эпилептический статус
- •Столбняк
- •Поражение головного мозга
- •Поражение спинного мозга
- •Глава 27 гастроэнтерология
- •Острейший гастроэнтерит
- •Травматология
- •Травматический шок
- •Синдром жировой эмболии
- •Газовая эмболия
- •Глава 29 иммунологические аспекты практики итар
- •Аллергия в практике итар
- •Анафилактический шок
- •Септический шоковый синдром
- •Список литературы
- •Оглавление
- •Часть I. Клиническая физиология главных синдромов критических состояний ..........……………………………………….. 12
- •Глава 1. Нарушение реологии крови и острая гиповолемия .…………….. 12
- •Глава 2. Острая дыхательная недостаточность ...…………………………... 30
- •Глава 11. Инфузионная и трансфузионная терапия ....……………………… 141
- •Глава 21. Пульмонология ...........………………………………………………….. 250
- •Глава 28. Травматология . . . .......………………………………………………….. 341
- •Глава 29. Иммунологические аспекты практики итар ..…………………….. 351
Глава 16 искусственная миоплегия
Медикаментозное расслабление мышц — искусственная миоплегия—может быть компонентом и анестезиологического пособия, и интенсивной терапии. В обеих ситуациях искусственная миоплегия с помощью релаксантов сочетается с различными методами искусственной вентиляции легких. Однако при клинико-физиологической оценке искусственной миоплегии надо четко различать две группы показаний к ней. Во-первых, искусственная миоплегия предпринимается, чтобы обеспечить возможность ИВЛ при операциях на органах грудной клетки, некоторых формах дыхательной недостаточности, десинхронизации искусственной и спонтанной вентиляции легких и др. Во-вторых, ИВЛ проводится с целью обеспечить возможность искусственной миоплегии для операций на органах живота, репозиций костей и вправления вывихов, интенсивной терапии, судорожных синдромов и др.
Говоря о клинической физиологии искусственной миоплегии, целесообразно рассмотреть три группы проблем: мионевральный синапс и миорелаксанты, миорелаксанты и мышечная система, миорелаксанты и жизненно важные функции организма.
Мионевральный синапс и миорелаксанты
В этом разделе обсуждены следующие вопросы: физиология мионеврального синапса, мионевральный блок и классификация миорелаксантов, функциональный контроль миорелаксации.
Физиология мионеврального синапса. Скелетные мышцы по характеру управления относятся к холинореактивным системам, весьма неоднородным как в структурном, так и в функциональном отношении. Различают холинореактивные системы ЦНС, ганглиев симпатической и парасимпатической нервной системы, постганглионарных волокон и, наконец, холинореактивные системы поперечнополосатых мышц. Объединяет эти системы медиатор — ацетилхолин — и общая схема строения синапса, хотя для каждой системы имеются свои структурные и функциональные особенности. Об этом нам придется вспомнить, когда мы будем говорить о побочных (и притом весьма опасных) функциональных эффектах миорелаксантов.
Синапс, являющийся границей между функционально контактирующими друг с другом нейронами, можно представить себе в виде узкого пространства (синаптическая щель), ограниченного с одной стороны пресинаптической, с другой— постсинаптической мембранами. Пресинаптическая мембрана состоит из внутреннего слоя, принадлежащего цитоплазме нервного окончания, и наружного слоя, образованного нейроглией. Мембрана в некоторых местах утолщена и уплотнена, в некоторых — истончена и имеет отверстия, через которые аксоплазма сообщается с синаптическим пространством. Постсинаптическая мембрана менее плотна, не имеет перерывов, отверстий.
В соответствии с классическими представлениями, существовавшими до последних лет, активный ацетилхолин, освобождающийся при стимуляции нерва, реагируя с холинорецептором постсинаптической мембраны, повышает ее проницаемость: она становится проницаемой не только для ионов калия, но и для натрия, начинается деполяризация мембраны. В результате обмена ионами между клеткой и внеклеточным пространством происходит резкое снижение мембранного потенциала мышечной клетки, который в покое равен —90 мВ. Падение его ниже порога (—70 мВ) возбуждает электрически чувствителъную мембрану, появляется потенциал действия, который заставляет сократиться мышечное волокно. Параллельно с возбуждением электрически чувствительной мембраны протекает и другой процесс — аккомодации ее: порог возбудимости мембраны возрастает. После того как порог превзойдет мембранный клеточный потенциал, мембрана становится невозбудимой, рефрактерной. Если мембранный клеточный потенциал снижается слишком медленно, то процесс аккомодации опережает его, порог возбудимости электрически чувствительной мембраны возрастает и потенциал действия не появится — мышечное волокно не сократится. Действие ацетилхолина весьма кратковременно: он разрушается холинэстеразой, после чего происходит процесс реполяризации мембраны.
В соответствии с этими классическими взглядами предполагалось, что тубокурарин и другие миорелаксанты, вызывая блокаду синапса, действуют только на постсинаптическую мембрану. Однако в 70-х годах было обнаружено, что и ацетилхолин, и миорелаксанты действуют не только на постсинаптическую, но и на пресинаптическую мембрану, причем последняя имеет холинорецепторы двух типов: одни (расположенные в мембране) облегчают освобождение новых порций ацетилхолина, другие (расположенные у первого узла Ранвье) участвуют в деполяризации аксона и, возможно, являются точкой приложения действия холинэстеразы.
Появились убедительные данные [Standaert F. G. et al., 1981] о роли циклических нуклеидов в нейромускулярной проводимости. Уже не вызывает сомнений, что освобождение ацетилхолинхлорида связано со смещением иона кальция. Нервный импульс активирует аденилциклазу нервного окончания, в котором АТФ превращается в цАМФ; последний воздействует на протеинкиназу, открывающую канал для Са2+. Поскольку цАМФ активируется аденилциклазой, а разрушается дифосфоэстеразой и в настоящее время имеются средства для стимуляции и торможения обоих ферментов, это позволяет поновому подойти к оценке нейромускулярной проводимости с точки зрения клиники и физиологии.
Мионевральный блок и классификация миорелаксантов. Новые представления о функции мионеврального синапса не могли не сказаться на клинико-физиологических представлениях об эффекте миорелаксантов.
Тридцать лет назад миорелаксанты по предполагавшемуся тогда характеру вызываемого ими блока разделяли на деполяризующие и недеполяризующие. Полагали, что деполяризующие миорелаксанты (типичный представитель—сукцинилхолин), подобно ацетилхолину, вызывают деполяризацию постсинаптической мембраны с падением мембранного клеточного потенциала. Однако в отличие от ацетилхолина релаксанты разрушаются очень медленно, деполяризованная мембрана аккомодирует— порог возбудимости чувствительной мембраны повышается. При нервном импульсе выделяющийся ацетилхолин может усилить деполяризацию мембраны, но порог возбудимости достигнут не будет, мышца не сократится.
Второй вид блока именовали антидеполяризующим и полагали, что вызывающие его релаксанты (типичный представитель—тубокурарин) препятствуют деполяризации: они реагируют с холинорецептором постсинаптической мембраны, но не вызывают изменения проницаемости мембраны. Если в этих условиях в мембрану поступает нервный импульс, то освободившийся ацетилхолин находит значительную часть рецепторов занятой молекулами тубокурарина. Если и происходит деполяризация мембраны, то явно недостаточная для появления потенциалов действия.
Этот характер блока, а соответственно и всю группу антидеполяризующих релаксантов характеризовали следующие электромиографические признаки: I) медленное развитие нервно-мышечного блока без фибрилляций; 2) снижение механического и электромиографического ответа мышцы на частую стимуляцию — явление «пессимума» или «увядания»; 3) «посттетаническое облегчение»— увеличение амплитуды одиночного биопотенциала после пятисекундной стимуляции нерва током тетанизирующей частоты (около 50 Гц); 4) «облегчение после покоя» — увеличение одиночного мышечного потенциала действия после пятисекундного перерыва частой стимуляции; 5) улучшение нервно-мышечной проводимости после введения антихолинэстеразных веществ.
Вторую группу релаксантов (деполяризующие) и вызываемый ими блок характеризовали, соответственно, противоположные признаки.
С самого начала высказывались сомнения в правильности этой классификации. Выяснилось, например, что после применения повторных доз деполяризующих релаксантов возникает типичный недеполяризующий блок. Это явление было названо «двойным блоком», «инверсией блока», «II фазой блока», «десенситизацией» и пр.
Электромиографическое исследование искусственной миоплегии показало несостоятельность существующего деления миорелаксантов начиная с такого классического признака, как посттетаническое облегчение. Ведь интактная тоническая мышца отвечает увеличением одиночного потенциала после тетанизации так же, как после воздействия релаксантов, а падение мышечного ответа на частую стимуляцию (явление «пессимума») не зависит от типа релаксанта, да и вообще, видимо, не связано с характером блока. Главное же заключается в том, что распространенные в анестезиологической практике методы электромиографии вообще не пригодны для детальной характеристики блока, а свидетельствуют лишь о его наличии и динамическом изменении.
Более тонкие электромиографические исследования, в том числе с применением микроэлектродной техники, показали, что любой тип блока связан не с деполяризацией мембраны, а со снижением чувствительности ее к ацетилхолину (десенситизацией) из-за блокады холинорецепторов релаксантом. Видимо, самым правильным названием такого блока является термин «десенситизирующий блок».
Однако деполяризация постсинаптической мембраны все же существует, хотя и не она определяет характер блока. Ее клинические и электромиографические признаки, например фибрилляция мышц, очевидны, в связи с чем предлагают называть такой блок двухфазным в отличие от первично возникающего паралича, называемого однофазным блоком. Однофазный блок обусловливают миорелаксанты типа тубокурарина, двухфазный— типа сукцинилхолина.
Таким образом, клинико-физиологический подход к применению миорелаксантов должен заключаться не в изучении биофизических тонкостей вызываемого ими блока, а в оценке скорости наступления и продолжительности блока, влияния миорелаксантов на мышечные группы организма и его жизненные функции. Такая оценка целесообразна после рассмотрения проблемы функционального контроля эффекта миорелаксантов.
Функциональный контроль миорелаксации. Функциональный контроль искусственной миоплегии требуется в большинстве случаев при решении вопроса о том, способны ли мышцы больного обеспечить спонтанную вентиляцию легких. С этой целью используют механомиографию, когда степень сокращения возбуждаемой мышцы (обычно пальцев кисти) определяют с учетом давления в сжимаемом мышцей резиновом баллоне, шприце, при помощи пружинного, пьезоэлектрического или плетизмографического преобразователя, и электромиографию — регистрацию вызванных потенциалов мышцы.
Из отечественных исследователей приоритет в применение электромиографии в анестезиологии принадлежит В. А. Кованеву и Я. М. Хмелевскому (1962), а наиболее подробно эта проблема рассмотрена в работе Ф. Ф. Белоярцева (1980). В серии работ М. Г. Фулиди (1965—1969) впервые говорится о непрерывном объективном контроле действия миорелаксантов в анестезиологической практике с помощью метода миорелаксографии [Зильбер А. П., Фулиди М. Г., 1966].
Суть метода миорелаксографии состоит в том, что наведенная ЭМГ регистрируется непрерывно в течение всей анестезии, и запись суммарного биопотенциала, получаемого специальным преобразователем, проводится по одну сторону от нулевой линии. Исследование выполняется при низкой частоте стимуляции (0,1—0,25 Гц) и медленной скорости протяжки регистрационной ленты — 1 см/мин. Амплитуда наведенного биопотенциала зависит от нервно-мышечной проводимости и объективно ее отражает. Скорость протяжки регистрационной ленты низкая, и регистрируемые биопотенциалы близко прилегают друг к другу. Кривая, соединяющая вершины биопотенциалов (миорелаксограмма), отражает изменения нервно-мышечной проводимости в течение всей анестезии (рис. 27).
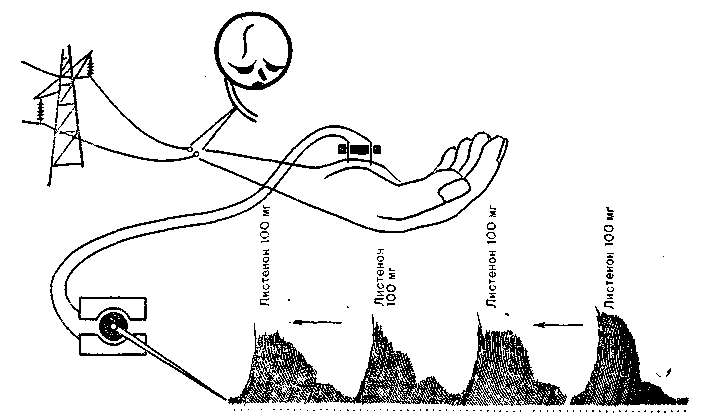
Рис. 27. Принцип миорелаксографии при контроле искусственной миоплегии.
В зарубежной анестезиологии широкое распространение в динамической оценке степени нейромускулярного блока имеет метод, предложенный Н. Н. Аli и соавт. (1970) и называемый «ряд из четырех» («train-of-four»). Суть его заключается в том, что на локтевой нерв подаются 4 супрамаксимальных стимула при частоте 2 Гц с повторением ряда через 10 с. Регистрируется ЭМГ с приводящих мышц I пальца или механограмма, полученная через специальный преобразователь. По соотношению амплитуд IV и I стимулов судят о степени блока. Методика удобна прежде всего тем, что позволяет стандартизировать и сравнивать результаты исследования, проведенного разными авторами у различных больных. Кроме того, она не требует тетанизации нерва, которая сама по себе нарушает локальную мионевральную проводимость.
