
- •Введение
- •Часть I клиническая физиология главных синдромов критических состояний
- •Глава 1
- •Физиологические эффекты гиповолемии
- •Функциональные критерии
- •Глава 2 острая дыхательная недостаточность
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Свертывание крови и фибринолиз
- •Первичная адгезия и агрегация
- •Реакция освобождения и вторичная агрегация
- •Принципы интенсивной терапии
- •Глава 4 гепаторенальный синдром
- •Физиологические механизмы
- •Функциональные критерии
- •Принципы интенсивной терапии
- •Глава 5 острая церебральная недостаточность
- •Физиологические механизмы
- •Функциональные критерии
- •Прогноз неврологического статуса
- •Принципы интенсивной терапии
- •Глава 6 болевой синдром
- •Физиологические механизмы
- •Принципы интенсивной терапии
- •Глава 7 операционный стресс
- •Функциональные критерии
- •Принципы физиологической защиты
- •Глава 8 нарушение метаболизма
- •Пути управления метаболизмом
- •Нарушение осмол яркости и водно-электролитного баланса
- •Часть II клиническая физиология методов интенсивной терапии, анестезии и реанимации
- •Реанимация при остановке сердца и дыхания
- •Г л а в а 11 инфузионная и трансфузионная терапия
- •Инфузия медикаментов
- •Парентеральное питание
- •Методы инфузионной терапии
- •Глава 12 вспомогательное кровообращение
- •Метод контрпульсации
- •Шунтирование желудочков
- •Функциональные эффекты
- •Глава 13 респираторная терапия
- •Оптимизация естественных механизмов дренирования мокроты
- •Глава 14 антигипоксическая терапия (ингаляционная, трансфузионная и медикаментозная)
- •Ингаляционная оксигенотерапия
- •Гипербарическая оксигенация
- •Энтеральная оксигенация
- •Трансфузионая оксигенация
- •Искусственная вентиляция легких
- •Клинико-физиологические аспекты процедуры искусственной вентиляции легких
- •Объективные критерии
- •Глава 16 искусственная миоплегия
- •Миорелаксанты и мышечная система
- •Глава 17 детоксикационная терапия
- •Стимуляция естественной детоксикации
- •Искусственная детоксикация
- •Синдроматическая терапия
- •Глава 18 мониторизация
- •Принципы мониторизации
- •Методы и цели
- •Параметры мониторизации
- •Часть III клинико-физиологический анализ итар в повседневной практике
- •Глава 19 акушерство
- •Амниотическая эмболия
- •Эклампсия
- •Глава 20 неонатология и педиатрия
- •Реанимация новорожденных
- •Бронхиолит
- •Синдром внезапной смерти младенца
- •Глава 21 пульмонология Влияние анестезиологического пособия на дыхание
- •Тромбоэмболия легочной артерии
- •Бронхоастматический статус
- •Отек легких
- •Синдром шокового легкого
- •Глава 22 кардиология
- •Внезапная кардиальная смерть
- •Кардиогенный шок
- •Глава 23 гепатология
- •Острая печеночная недостаточность
- •Нефрология Влияние анестезии на функции почек
- •Острая почечная недостаточность
- •Глава 25 гематология
- •Геморрагический шок
- •Глава 26 неврология и нейрохирургия
- •Эпилептический статус
- •Столбняк
- •Поражение головного мозга
- •Поражение спинного мозга
- •Глава 27 гастроэнтерология
- •Острейший гастроэнтерит
- •Травматология
- •Травматический шок
- •Синдром жировой эмболии
- •Газовая эмболия
- •Глава 29 иммунологические аспекты практики итар
- •Аллергия в практике итар
- •Анафилактический шок
- •Септический шоковый синдром
- •Список литературы
- •Оглавление
- •Часть I. Клиническая физиология главных синдромов критических состояний ..........……………………………………….. 12
- •Глава 1. Нарушение реологии крови и острая гиповолемия .…………….. 12
- •Глава 2. Острая дыхательная недостаточность ...…………………………... 30
- •Глава 11. Инфузионная и трансфузионная терапия ....……………………… 141
- •Глава 21. Пульмонология ...........………………………………………………….. 250
- •Глава 28. Травматология . . . .......………………………………………………….. 341
- •Глава 29. Иммунологические аспекты практики итар ..…………………….. 351
Глава 7 операционный стресс
Рассуждая об операционном стрессе в разделе, посвященном клинической физиологии синдромов критических состояний, следует подчеркнуть, что операционный стресс — это не единый синдром, а совокупность синдромов, вызываемых оперативным вмешательством.
При клинико-физиологической оценке операционного стресса мы сталкиваемся с интересным противоречием. Для защиты организма от стрессовых факторов операции используется современное анестезиологическое пособие, различные компоненты которого сами по себе являются стрессорами. Анестезиологический стресс по масштабам несоизмерим с операционным, а что касается задач, механизмов и методов, то он предотвращает жизненно опасные физиологические последствия операционного стресса. Однако не следует обольщаться безвредностью анестезиологического стресса: просто, как сказано в традиционной юридической формуле, причиненный анестезиологическим пособием вред является менее значительным, чем предотвращенный.
Проблему операционного стресса мы рассмотрим в такой последовательности: агрессивные факторы оперативного вмешательства, физиологические механизмы операционного стресса, клинические синдромы, принципы физиологической защиты оперируемого больного.
Агрессивные факторы оперативного вмешательства
Известно пять главных агрессивных факторов операционного стресса: психоэмоциональное возбуждение, боль, патологические рефлексы неболевого характера, кровопотеря, повреждение жизненно важных органов. Каждый из них проявляется различно в зависимости от трех обстоятельств: общего состояния больного (включая предшествующую патологию), продолжительности и травматичности оперативного вмешательства и адекватности анестезиологической защиты.
Психоэмоциональное возбуждение — важнейший и далеко не адекватно учитываемый хирургами и анестезиологами агрессивный фактор оперативного вмешательства. Нерациональное отношение к этому фактору особенно обидно потому, что он, во-первых, действует всегда, во-вторых, сравнительно легко устраним и, в-третьих, им можно заниматься, как правило, в спокойной обстановке до плановой операции.
Внешне безмятежное поведение больных перед операцией отнюдь не означает отсутствие психоэмоционального стресса. Иногда такое поведение, наоборот, сопровождается более выраженной, но умело скрываемой катехоламинемией, отчего ее следствия не становятся менее опасными. Всякий нормальный человек опасается предстоящей операции, и избыточный выброс гормонов агрессии — катехоламинов — при этом неизбежен. Предоперационные эмоциональные реакции способствуют увеличению выброса гормонов мозгового вещества и коры надпочечников в 2—4 раза. Выраженным стимулятором адренокортикальной активности является бессонница.
Боль до и во время операции действует точно так же, стимулируя катехоламинемию. Неболевые патологические рефлексы при рассечении тканей, тракции органов также могут увеличить выброс катехоламинов, но могут воздействовать и через холинергическую систему, усиливая опасные последствия катехоламинемии нарушением ритма и силы сердечных сокращений, бронхиолоспазмом и т. п.
Операционная кровопотеря уменьшает ОЦК, над сокращением которого уже поработала катехоламинемия, а повреждение некоторых органов — мозга, сердца и крупных сосудов, легких, печени, почек (в том числе ишемическое повреждение) — усиливает начальные механизмы операционного стресса или мешает организму и анестезиологу адекватно с ними бороться.
Разумеется, вклад, вносимый каждым из пяти рассмотренных факторов в общую клинико-физиологическую картину операционного стресса, различён у разных больннх, зависит от действий хирурга и анестезиолога. Срочно или планово оперируется больной, корригированы ли его дыхание, кровообращение, метаболизм? Каков характер выполняемой операции и оперирует ли хирург травматично, но зато быстро, или медленно, но осторожно, а может быть, медленно и травматично? Каковы мануальные способности и реактивность анестезиолога, достаточно ли широк арсенал методов и средств управления функциями больного и, главное, как он анализирует ситуацию с позиций клиники и физиологии? От всех этих факторов, которые подчас трудно объективно оценить, в конечном счете зависит окончательный итог операционного стресса. Далеко не всегда этот результат проявляется во время операции, гораздо чаще—в послеоперационном периоде, а иногда и позже.
Физиологические механизмы операционного стресса
В физиологических механизмах операционного стресса надо различать три уровня реакций: 1) первичное состояние тревоги, возбуждения, предназначенное для усиления деятельности жизненно важных органов за счет менее важных органов и тканей; 2) нарушение жизнедеятельности второстепенных органов и тканей из-за слишком длительного голодного режима; 3) поражение жизненно важных органов в связи с расстройствами, которые второстепенные органы и ткани вызвали в организме.
Первичная реакция. Начинается с возбуждения ретикулярной формации, гипоталамо-гипофизарной системы, а затем захватывает симпатико-адреналовую систему. С этого момента в клинико-физиологических проявлениях реакции начинают преобладать механизмы, связанные с деятельностью надпочечников (рис. 18).
Основу этой деятельности составляет массивный выброс катехоламинов («гормонов агрессии») — многообразный механизм защиты, действующий кратковременно в связи с быстрым разрушением катехоламинов. Около 90% катехоламинов в течение нескольких минут адсорбируется мембранами клеток, и гидролиз их протекает под действием моноаминооксидазы. Основные катехоламины — адреналин, норадреналин и допамин, соотношение которых бывает различным как в естественном состоянии, так и в условиях оперативного вмешательства. При состоянии агрессии адреналин составляет около 80% поступающих из надпочечников катехоламинов.
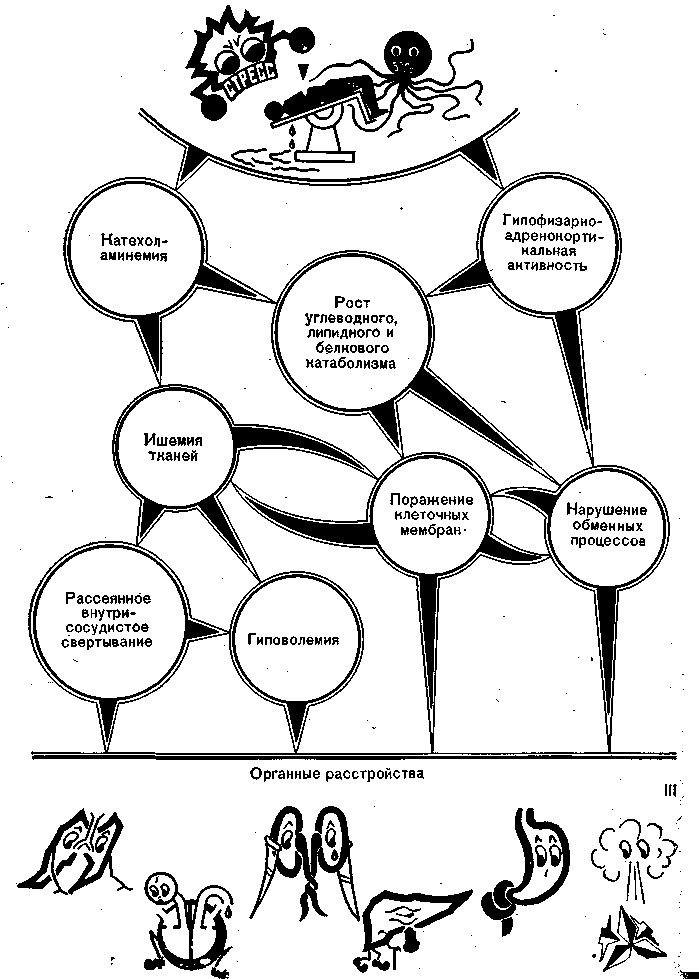
Рис. 18. Три уровня физиологических реакций операционного стресса: реакция тревоги и мобилизация защитных сил (I), поражение клеток и тканей (II), органные расстройства (III)—острая дыхательная, сердечная, почечная, печеночная недостаточность, поражения желудочно-кишечного трактуя иммуносептические расстройства (слева направо).
Биосинтез катехоламинов осуществляется таким путем: тирозин→ДОФА (дигидрооксифенилаланин)→допамин→норадреналин→адреналин.
Для того чтобы наступил выброс катехоламинов из надпочечника, совсем не обязателен нервный импульс, идущий из сетчатого образования. Аналогичная непосредственная реакция надпочечников (что особенно важно для анестезиолога) возникает под действием поступающих из пораженных тканей активных полипептидов — серотонина, гистамина и др. Эта реакция проявляется воздействием как непосредственно на надпочечники, так и опосредованно через таламус. В условиях операционной агрессии уровень катехоламинов может увеличиваться в 100 раз и более, возрастая в особо травматичные моменты операции.
Влияние катехоламинов осуществляется через α- и β-адренорецепторы, в разных соотношениях находящиеся в различных органах. Действуя через эти рецепторы на органы, катехоламины могут давать как возбуждающий, так и тормозящий эффект.
Через симпатико-адреналовую систему стимулируются дыхание, гемодинамика, все виды метаболизма, т. е. хирургическая агрессия обусловливает напряженный режим работы большинства систем организма. Однако эти режимы связаны не с более экономной работой систем, а, наоборот, с неоправданно щедрым самосжиганием органов и истощением их резервов.
Не следует думать, что в первичных реакциях операционного стресса участвует только симпатико-адреналовая система. Холинергическая система также вносит свой вклад в общее стрессовое состояние. Во-первых, во время операции ряд патологических рефлексов на дыхание и кровообращение замыкается через холинергическую систему (ваго-вагальные и другие рефлексы). Во-вторых, ацетилхолин способен стимулировать выделение адреналина из мозгового вещества надпочечника, который в эмбриологическом аспекте является симпатическим ганглием, а все ганглии по медиаторному управлению относятся к холинореактивным системам.
Вероятно, действие катехоламинов на миокард, сосуды и различные виды метаболизма опосредуется через систему аденилциклаза — цАМФ, которая изменяет проницаемость мембран и функции актомиоаина в гладких мышцах прекапиллярных сфинктеров. Отчетливая связь между уровнями катехоламинов и цАМФ в условиях операционного стресса у больных показана A. Engquist и соавт. (1980).
Но участие симпатико-адреналовой системы в хирургической агрессии не ограничивается катехоламинемией. В реакцию вовлекаются гипофиз (выброс АКТГ, АД Г и других тропных гормонов), щитовидная и поджелудочная железы, гормональная активность которых, как и коры надпочечников, повышается. Участие в общей реакции на операционную травму коры надпочечников имеет особое значение для анестезиологов.
Увеличивается выброс обеих групп гормонов коры: глюкокортикоидных (содержащих гидроксильную группу в положении 17- так называемых 17-гидрокортикостероидов) и минералокортикоидных (не содержащих ОН в положении 17, т. е. 17-дезоксикортикостероидов).
Эффект этих гормонов различен. Глюкокортикоиды (основной представитель—гидрокортизон) действуют главным образом на метаболизм, воспалительную реакцию, лимфоидную ткань. Минералокортикоиды (основной представитель—альдостерон) влияют в основном на водно-электролитное равновесие, нарушая реабсорбцию электролитов в почке.
Обобщить физиологические эффекты гормонов коры надпочечника в условиях оперативного вмешательства можно следующим образом.
Глюкокортикоиды: а) углеводный обмен: возникает гипергликемия из-за глюконеогенеза и торможения окисления глюкозы в тканях; отложение гликогена в печени усиливается; растут лактаты и пируваты; б) белковый обмен: возрастает катаболизм белков и дезаминирование аминокислот; в) система кровообращения: повышается реакция сосудов на катехоламины; г) система крови: лимфопения в связи с инволюцией лимфоидной ткани, эозинопения из-за секвестрации эозинофилов в легких и селезенке, стимуляция эритропоэза и тромбоцитопоэза; д) пищеварительная система: стимуляция секреции желудочного сока и наклонности слизистой к самоперевариванию (стрессовые эрозии и язвы); е) прочее: противовоспалительное и антиаллергическое действие, торможение гипофиза (АКТГ) и поджелудочной железы (инсулина).
Минер ал окортикоиды: а) система мочеобразования: увеличение рёабсорбции натрия и воды с повышенной экскрецией калия; б) прочее: противовоспалительное действие.
Как видно из обобщения, гормоны коры надпочечника в значительной степени действуют синергично с катехоламинами. Можно сказать, что симпатико-адреналовая система является стартером, запускающим в организме высокий уровень жизнедеятельности, а гипофизарно-адренокортикальная система стабилизирует этот уровень, время от времени подстегивая симпатико-адреналовую, если функции ее начинают нормализоваться. Не с этим ли связана специфика кровоснабжения надпочечника (кровь поступает в мозговое вещество надпочечника через многочисленные капилляры из коркового вещества)? Предполагают, что гидрокортизон играет важную роль в преобразовании норадреналина в адреналин. Это подтверждается также несомненным синергизмом гидрокортизона и адреналина в периферических тканях.
Особого внимания заслуживает то обстоятельство, что не менее половины находящихся в крови гормонов коры надпочечника связано с белками плазмы, т. е. существует в неактивной форме, превращаясь при необходимости в активную. Следовательно, предшествующая гипопротеинемия увеличивает циркуляцию активных гормонов и стрессовая реакция у таких больных более выражена.
Весь этот сложный комплекс нейроэндокринной регуляции необходим организму главным образом для того, чтобы повысить производство энергии и увеличить кровоснабжение мозга и сердца в условиях агрессии, которую предстоит выдержать. Эти цели достигаются следующими путями.
Главное энергетическое сырье организма — глюкоза и ненасыщенные жирные кислоты. Адреналин стимулирует распад гликогена в печени и мобилизацию жирных кислот из липидов, повышая роль I—II и III пути биологического окисления (см. главу 8). Установлено, что в условиях операционной агрессии в крови резко возрастает уровень глюкозы и свободных жирных кислот, которые хранились главным образом в триглицеридах — основных депо свободных жирных кислот. Триглицериды находятся в организме преимущественно в виде липопротеидов низкой плотности (β-липопротеидов), в больших количествах поступающих в кровь при стрессовом состоянии.
Еще совсем недавно основное значение в росте энергетического метаболизма при стрессе придавали системе гликоген — глюкоза, а на липидный метаболизм не обращали внимания. Однако метаболизм жирных кислот покрывает около половины энергетических трат при стрессе, и, как мы увидим дальше, вовлечение фосфолипидов в стрессовую реакцию не проходит для организма бесследно.
Осуществление второй цели стрессовой нейрогуморальной регуляции — увеличение кровоснабжения мозга и миокарда — происходит за счет двух типов реакций: усиления и учащения сердечных сокращений под действием катехоламинов и спазма артериол всех прочих органов и тканей. Этот спазм создает полуголодный режим для второстепенных структур, но мозг и миокард кровоснабжаются в избытке, поскольку их артериолы катехоламины не сокращают.
Любое стрессовое состояние, в том числе операционное, в конце концов нарушает всю систему регуляции, если в ходе его развития не была предпринята коррекция.
Вторичные изменения в тканях. Под влиянием катехоламинов блокируется капиллярный кровоток, а кровоток через артериовенозные анастомозы возрастает. Благодаря этому периферическое сопротивление повышается не слишком резко и в первое время венозный возврат оказывается достаточным. Однако вскоре развиваются реологические расстройства, связанные с замедлением кровотока через капиллярные системы, вследствие чего возникают: секвестрация крови и гиповолемия, рассеянное внутрисосудистое свертывание крови, ишемия различных органов и тканей с нарушением их функций, поражение метаболизма.
Поражение метаболизма касается прежде всего реакций биологического окисления, которые первыми включаются в стрессовое состояние, чтобы увеличить продукцию энергии. Пока кислорода достаточно, образование энергии происходит по первому — второму пути (Эмбдена — Мейергофа — Кребса) с продукцией 38 молекул АТФ из 1 молекулы глюкозы. При наступлении ишемии тканей развивается синдром шокового легкого и кислорода начинает не хватать. Образование энергии прекращается на рубеже, с которого начинается аэробный цикл Кребса (лактат — пируват). Появляется гипоксиче-ский избыток лактата, возникает метаболический ацидоз, а главное, на этом уровне выработки энергии образуется лишь 2, а не 38 молекул АТФ. Избыток лактата может в какой-то мере служить критерием тяжести стресса, разумеется не абсолютным.
Избыток Н+ ведет к удалению из клетки К+, который на 1/3 замещается Na+, а на 2/3 — Н+. Избыток внеклеточного К+ удаляется почками. Чем более выражен операционный стресс и чем менее совершенна анестезиологическая защита, тем больше К+ удаляется из клетки и выводится из организма.
Состояние электролитного баланса существенно зависит от уровня АДГ и альдостерона, которые включаются в ответ на первичную гиповолемию, чем бы она ни была вызвана — операционной кровопотерей или секвестрацией крови в капиллярных системах. Диурез сокращается, усиливается гипергидратация, выводится К+, накапливается Na+.
Поскольку в ходе стрессовой реакции катехоламины резко усиливают метаболизм липидов (для производства энергии из ненасыщенных жирных кислот), изменяются свойства клеточных мембран, основу которых составляют фосфолипиды. Происходит гидролиз мембранных фосфолипидов с помощью фосфолипазы, в связи с чем мембранные структуры поражаются при любом стрессовом состоянии. Кроме того, нарушается обмен холестерина, который участвует в поддержании целости, проницаемости и функциональной активности мембран. Благодаря этому нарушается ультрамикроструктура органов и снижаются их функциональные возможности.
При этом особенно страдают легкие. Поражение фосфолипидов при стрессе сказывается не только на клеточных мембранах альвеоцитов, но и на состоянии сурфактанта, основу которого составляет дипальмитоловый лецитин, являющийся фосфолипопротеидом.
Функциональные следствия. Весь этот далеко не полный комплекс стрессовых расстройств ведет к поражению жизненно важных функций организма.
Гиповолемия вызывает ишемию всех органов с генерализованными расстройствами микроциркуляции и метаболизма — гипокалиемией, метаболическим ацидозом, осмолярными расстройствами и др. (см. главу 1). О расстройствах микроциркуляторного кровотока при стрессе свидетельствует увеличение в 2—3 раза лимфотока по грудному лимфатическому протоку — главному коллектору лимфы.
Синдром шокового легкого ведет к дыхательной недостаточности, резистентной к обычным режимам кислородной терапии (см. главу 21). В послеоперационном периоде он нередко проходит под маской вульгарной пневмонии. Развивается почечная недостаточность с задержкой воды, шлаков, нарушением ренин-ангиотензивной регуляции гемодинамики (см. главу 24).
Возникает печеночная недостаточность с гипоальбуминемией, снижением деструкции лактатов и другими метаболическими расстройствами (см. главу 23).
В связи со снижением продукции в печени иммуноглобулинов, а также из-за стрессового поражения гранулоцитов, лимфоцитов, нарушения фагоцитоза меняется иммунореактивность. Это может проявиться септическими расстройствами, плохим заживлением и очищением ран и т. д. (см. главу 29).
Нарушение свертывающих свойств крови и синдром рассеянного внутрисосудистого свертывания (см. главу 3) в послеоперационном периоде могут привести к тромбоэмболическим осложнениям или кровотечениям, особенно в тех случаях, когда к расстройствам свертывания присоединяются стрессовые эрозии и язвы пищеварительного тракта (см. главу 27).
Возможно развитие стрессовой паралитической непроходимости, которая ухудшает условия вентиляции легких и ведет к выраженным расстройствам метаболизма (см. главу 27).
В последнюю очередь развивается миокардиальная недостаточность (если не было предшествующего поражения миокарда), которая связана главным образом с генерализованными нарушениями метаболизма.
