
- •1.Определение бас
- •2.Цели выделения бас
- •3.Первичная обработка биологического сырья.
- •3.1.Сырье для выделения бас
- •3.2.Обобщенная схема выделения бас
- •3.3.Сепарация.
- •3.4.Консервация.
- •Микроорганизмы
- •3.4.1.Охлаждение.
- •3.4.2.Консерванты
- •3.4.3.Уменьшение содержания воды
- •3.4.4.Герметизация
- •3.5.Измельчение и гомогенизация
- •3.5.1.Физические методы
- •3.5.2.Физико-химические методы
- •3.5.3.Химические методы
- •4.Экстракция
- •4.1.Классическая экстракция.
- •4.2.Сверхкритическая экстракция (sfe)
- •4.3.Твердофазная экстракция
- •5.Центрифугирование
- •5.1.Общие принципы центрифугирования
- •5.2.Дифференциальное центрифугирование
- •5.3.Зонально-скоростное центрифугирование
- •5.4.Изопикническое центрифугирование
- •5.5.Препаративные центрифуги
- •5.6.Конструкция роторов
- •5.7.Аналитические ультрацентрифуги
- •5.8.Определение молекулярных весов
- •5.8.1.Метод скорости седиментации
- •5.8.2.Метод седиментационного равновесия
- •5.8.3.Метод приближения к седиментационному равновесию
- •5.9.Исследование конформационных изменений в макромолекулах
- •5.10.Методы создания градиентов для центрифугирования
- •5.11.Извлечение продуктов из центрифужных пробирок
- •6.Мембранные технологии
- •6.1.Диализ
- •6.2.Электродиализ
- •6.3.Ультрафильтрация
- •6.4.Материалы мембран
- •6.5.Другие виды фильтрации
- •7.Буферные растворы.
- •8.Хроматография
- •8.1.Классификация хроматографических методов
- •8.1.1.Классификация по агрегатному состоянию фаз
- •8.1.2.Классификация по технике исполнения
- •8.1.3.Классификация по принципам разделения
- •8.2.Основы теории хроматографии
- •8.2.1.Общие понятия и принципы
- •8.2.2.Параметры хроматографического разделения
- •8.3.Адсорбционная хроматография
- •8.4.Распределительная хроматография
- •8.5.Эксклюзионная хроматография
- •8.6.Ионообменная хроматография
- •8.7.Аффинная хроматография
- •8.8.Обращенно-фазовая хроматография
6.5.Другие виды фильтрации
При выделении БАС наиболее широко используется именно ультрафильтрация, однако стоит упомянуть и другие примеры мембранных технологий (рис.22).

Рисунок 21. Распределение мембранных методов по размерам пор.
Микрофильтрация в диапазоне сотен микрометров может применятся для холодной стерилизации лекарственных препаратов и пищевых продуктов. Нанофильтрация и, особенно, обратный осмос применяется как одна из стадий для тонкой очистки воды.
7.Буферные растворы.
Буферный раствор – раствор с определенным значением pH, способный сохранять его при добавлении к нему кислот или щелочей, а также при разбавлении.
Величина буферного действия характеризуются буферной емкостью β, равной количеству сильного основания, которое необходимо добавить к одному литру буфера для изменения рН раствора на одну единицу (рис. 22).

Рисунок 21. Выражение в дифференциальной форме для расчета буферной емкости. db – количество добавленной кислоты или основания в молях, d(pH) – изменение водородного показателя
Первый тип буферных растворов – это смесь слабой кислоты и ее соли или слабого основания и его соли. При добавлении к раствору слабой кислоты (НА) и ее соли (А-) ионов водорода последние нейтрализуются анионами соли, которые действуют в данном случае как слабое основание; гидроксильные ионы, наоборот, нейтрализуются кислотой. При логарифмировании уравнения для константы диссоциации слабой кислоты получается уравнение Гендерсона-Хассельбаха, с помощью которого можно рассчитать pH такого буферного раствора.

Рисунок 22. Вывод уравнения Гендерсона-Хассельбаха исходя из уравнения для константы диссоциации слабой кислоты.
Изучение этого уравнения, для примера ацетатного буферного раствора (рис. 23), оказывает, что буферная емкость максимальна в том случае, когда концентрации соли (сопряженного основания) равна концентрации кислоты. При этом pH буферного раствора становится равным pKa кислоты. Хорошая буферная емкость соответствует pKa ± 0.5 ед. pH, а достаточная pKa ± 1 ед. pH. Из этого следует, что нельзя использовать ацетатный буферный раствор за границами 4.76 ± 1 pH.
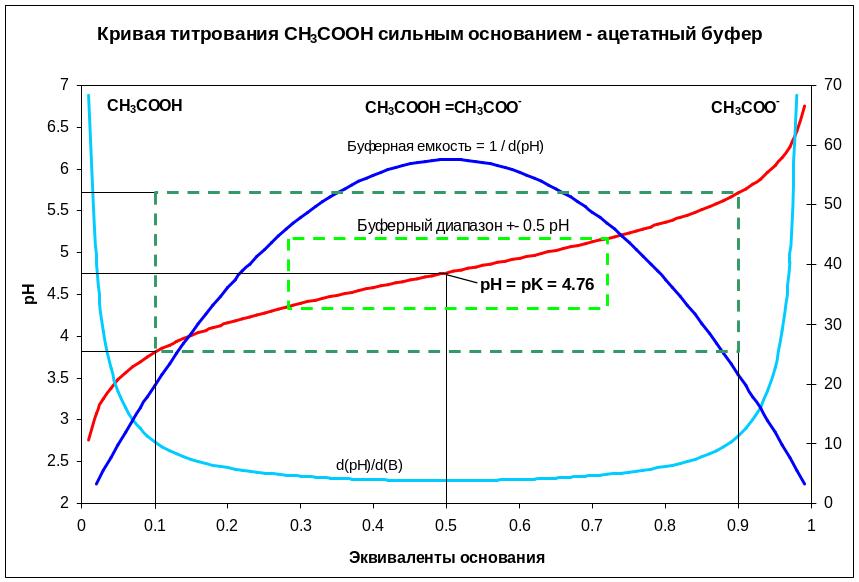
Рисунок 23. Рассчитанные графики зависимости pH и буферной емкости для ацетатного буферного раствора.
Буферная емкость зависит также от общей концентрации раствора: чем выше концентрация раствора, тем больше его буферная емкость. Концентрация веществ в буферных растворах обычно бывает порядка 0,05—0,20 М.
К буферным растворам первого типа относятся ацетатный, формиатный, цитратный, боратный, ТРИС , аммиачный и другие.
Второй тип буферных растворов – это растворы двух солей, кислой и основной, например фосфатный буферный раствор (рис. 24).

Рисунок 24. Принцип действия фосфатного буферного раствора.
Третий тип буферных растворов - раствор амфотерного вещества (например белка). Белки являются наиболее важной группой физиологических буферов. Благодаря большому количеству содержащихся в боковых цепях аминокислот щелочных и слабокислых групп белки имеют очень высокую буферную емкость. Буферная емкость крови в основном определяется гемоглобином.
