
- •Оглавление
- •Основная литература
- •Дополнительная литература
- •Тематический план лекций для до
- •Тематический план лекций для озо
- •План лабораторных занятий для озо
- •Возможные темы рефератов
- •Занятие 1. Организация работ в лаборатории
- •Правила выживания в лаборатории
- •1.2. Дополнительная литература
- •1.4. Вопросы для самоконтроля
- •1.5. Задание на дом
- •Занятие 2. Вода, ее свойства и методы измерений рН
- •2.1. Физико-химические свойства и роль воды в биосфере
- •2.2. Дополнительная литература
- •2.3. Экспериментальная часть
- •2.3.1. Приготовление ацетатных буферных растворов
- •2.3.3. Электрометрические измерения
- •2.4. Вопросы для самоконтроля
- •2.5. Задание на дом
- •Занятие 3. Типы, дозировка и способы анализа растворов
- •3.2. Дополнительная литература
- •3.3. Экспериментальная часть
- •3.3.3. Сравнительный качественный анализ аминокислот
- •3.4. Вопросы для самоконтроля
- •3.5. Задание на дом
- •Занятие 4. Методы спектроскопии в анализе биомолекул и клеток
- •4.2. Дополнительная литература
- •4.3. Экспериментальная часть
- •4.3.2. Определение концентрации гемоглобина (Hb) в крови
- •4.3.3. Определение количества эритроцитов в крови с помощью турбидиметрии
- •4.4. Вопросы для самоконтроля
- •4.5. Задание на дом
- •Занятие 6. Основные приемы препаративной биохимии
- •6.2. Дополнительная литература
- •6.3. Экспериментальная часть
- •6.3.2. Разделение гемоглобина и теней эритроцитов
- •6.3.3. Высаливание белковых фракций плазмы крови и их
- •6.4.Вопросы для самоконтроля
- •6.5. Задания на дом
- •Занятие 7. Методы количественного анализа белков
- •7.2. Дополнительная литература
- •7.3. Экспериментальная часть
- •7.3.1. Количественное исследование белковых фракций крови биуретовым методом
- •7.4. Вопросы для самоконтроля
- •7.5. Задание на дом
- •Занятие 8. Деление молекулярных смесей методами хроматографии
- •8.2. Дополнительная литература
- •8.3. Экспериментальная часть
- •8.3.1. Хроматография аминокислот и пептидов на бумаге
- •8.3.2. Гель-хроматография смеси на колонке Сефадекса g – 50
- •8.4. Вопросы для самоконтроля
- •8.5. Задание на дом
- •Занятие 9. Итоговое № 1. Статическая
- •9.2. Задание на дом
- •Занятие 10. Разделение биополимеров методами электрофореза
- •10.2. Дополнительная литература
- •10.4. Вопросы для самоконтроля
- •10.5. Задание на дом
- •Занятие 11. Количественный анализ и свойства ферментов
- •11.2. Дополнительная литература
- •11.3. Экспериментальная часть
- •11.3.1. Получение разведенного препарата амилазы слюны
- •11.3.2. Количественное определение активности амилазы слюны способом Вольгемута
- •11.3.3. Выявление специфичности амилазы
- •11.3.4. Зависимость активности амилазы от температуры
- •11.3.4. Зависимость активности амилазы от величины рН инкубационной смеси. 1. В соответствии с таблицей протокола опыта,
- •11.4. Вопросы для самоконтроля
- •11.5. Задание на дом
- •Занятие 12. Брожение как модель изучения процессов метаболизма
- •12.2. Дополнительная литература
- •12.3. Экспериментальная часть
- •12.3.2. Количественное определение ортофосфата
- •12.4. Вопросы для самоконтроля
- •12.5. Задание на дом
- •Занятие 13. Углеводы. Методы определения и диагностическая роль глюкозы
- •13.2. Дополнительная литература
- •13.3. Экспериментальная часть
- •13.3.1. Глюкозооксидазный метод определения глюкозы в био-жидкостях с помощью тест-наборов фирмы Lachema (Чехия)
- •12.3.2. Определение глюкозы в крови с помощью экспресс-анализатора Эксан-г (Литва)
- •12.3.3. Определение глюкозы в крови с помощью автономного экспресс-измерителя пкг-02-«Сателлит» (Россия)
- •13.4. Вопросы для самоконтроля
- •13.5. Задание на дом
- •Занятие 14. Основы химии и метаболизма липидов и биомембран
- •14.2. Дополнительная литература
- •14.3 Экспериментальная часть
- •14.3.2. Метод определения общего холестерола в биожидкостях, с помощью тест-набора реагентов «Новохол» (зао «Вектор-Бест»)
- •14.4. Вопросы для самоконтроля
- •14.5. Задание на дом
- •Занятие 16. Основы метаболизма азотистых соединений
- •Варианты азотистого баланса
- •Потребность животных в аминокислотах (По р. Марри и др., 1993, с изменениями)
- •16.2. Дополнительная литература
- •16.3 Экспериментальная часть
- •16.3.1. Определение количества мочевины в биожидкостях с помощью тест-набора фирмы Lachema (Чехия)
- •16.3.2. Определение концентрации креатинина в биожидкостях с помощью тест-набора фирмы Lahema (Чехия)
- •16.4. Вопросы для самоконтроля
- •16.5. Задания на дом
- •Занятие 17. Семинар по интеграции метаболизма
- •17.2. Темы реферативных сообщений
- •17.3. Обсуждение рефератов
- •17.4. Задания на дом
- •Занятие 18. Контрольные вопросы к итоговому № 2. Способы управления метаболизмом
- •Приложение
Занятие 14. Основы химии и метаболизма липидов и биомембран
14.1. Общие замечания. С липидами (греч. липос = жир) в виде жира животных и растительных масел, люди знакомы с незапамятных времен. Их применяли в пищу, для освещения, изготовления лекарств, средств косметики, смазок, гидроизолирующих материалов и лакокрасочных покрытий. С XIV в. появились высыхающие масляные краски, сыграв важную роль в развитии живописи и культуры. Техническая обработка липидов началась лишь в XVIII в. с нагрева и щелочного гидролиза. Она привела к получению солей высших жирных кислот = ВЖК, названных «мылами» и выделению глицерола (К. В. Шееле, Швеция). Затем М. Э. Шеврёль (Франция), обработав мыла минеральными кислотами, выделил кристаллические ВЖК и холестерол = ХС. Он же предложил и первую классификацию, отнеся к омыляемым липидам сложные эфиры глицерола и ВЖК. Продолжив эти работы, П. Бертло (1854) синтезировал триацилглицеролы = ТАГ из глицерола и ВЖК, а Ш. Вюрц (1859) – провел их полный органический синтез.
Около 100 лет из ткани мозга, желтка яиц, сои, планктона и других, в т.ч. ископаемых объектов выделяли множество органических молекул, которые относили к липидам, т.к. они плохо растворялись в воде и гораздо лучше – в органических растворителях. Кроме ВЖК и и спиртов, в этих природных соединениях находили фосфат, сульфат, аминоспирты, углеводы и др. Но сложности экстракции, разделения и классификации так тормозили развитие липидологии, что ее звали Schmierchemie – грязной химией.
Со второй половины ХХ в. унифицированы методы экстракции липидов, а хроматография – упростила их разделение. Структурное же разнообразие оказалось так велико, что до сих пор у липидов нет единого определения и классификации. Взгляд на них, как на биополимеры углеводородных групп, позволил считать липидами все дифильные гомо- и гетеромолекулы, создающие при кооперации преимущественно гидрофобных взаимодействий, малополярные ассоциаты переменного состава. Т. о., в строгом смысле, липиды не полимеры, как белки, полинуклеотиды или полиозы. Но биофизика, как основа молекулярной биологии, упростила не только их определение, но и классификацию (рис. 14.1).
Форма, размеры и поверхностная активность липидных агрегатов зависят от степени полярности среды и концентраций их компонентов. В воде, уже при очень низких, порядка 10-10 моль/л критических концентрациях мицеллообразования = ККМ, липиды собираются в сферические, эллипсоидные, реже гексагональные = трубчатые мицеллы.

Рис. 14.1. Схема важнейших подклассов липидов
При этом их полярные группы ориентируются к водной фазе, а углеводородные «хвосты» – скрыты внутри. Агрегационное число в мицеллах молока, млечных соков растений, хиломикронах и липопротеинах гемолимфы и плазмы крови животных, может достигать 2-3-х тысяч молекул.
Наличие в молекуле липида двух алифатических «хвостов», затрудняет их агрегацию в мицеллы с малым радиусом кривизны, но позволяет возникать очень протяженным липидным бислоям = пленкам, толщиной 5-10 нм, в конце концов, замкнутым сами на себя. При разном составе и строении, вязкость бислоя сравнима с вязкостью оливкового масла, а структура жидкого кристалла – допускает латеральную диффузию молекул. Двуслойные липидные ассоциаты, включающие молекулы белков, реже гликолипидов и гликопротеинов и разграничивающие водные фазы клеток, объединяет термин биомембраны. Наконец, тоже дифильные природные детергенты и синтетические моющие средства = СМС, имеют ККМ порядка 10-3 – 10-5 моль/л и агрегационное число от нескольких десятков до полутора-двух сотен молекул. Они плохо образуют мицеллы и бислои, но охотно встраиваются и разрушают такие структуры, построенные другими дифильными липидами.
Каждый подкласс липидов (рис. 14.1), в свою очередь поддается делению. Самый важный и распространенный из них, знакомый из курса органической химии – монокарбоновые ВЖК. Их общая формула R-CООН, при четном числе атомов С в линейном, предельно насыщенном или непредельном углеводородном R. С поправкой на функциональную группу, сходные длина R и масса 300 – 400 Да, приближают к ним свойства высших алифатических спиртов и альдегидов. Важно, что по термодинамическим причинам, конформация алифатического R растянута, а каждая двойная связь = Δ обычно влечет его цис-изгиб на 30о. Т.о., положение Δ и, тем более их количество в R полиненасыщенных жирных кислот = ПНЖК, снижает число гидрофобных взаимодействий и, соответственно, плотность упаковки соседних молекул, проявляясь всплывающими на поверхность более плотной водной фазы, жировыми каплями бульонов и радугой масляных пятен в лужах.
Известно, что предельные ВЖК, как максимально восстановленные углеводороды, содержат много потенциальной энергии и в первую очередь, служат энергетическим резервом клеток и организмов. Они могут синтезироваться из избытка углеводов пищи и, через ацетоуксусную кислоту, из т.н. кетогенных аминокислот: Вал, Лей, Иле, Мет, Тре, Фен и Тир. Непредельные ВЖК содержат от 1 до 6 Δ. Но, если десатуразы продуцентов образуют ряд ПНЖК с Δ в положениях R ω3, ω6, ω9 и т.д., то у консументов, десатураза вводит лишь 1Δ, в положение до ω9 ВЖК. Т.о. жирнокислотный состав (табл. 14.1), раскрывает смысл «школьного заклинания»: «животный жир – твердый, а растительный – жидкий».
Таблица 14.1
Состав ВЖК в жирах, в %

Незаменимы = эссенциальны для консументов лишь линолевая – ω6, 18:2, Δ9,12 и линоленовая – ω3, 18:3, Δ9,12,15 кислоты, хотя термин «витамин F», объединяет совокупность всех ПНЖК растительных масел и жира печени тресковых рыб. Их незаменимость вызвана тем, что линоленовая кислота – субстрат биосинтеза арахидоновой кислоты – ω6, 20:4, Δ5,8,11,14. Т.о., пластическая функция эссенциальных ВЖК, в первую очередь связана с их участием в биосинтезе ФЛ, снижением вязкости и, соответственно, повышением текучести биомембран.
Другая пластическая роль арахидоновой кислоты – образование из нее под действием оксигеназ, ряда молекул-биорегуляторов, объединенных собирательным термином эйкозаноиды (греч. эйкоза = 20). Период полусуществования = Т1/2 простагландинов, лейкотриенов, тромбоксанов и др. так мал (мс-мин), что они успевают изменить лишь метаболизм продуцировавшей их клетки по аутокринному, или соседних клеток – по паракринному механизму. В обоих случаях, эти гистогормоны регулируют секрецию воды и натрия почкой, тонус клеток гладкой мускулатуры сосудов, бронхов, кишечника, матки, а также развитие признаков инфекций, воспаления, отеков и аллергических реакций, в т.ч. бронхиальной астмы. Наконец, многие противовоспалительные средства, включая аспирин, ингибируют оксигеназы синтеза эйкозаноидов.
И зопентадиен
(уст. изопрен) – мономер
обширного подкласса изопреноидов.
Две и больше молекул его активной формы
изопен-тилбисфофата
= ИПФФ,
стыкуясь по принципу «голова-хвост»,
образуют разные линейные, ци-клические,
смешанные и сопряженные молекулы биоты.
Очень разнообразен их синтез у простей-ших,
грибов и растений, создающих множество
терпеноидов, включая каротин и другие
пигменты, эфирные масла типа гераниола,
лимонена, ментола, витаминов А, Е, К, Р,
камфары, смол, латексов и т.д. Моно- и
сесквитерпены играют роль гормонов и
феромонов у насекомых. У позвоночных
животных, способность ИПФФ к конденсации
сужена до синтеза линейного гексамера
– сквалена
и его циклизации в плоский ланостерол
из 17 С-атомов
циклопентанпергидрофенантрена с
11-членным R.
Как конечный продукт секрета сальных
желез птиц и млекопитающих, он создает
защитные смазки перьев и шерсти. Также
из ланостерола возникает его гомолог
– холестерол
= ХС – крупный,
387 Да и гидрофобный полицикл, с R,
укороченным до 8 С (рис. 14.2). Он имеет
единственный гидроксил в положении С3
и Δ в положении 5-6, склоняющую НО-группу
к диссоциации. Как основной стерол
организма животных, эта жесткая и
дифильная молекула, встраиваясь в
биомембраны, повышает
их вязкость
и, соответственно снижает
проницаемость
для ионов и полярных молекул. Т.о.,
концентрации
структурных ПНЖК мембранных ФЛ
и более
подвижный ХС,
как молекулы-антагонисты
контролируют вязкость, текучесть и
проницаемость биомембран.
зопентадиен
(уст. изопрен) – мономер
обширного подкласса изопреноидов.
Две и больше молекул его активной формы
изопен-тилбисфофата
= ИПФФ,
стыкуясь по принципу «голова-хвост»,
образуют разные линейные, ци-клические,
смешанные и сопряженные молекулы биоты.
Очень разнообразен их синтез у простей-ших,
грибов и растений, создающих множество
терпеноидов, включая каротин и другие
пигменты, эфирные масла типа гераниола,
лимонена, ментола, витаминов А, Е, К, Р,
камфары, смол, латексов и т.д. Моно- и
сесквитерпены играют роль гормонов и
феромонов у насекомых. У позвоночных
животных, способность ИПФФ к конденсации
сужена до синтеза линейного гексамера
– сквалена
и его циклизации в плоский ланостерол
из 17 С-атомов
циклопентанпергидрофенантрена с
11-членным R.
Как конечный продукт секрета сальных
желез птиц и млекопитающих, он создает
защитные смазки перьев и шерсти. Также
из ланостерола возникает его гомолог
– холестерол
= ХС – крупный,
387 Да и гидрофобный полицикл, с R,
укороченным до 8 С (рис. 14.2). Он имеет
единственный гидроксил в положении С3
и Δ в положении 5-6, склоняющую НО-группу
к диссоциации. Как основной стерол
организма животных, эта жесткая и
дифильная молекула, встраиваясь в
биомембраны, повышает
их вязкость
и, соответственно снижает
проницаемость
для ионов и полярных молекул. Т.о.,
концентрации
структурных ПНЖК мембранных ФЛ
и более
подвижный ХС,
как молекулы-антагонисты
контролируют вязкость, текучесть и
проницаемость биомембран.
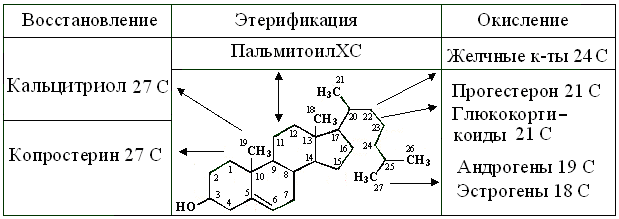
Рис. 14.2. Структура и схема превращений холестерола в тканях
Также ХС – предшественник всех стероидов животных, образование которых зависит от набора Е, экспрессируемых в той или иной ткани. Из него возникают пальмитоилХС – запасная форма в мицеллах и конечный продукт – копростерин ЖКТ. Желчные кислоты, как и фитостерины – природные детергенты, образующие небольшие агрегаты из нескольких молекул. Как и все детергенты, они легче разрушают, чем образуют липидные мицеллы и бислои. Поэтому, в переваривании пищевых жиров, желчные кислоты играют 3 роли: 1) эмульгатора; 2) активатора липазы и 3) транспортера ВЖК в эпителиоциты кишечника. Наконец, из ХС образуются такие БАВ, как индуктор генов синтеза калбиндинов – 1,3,25-три-гидроксикальциферол = кальцитриол, глюко- и минералокортикостероиды, а также все половые гормоны.
Как следует из рис. 14.1 и названия подкласса, основа всех глицеролипидов – трехатомный спирт глицерол. Образование трех сложноэфирных связей с остатками ВЖК по всем гидроксилам, ведет к биосинтезу ТАГ, а присоединение в двух положениях ВЖК и, ортофосфата в третьем – дает более полярную фосфатидную кислоту = ФдК (рис. 14.3). ВЖК в их составе могут var, в зависимости от вида, типа пищи и температуры мест обитания. Так, у животных, обитателей средних широт, в среднем положении глицеролипидов – непредельная ВЖК, а с краев – предельные. Полная гидрофобность молекул ТАГ делает их химически инертными, в связи с чем, они играют пассивные физиологические роли механо- и термоизоляторов, а также энергетических резервов жировых клеток и вакуолей.

Рис. 14.3. Структурные и условные формулы ТАГ и фосфатидных кислот
ФдК не играет самостоятельной структурной роли, но служит предшественником биосинтеза всех, более полярных чем ТАГ, подклассов ФЛ (рис. 14.4). При этом соответствующие спирты, создают основу структурной классификации собственно ФЛ.

Рис. 14.4. Схема структуры и свойств производных фосфатидной кислоты
Из рисунка 14.5 видно, что гидроксиаминокислота серин, не только образует самостоятельный подкласс ФЛ – ФдС, но, при помощи указанных Е, служит предшественником подклассов ФдЭ и ФдХ. Более крупная гидрофобная головка ФдХ вынуждает их локализоваться преимущественно по большой кривизне внешних монослоев биомембран, тогда как небольшие полярные головки ФдС и особенно ФдЭ, влекут их локализацию по малой кривизне внутренних монослоев. При этом у ФдХ и ФдЭ, отрицательный заряд фосфата нейтрализован положительным зарядом атома N, тогда как у ФдС и, особенно, резко полярных ФдИ, выражен избыточный отрицательный заряд внутренней поверхности мембран.
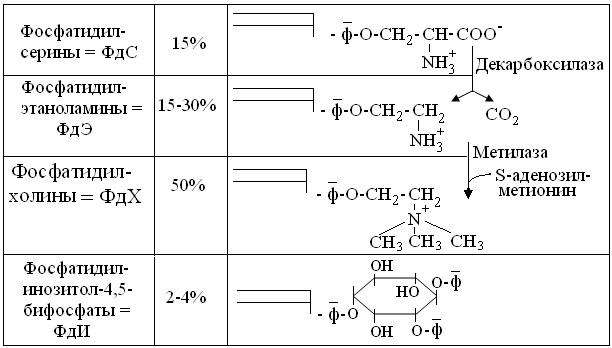
Рис. 14.5. Структура и классификация собственно ФЛ
Добавим, что мембранные фосфолипазы с разной специфичностью, разрушая ФЛ, образуют продукты со свойствами БАВ. Так, фосфолипаза С, гидролизуя ФдИ, образует малополярный диацилглицерол = ДАГ и резко полярный инозитолтрифосфат = ИФ3, каждый из которых, диффундируя соответственно по липидной и водной фазам клетки, играет роль сигнальных молекул. В других случаях, фосфолипаза А2 высвобождает из мембранных ФЛ арахидоновую кислоту, что, как уже сказано, ведет к образованию эйкозаноидов с функцией гистогормонов. Другой, уже «однохвостый» продукт фосфолипазы А2, по устаревшей номенклатуре названный лизолецитином, подобно детергентам разрушает биомембраны, что легко выявить по гемолизу эритроцитов. Обычно, такой «гемолитический яд» не успевает нанести серьезного вреда, т.к. его разрушают другие фосфолипазы. Но ряд тропических водорослей, медуз, морских звезд и перепончатокрылых содержит такие концентрации «однохвостых» липидов, что их гемолитическое действие весьма ощутимо. Наконец, яды змей могут содержать фосфолипазы широкого спектра действия, вызывающие массивный лизис биомембран, как в месте укуса, так и по ходу кровеносных сосудов.
В
основе подкласса сфинголипидов
(рис. 14.1) лежит двухатомный
спирт
сфингозин.
Его можно рассматривать как производное
глицерола, с заменой гидроксилов в
положении С2 на аминогруппу и в С3 – на
алифатический хвост с 16 – 20 С-атомами.
Нередко, в положении С4-С5, есть Δ в
трансконфигурации. Видимо, длинноцепочечная
(С20
–С22)
ВЖК,  скрепленная
со сфингозином амидной
связью в С2
остатка глицерола, придает сфинголипидам
повышенную гидрофобность. В свое время
эти соединения получили название
керамиды = церамиды (от греч. кератос =
рог). В свободном виде, они в тканях почти
не встречаются, но, соединяясь с фосфатом,
холином и его гликановыми производными,
в т.ч. сульфатированными, создают разные
классы сфинголипидов плазматических
мембран клеток.
скрепленная
со сфингозином амидной
связью в С2
остатка глицерола, придает сфинголипидам
повышенную гидрофобность. В свое время
эти соединения получили название
керамиды = церамиды (от греч. кератос =
рог). В свободном виде, они в тканях почти
не встречаются, но, соединяясь с фосфатом,
холином и его гликановыми производными,
в т.ч. сульфатированными, создают разные
классы сфинголипидов плазматических
мембран клеток.
Воски – простейший класс гетеролипидов (рис. 14.1). Как сложные эфиры высших одноатомных алифатических спиртов и ВЖК, они служат основной формой энергозапасов микроорганизмов морского планктона и, в силу своей гидрофобности и химической инертности, защитным покрытием листьев, плодов растений и смазкой перьев и кожи водных животных (табл. 14.2). Наиболее известен мирицилпальмитат пчел, образующий структуру сот и, до выпуска парафина в промышленных масштабах, широко применявшийся для изготовления свечей, сургуча, ряда смазок и клеев.
Таблица 14.2
Примеры химического состава восков

