- •Билет 1
- •Билет 2
- •Билет 3
- •1.Преобразования и принцип относительности галилея.
- •Внутренний фотоэффект
- •Фотоэффект в запирающем слое
- •3. Молекулярно-кинетическая теория (мкт)
- •Билет 4
- •Билет 5
- •Билет 6
- •Билет 7
- •1.Тормозное рентгеновское излучение.
- •2. Сложение колебаний, происходящих в одном направлении.
- •3. Теплоемкость при постоянном давлении и объеме.
- •Билет 8
- •Билет 9
- •Билет 10
- •Билет 12
- •3.Двойное лучепреломление
- •4.Деформация
- •5.Эффект Керра
- •Билет 13
- •1.Силы, действующие на тело, покоящееся на земле.
- •2.Стоячие волны.
- •3. Дифракция света. Принцип Гюйгенса-Френеля. Зоны Френеля.
- •Билет 15
Билет 1
1.1 Основные законы оптики:
Закон прямолинейного распространения света
Выполняется в прозрачных однородных средах. Наблюдаемые отклонения – дифракция света, рассеяние света в мутной среде

Закон независимости распространения световых лучей
Освещенность экрана, создаваемая несколькими световыми лучами, равна сумме освещенностей, создаваемых каждым пучком в отдельности. Наблюдаемые отклонения – интерференция света.
Закон отражения света

1) Угол падения (φ) равен углу отражения (φ´) | φ= φ´
2) Падающий луч, луч отраженный и перпендикуляр, восстановленный в точке падения, лежат в одной плоскости
Закон преломления света

![]()
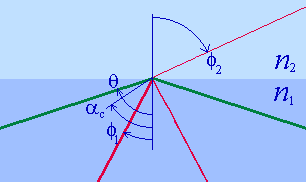
Полное внутреннее отражение
![]()
Полное внутреннее отражение — внутреннее отражение, при условии, что угол падения превосходит некоторый критический угол. При этом падающая волна отражается полностью, и значение коэффициента отражения превосходит его самые большие значения для полированных поверхностей. Коэффициент отражения при полном внутреннем отражении не зависит от длины волны.
Построение изображений в тонких линзах.
Линза называется тонкой, если ее толщина значительно меньше радиусов кривизны образующих поверхностей. В тонкой линзе можно пренебречь смещением, α лучей, проходящих через центральную часть.

1.2 Давление внутри жидкости. Закон Архимеда.
Согласно
закону Архимеда, равнодействующая
всех сил давления, приложенных к
поверхности тел, погруженных в жидкость
(или
газ),
направлена
вертикально вверх и равна весу жидкости
(или
газа)
в
объеме данного тела.
![]()

1.3 Состояние вещества. Параметры состояния. Идеальный газ.
Состояние вещества - классификация веществ относительно их структурных характеристик. Существует четыре общепризнанных состояния веществ: ТВЕРДОЕ, ЖИДКОЕ, ГАЗООБРАЗНОЕ и ПЛАЗМА.
Параметры состояния - это свойства веществ, которые идентифицируют их термодинамическое состояние (состояние вещества с точки зрения его давления, температуры, внутренней энергии, плотности, удельного объема, энтальпии и энтропии) в определенное время.
ИДЕАЛЬНЫЙ ГАЗ, теоретическая модель газа; в которой пренебрегают размерами частиц газа, не учитывают силы взаимодействия между частицами газа, предполагая, что средняя кинетическая энергия частиц много больше энергии их взаимодействия, и считают, что столкновения частиц газа между собой и со стенками сосуда абсолютно упругие.
![]()
По эквивалентной формулировке идеальный газ одновременно подчиняется закону Бойля — Мариотта и Гей-Люссака
![]() Свойства
идеального газа описываются уравнением
Менделеева — Клапейрона, где
Свойства
идеального газа описываются уравнением
Менделеева — Клапейрона, где
![]() -
универсальная газовая постоянная,
-
универсальная газовая постоянная,
![]() —
масса,
—
масса,
![]() —
молярная масса.
—
молярная масса.
![]() где
где
![]() —
концентрация частиц,
—
концентрация частиц,
![]() —
постоянная Больцмана.
—
постоянная Больцмана.
Билет 2

Криволинейное движение – это движение, траектория которого представляет собой кривую линию (например, окружность, эллипс, гиперболу, параболу). Примером криволинейного движения является движение планет, конца стрелки часов по циферблату и т.д. В общем случае скорость при криволинейном движении изменяется по величине и по направлению.
Криволинейное движение материальной точки считается равномерным движением, если модуль скорости постоянен (например, равномерное движение по окружности), и равноускоренным, если модуль и направление скорости изменяется (например, движение тела, брошенного под углом к горизонту).
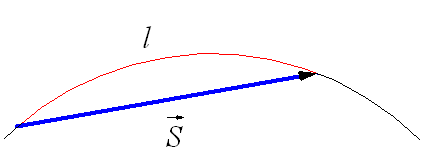
Траектория и вектор перемещения при криволинейном движении.
При движении по криволинейной траектории вектор перемещения направлен по хорде (рис. 1.19), а l – длина траектории. Мгновенная скорость движения тела (то есть скорость тела в данной точке траектории) направлена по касательной в той точке траектории, где в данный момент находится движущееся тело (рис. 1.20).
М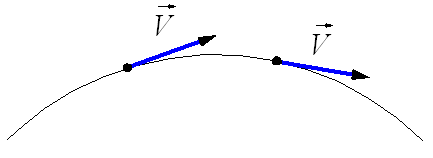 гновенная
скорость при криволинейном движении.
гновенная
скорость при криволинейном движении.
Криволинейное движение – это всегда ускоренное движение. То есть ускорение при криволинейном движении присутствует всегда, даже если модуль скорости не изменяется, а изменяется только направление скорости. Изменение величины скорости за единицу времени – это тангенциальное ускорение:
![]()
или
![]()
Где vτ, v0 – величины скоростей в момент времени t0 + Δt и t0 соответственно.
Тангенциальное ускорение в данной точке траектории по направлению совпадает с направлением скорости движения тела или противоположно ему.
Нормальное ускорение - это изменение скорости по направлению за единицу времени:
![]()
Нормальное ускорение направлено по радиусу кривизны траектории (к оси вращения). Нормальное ускорение перпендикулярно направлению скорости.
Центростремительное ускорение – это нормальное ускорение при равномерном движении по окружности.
Полное ускорение при равнопеременном криволинейном движении тела равно:
![]()
2)
Радиоактивность – свойство атомных ядер самопроизвольно изменять свой состав в результате испускания частиц или ядерных фрагментов. Закон радиоактивного распада N (t) = N0 e-λt = N0 e-t/
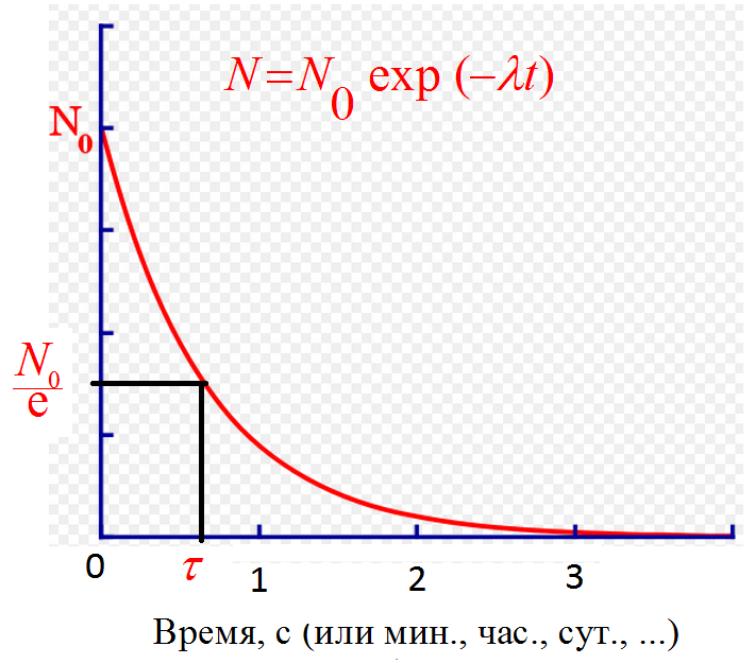
Основными видами радиоактивного распада являются:
• α-распад – испускание ядрами α-частиц,
• β-распад – испускание (или поглощение) лептонов,
• γ-распад – испускание γ-квантов,
• спонтанное деление – распад ядра на два осколка сравнимой массы.
Редкие виды радиоактивного распада - испускание ядрами одного или двух протонов, а также кластеров – лёгких ядер от 12С до 32S. Во всех видах радиоактивности (кроме гамма-радиоактивности) изменяется состав ядра – число протонов Z , массовое число А или то и другое одновременно.
Спонтанное деление - четвертый вид радиоактивности, открытый в 1940 Г.Н.Флеровым и К.А.Петржаком для природного урана, связан со спонтанным делением ядер, в процессе которого некоторые достаточно тяжелые ядра распадаются на два осколка с примерно равными массами. Ядра урана могут делиться различным образом, давая два осколка (например, 56Ba-36Kr, 54Xe-38Sr и т.п.). В 1 г естественного урана происходит в среднем одно деление в мин.
По своим основным характеристикам:
величине выделяемой энергии (200 МэВ), виду спектра масс осколков, числу и энергии вторичных нейтронов (мгновенных – испускаемых в момент деления и запаздывающих – вылетающих после β - распада осколков) – спонтанное деление очень схоже с делением тяжёлых ядер под действием нейтронов.
Третий вид β-распада (K-захват или е-захват) заключается в том, что ядро поглощает один из K-электронов своего атома, в результате чего один из протонов превращается в нейтрон, испуская при этом нейтрино:
р + е- → n + v
Прото́нный распа́д (протонная эмиссия, протонная радиоактивность) — один из видов радиоактивного распада, при котором атомное ядро испускает протон.
(A, Z) → (A − 1, Z − 1) + p.

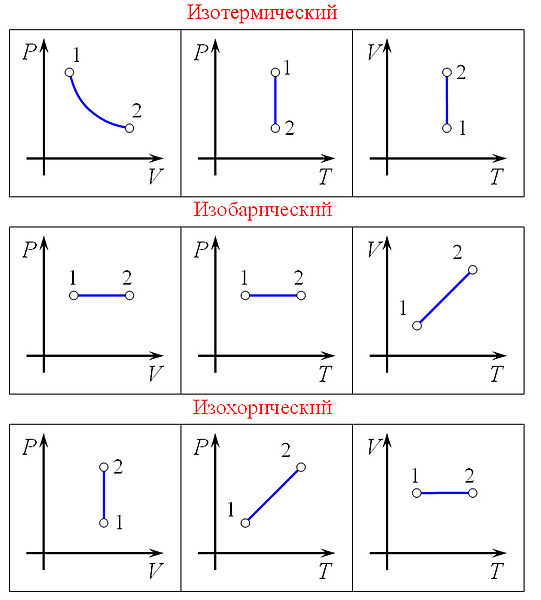
3) Изобарный процесс
И![]() зобарный
процесс— процесс изменения состояния
термодинамической системы при постоянном
давлении
зобарный
процесс— процесс изменения состояния
термодинамической системы при постоянном
давлении
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком. Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный процесс
Изохорный процесс — процесс изменения состояния термодинамической системы при постоянном объёме (). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
![]()
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
Ещё стоит указать что поданная к газу энергия расходуется на изменение внутренней энергии то есть Q = 3* ν*R*T/2=3*V*ΔP, где R — универсальная газовая постоянная, ν количество молей в газе, T температура в Кельвинах, V объём газа, ΔP приращение изменения давления. а линию, изображающая изохорный процесс на диаграмме, в осях Р(Т), стоит продлить и пунктиром соединить с началом координат, так как может возникнуть недопонимание.
Изотермический процесс
PV=CONST
Изотермический процесс — процесс изменения состояния термодинамической системы при постоянной температуре ()(). Изотермический процесс описывается законом Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.