
- •Понятие о коррозии металлов
- •1.5 Общие принципы защиты Ме от коррозии
- •2.1 Возникновение скачка потенциала на границе между фазами
- •2.2 Равновесные и неравновесные электродные потенциалы
- •Стационарный потенциал
- •2.8 Термодинамика эл-хим коррозии
- •3.1 Стадийность электродных процессов
- •Катодное восстановление кислорода, растворённого в электролите. Консетрационная поляризация при восстановлении при восстановление кислорода
Понятие о коррозии металлов
Коррозия – самопроизвольное разрушение металлических материалов в результате их химического или электрохимического взаимодействия с окружающей ( коррозионной) средой.
Коррозию как самопроизвольный процесс необходимо различать от преднамеренного разрушения
1)При получении солей растворением металла кислотами
2)В гальванических элементах с целью получения электрического тока
3)В процессе электрогальваники
4)В процессе металлотермии
Коррозионные процессы следует отличать от таких видов разрушения металлов как:
1)Радиоактивный распад металлов
2)от эрозии(чисто-механических разрушение металла)
Т.к коррозия протекает на границе раздела фаз металл-коррозионная среда, то она является гетерогенным многостадийным процессом и состоит как минимум из трех основных многократно повторяющихся стадий:
1) подвода реагирующих веществ (в том числе коррозионного агента) к поверхности раздела фаз;
2) собственно реакции взаимодействия металла с коррозионной средой, итогом которой является переход некоторого количества металла в окисленную форму с образованием продуктов коррозии, а коррозионного агента в восстановленную форму;
3) отвод продуктов коррозии из реакционной зоны.
2.2 Классификация коррозионных процессов. Виды коррозионных разрушений.
Сущность любого коррозионного процесса сводится к окислению металла, то есть образованию более устойчивого состояния - его окисленной формы.
В зависимости от механизма окисления различают химическую и электрохимическую коррозию:
1.Химическая коррозия - самопроизвольное взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды происходят в одном акте, а коррозионными являются среды, не проводящие электрический ток (сухие газы или жидкости неэлектролиты):
mМе + nОх — Mem(Red)n
где Me - металл; Ох - окислительный компонент коррозионной среды; Red его восстановленная форма.
2.Электрохимическая коррозия - самопроизвольное взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды происходят не в одном акте, а сопряжено и скорости этих процессов зависят от величины электродного потенциала металла:
Me — Mez+ + ze
n Ox +ze — mRed
Коррозионными средами в данном случае являются токопроводящие среды (растворы или расплавы электролитов, влажные газы).
В зависимости от условий протекания различают следующие основные виды коррозии:
1.Газовая коррозия - коррозия металлов в сухих газах, чаще при высоких температурах.
2.Атмосферная - коррозия во влажном воздухе или любой другой влажной газовой среде.
3.Жидкостная - коррозия в жидкостях как электролитах, так и неэлектролитах.
4.Подземная - коррозия в различных почвах и грунтах.
5.Биокоррозия - коррозия являющаяся результатом жизнедеятельности определенных микроорганизмов.
6.Структурная коррозия - коррозия, обусловленная структурной неоднородностью металлов и их сплавов.
7.Коррозия внешним током — электрохимическая коррозия под действием тока от внешнего источника.
8.Коррозия блуждающими токами - электрохимическая коррозия под действием блуждающего (наведенного) тока.
9.Контактная коррозия (КК) — ускорение коррозии электроотрицательного металла при контакте с другим, более электроположительным металлом.
10.Щелевая коррозия - обусловлена интенсификацией коррозионного процесса в щелях и зазорах как между металлами, так и между металлом и неметаллом.
11.Коррозия под напряжением - коррозия, происходящая при одновременном воздействии на металл коррозионной среды и механических напряжений, возникающих как при постоянной, так и при знакопеременной или циклической нагрузке.
12.Сульфидное коррозионное растрескивание (СКР) - проявляется в высокопрочных сталях в коррозионных средах, содержащих сероводород, при растягивающих нагрузках.
13.Водородное растрескивание (ВР) или «охрупчивание» - проявляется в низкопрочных сталях при эксплуатации их в наводораживающих средах, обычно - кислых, без приложения механических нагрузок.
14.Коррозия при трении (коррозионная эрозия) - разрушение металла при одновременном воздействии на него коррозионной среды и трения.
В зависимости от характера коррозионного разрушения различают следующие основные виды коррозии (виды коррозионных разрушений):
1.Сплошная или общая коррозия - коррозия, протекающая на всей поверхности металлического материала. Она бывает:
а) равномерной - протекающей с одинаковой скоростью на всей поверхности металла;
б) неравномерной - протекающей с неодинаковой скоростью на различных участках поверхности металла;
в) избирательной (селективной) - обусловленной разрушением одной структурной составляющей или одного компонента сплава.
2.Местная коррозия - коррозия, протекающая на отдельных участках поверхности металлического материала. Она бывает:
а) пятнами - в виде отдельных пятен на поверхности металла;
б) язвами - в виде отдельных раковин на поверхности металла;
в) питтинговой (ПК) или точечной коррозией - в виде, малозаметных визуально, глубоких язв (каналов) очень малого диаметра, которые могут пронизывать всю толщу металла;
г) подповерхностной коррозией - в виде вспучивания и расслоения металла вследствие того, что разрушение и продукты коррозии оказываются сосредоточенными в некоторых областях внутри металла, под его поверхностью
д) межкристаллитная (МКК) или интеркристаллитная но коррозия, распространяющаяся по границам кристаллитов (зерен) метелла и вызванная действием коррозионной среды после провоцирующего термовоздействия (термообработки);
е) ножевая коррозия (НК) это частный вариант МКК, характерный для сварных соединений. Имеет вид надреза ножом в зоне, прилегающей к сварному шву;
ж) коррозионное растрескивание (КР) - это внезапное хрупкое разрушение металла в результате одновременного воздействия коррозионной среды и внешних или внутренних остаточных механических растягивающих напряжений. Бывает транскристаллитнмм или интеркристаллитным.
Практика свидетельствует о том, что среди видов коррозионных разрушений наибольшую долю – 1/2 можно отнести на счет таких опасных видов местной коррозии, как ПК, МКК и КР, а еще ~ 1/3 приходится на общую равномерную и неравномерную коррозию. Однако необходимо особо отметить, что относительное количество разрушений по тому или иному механизму не отражает действительной оценки их опасности. Экономические и экологические потери в результате коррозионных поражений, в первую очередь, определяются характером конкретного производства, его уникальностью, металлоемкостью конструкций, участием в технологии высокотоксичных веществ, ценностью конечной продукции и т. д.
Способы выражения скорости коррозии и методы ее оценки
Скорость коррозии вычисляют либо в весовых единицах, отнесенных к единице поверхности (см2, м2) в единицу времени (час, сутки, год), либо как усредненное уменьшение толщины образца в микронах, миллиметрах или сантиметрах в год.
Среднюю скорость коррозии можно рассчитать по формуле:
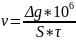
Где
v
– скорость коррозии, г/(м2*ч);
 - потеря массы образца, г; S
– площадь образца, мм2;
τ – время испытаний, ч; 106
– число мм2
в 1 м2.
- потеря массы образца, г; S
– площадь образца, мм2;
τ – время испытаний, ч; 106
– число мм2
в 1 м2.
По величине средней скорости коррозии находят балл, характеристику устойчивости металла и коррозионную активность среды.
Сравнить коррозионную стойкость металлов и сплавов с различной плотностью можно с помощью глубинного показателя:

Где v – средняя скорость коррозии, г/(м2*ч); ρ – плотность металла, г/см3; δ – глубинный показатель коррозии, мм/год.
Метод оценки коррозии по изменению массы называется гравиметрическим.
Если коррозия сопровождается выделением или поглощением газа, то скорость коррозии можно выразить через изменение объема газа вольюмометрическим методом. Изменение массы образца составляет:


V – объем поглощенного О2 или выделившегося H2, см3; Vмоль – мольный объем газа, см3; А – атомная масса металла, г; z – степень окисления металла.
Скорость коррозии при этом:
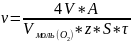

Мерой скорости электрохимической коррозии является сила тока I (А) или плотность тока i (А/см2) коррозии. Скорость коррозии связана с I или i соотношением:

Где v – скорость коррозии, г/(см2*с); n – число электронов, участвующих в реакции (n может не совпадать с z); F – число Фарадея (96500 Кл/г-экв.).
Термодинамические причины протекания коррозионных процессов, факторы, препятствующие им.
Единственной причиной окисления металлов в любой среде является их термодинамическая неустойчивость , то есть возможность самопроизвольного взаимодействия металла с окислителем. Она оценивается величиной изменения свободной энергии Гиббса ΔGт. Если эта энергия убывает в ходе реакции (ΔGт < 0), то окисление металла термодинамически разрешено, при ΔGт > 0 процесс запрещен, при ΔGт = 0 наступает состояние равновесия.
Если рассматривать окисление метллов по условной схеме xMe + y/2O2 = = MexOy, то на основании обычных термодинамических законов можно сделать вывод, что увеличение давления кислорода в атмосфере увеличивает вероятность образования оксидов. В соответствии с уравнением изотермы Вант-Гоффа:

где
 - равновесное давление кислорода;
- равновесное давление кислорода;
 - давление кислорода, при условиях
эксплуатации металла.
- давление кислорода, при условиях
эксплуатации металла.
Увеличение температуры уменьшает вероятность образования оксидов, и для каждого металла существует некоторая температура, при которой он перестает окисляться. Эта температура лежит много выше рабочей температуры металлов, которая не превышает 1200 °С.
