- •Вопрос 1.
- •Вопрос 2
- •Интерференция световых волн
- •Интерференция света в тонких плёнках
- •Интерферометры
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6 .Интерференция поляризованного света. Вращение плоскости поляризации.
- •Вопрос 7. Электромагнитные волны в веществе. Распространение света в веществе. Дисперсия света. Поглощение света. Прозрачные среды. Поляризация волн при отражении.
- •Элементы квантовой электроники
- •12.1. Поглoщение, спонтанное и вынужденное излучение
- •Вопрос 9. Законы теплового излучения
- •Вопрос 10
- •Явление фотоэлектрического эффекта:
- •Вольт-амперная характеристика (рис 2)
- •Эффект Комптона
- •Стационарные задачи квантовой механики:
- •Штерна -герлаха опыт
- •Вопрос 11
- •Гипотеза де-Бройля. Волновые свойства вещества
- •Вопрос 12
- •Пространственное распределение электрона в атоме водорода. @
- •Особенности структуры электронных уровней в сложных атомах. Связь распределения электронов по орбиталям с периодической таблицей Менделеева.@
- •Вопрос 13.
- •Механизмы ядерных реакций.
- •Цепная реакция деления
- •Атомный реактор
- •Термоядерные реакции
- •Вопрос 14
- •Вещество и поле
- •Единая теория материи
Особенности структуры электронных уровней в сложных атомах. Связь распределения электронов по орбиталям с периодической таблицей Менделеева.@
Условно
все возможные квантовые состояния
распределяют (группируют) по слоям
(оболочкам), подслоям (подоболочкам) и
орбиталям. Как оказалось, свойства
атомов определяются распределением
электронов по этим состояниям.
Квантовым
слоем (квантовой оболочкой) называют
совокупность состояний, которым
соответствует одно и тем же значение
квантового числа n, но разные значения
l, m,
s. Наибольшее число электронов N, которые
могут находиться в оболочке, согласно
(2.8), равно удвоенному квадрату номера
слоя: N=2n2.
Так как энергия состояний в многоэлектронном
атоме зависит от двух квантовых чисел
n и l, то электроны в квантовом слое могут
занимать l энергетических уровней.
Квантовые слои обозначаются цифрами,
соответствующими номерам слоев, кроме
того они имеют названия: слой n = 1 называют
К слоем (или К оболочкой), слой n = 2 называют
L слоем (или L оболочкой), слой n =
3 – М слоем, n = 4 – N, n = 5 – О слоем, n = 6 –
Р и так далее.
Каждый
квантовый слой с номером n условно
состоит из n квантовых подслоев
(подоболочек), соответствующих состояниям
с одними и теми же n,
l, но разными m, s. В
подслое может находиться до
2(2 l+1) электронов,
подслои обозначаются буквами: l = 0
– s, l =
1 – p, l =
2 – d, l =
3 – f, l= 4 – g и т.д. Энергия электронов
одного подслоя примерно одинакова.
В
свою очередь, каждый подслой состоит
из 2l+1орбиталей, соответствующих
состояниям с одними и теми же n, l, m, но
разными s. 1/2.На
каждой орбитали может находиться не
более двух электронов с разными спиновыми
числами s =
Отсюда
следует, что в s-подслое может содержаться
максимум 2 электрона, в р-подслое – 6, в
d – 10, в f – 14, в g – 18 электронов.
Соответственно в слое K может содержаться
максимум 2 электрона, в слое L – 8, в слое
M –18, в слое N – 32 и т.д.
1sСтруктуры
и максимально возможные заполнения
слоев изображают в виде формул: K-слой
2
2s,
L слой 22p6
3s,
M-слой 2 3p6 3d10
4s,
N-слой 2 4p64d104f14.
Используя введенные понятия, можно
условно формулой и графически изобразить
распределение электронов, например
атома кислорода О8,
следующим образом: символьно- 1s2 2s2 2p4 ,
графически- (Рис.14).
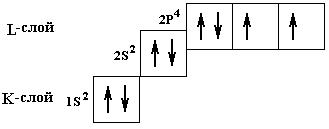 Рис.14.
Условное графическое изображение
орбиталей кислорода.
При
заселении орбиталей электроны в первую
очередь располагаются поодиночке на
каждой орбитали, а затем начинается их
заполнение вторыми электронами. Эта
особенность называется правилом Гунда,
она связана с тем, что энергия подслоя
при таком заполнении несколько меньше.
На рис.14 показано применение этого
правила для кислорода.
Рис.14.
Условное графическое изображение
орбиталей кислорода.
При
заселении орбиталей электроны в первую
очередь располагаются поодиночке на
каждой орбитали, а затем начинается их
заполнение вторыми электронами. Эта
особенность называется правилом Гунда,
она связана с тем, что энергия подслоя
при таком заполнении несколько меньше.
На рис.14 показано применение этого
правила для кислорода.
Принцип Паули - фундаментальный закон природы,согласно которому в квантовой системе две (или более) тождественныечастицы с полуцелым спином не могут одновременно находиться в одном и томже состоянии. Сформулирован В. Паули (1925). Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: 1. Главное квантовое число n (n = 1, 2 ...). 2. Орбитальное (азимутальное) квантовое число l (l = 0, 1, 2, ... n-1). 3. Магнитное квантовое число m (m = 0, +/-1, +/-2, +/-... +/-l). 4. Спиновое квантовое число ms (ms = +/-1/2 ). Для одного фиксированного значения главного квантового числа n существует 2n2 различных квантовых состояний электрона. Один из законов квантовой механики, называемый принципом Паули, утверждает: В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел, (т.е. не может быть двух электронов в одинаковом состоянии). Принцип Паули дает объяснение периодической повторяемости свойств атома, т.е. периодической системе элементов Менделеева.
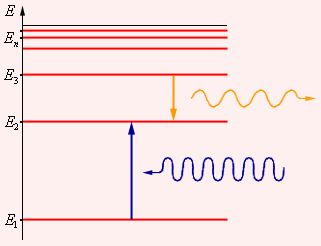
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовыхсостояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра, т. е. происходит ионизация. Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
|
Рисунок 6.2.2. Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов |
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
|
где h – постоянная Планка. Отсюда можно выразить частоту излучения:
|
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
ЛИНЕЙЧАТЫЕ СПЕКТРЫ — оптические спектры испускания и поглощения, состоящие из отдельных спектральных линий. Л. с. являются атомные спектры, спектры звёздных атмосфер (см. Фраунгофероеы линии), спектры органич. молекул при низких темп pax в спец. условиях (см.…
АТОМНЫЕ СПЕКТРЫ - оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами атома. Атомные спектры - линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов, используются также в спектральном анализе.