
- •Контенты лекций по дисциплине «Современные концепции естествознания»
- •Раздел 1. Естествознание, его предмет, структура и место среди других наук
- •Тема 1.1. Естественнонаучная и гуманитарная культуры; научный метод; история естествознания
- •Раздел 2. Панорама современного естествознания
- •Тема 2.1. Основные понятия и законы естествознания
- •Современная физическая картина
- •Тема 2.2. Микромир и его особенности
- •Мир элементарных частиц
- •Тема 2.3. Макромир и его особенности
- •Геодинамические процессы
- •Особенности постнеклассической науки XXI в.
- •Теория самоорганизации (синергетика)
- •Тема 2.4. Мегамир и его особенности
- •Раздел 3. Особенности биологического уровня организации материи
- •Тема 3.1. Уровни организации жизни
- •Тема 3.2. Возникновение жизни на Земле
- •Тема 3.3. Эволюция органического мира
- •Тема 3.4. Антропогенез
- •Тема 3.5. Биосфера и человек
Тема 2.2. Микромир и его особенности
Как правило, человечество получало и получает знания селективно, условно деля познаваемый мир на три структурных уровня: мега- , макро- и микромир.
Мегамир – часть материального мира, в которой познание доступно астрономическому (наблюдательному и теоретическому) исследованию; макромир – часть материального мира, в которой живет и действует человек и возможно познание путем непосредственного восприятия с помощью органов чувств человека; микромир – часть материального мира, в которой для человека невозможно познание путем непосредственного наблюдения.
Возникновение и развитие квантовой физики
Гипотеза квантов. В 1809 г. П. Прево сделал вывод, что каждое тело излучает независимо от окружающей среды. Г. Кирхгоф в 1860 г. сформулировал новый закон, который гласит, что для излучения одной и той же длины волны при одной и той же температуре отношение испускательной и поглощательной способностей для всех тел одинаково. Кирхгоф ввел понятие абсолютно черного тела как тела, поглощающего все падающие на него лучи.
Для энергии излучения абсолютно черного тела В. Вин в 1896 г., Дж. Рэлей и Дж. Джине в 1900 г. предложили две различные формулы. Как показали экспериментальные результаты, формула Вина асимптотически верна в области коротких волн и дает резкие расхождения с опытом в области длинных волн, а формула Рэлея – Джинса асимптотически верна для длинных волн, но не применима для коротких.
В 1900 г. на заседании Берлинского физического общества М. Планк предложил новую формулу для распределения энергии в спектре черного тела. Эта формула полностью соответствовала опыту, но ее физический смысл был не вполне понятен. Дополнительный анализ показал, что она имеет смысл только в том случае, если допустить, что излучение энергии происходит не непрерывно, а определенными порциями – квантами (ε). Формулировка гипотезы квантов энергии была началом новой эры в развитии теоретической физики.
Существенно новым шагом в развитии квантовой гипотезы было введение понятия квантов света. Эта идея была разработана в 1905 г. Эйнштейном и использована им для объяснения фотоэффекта. В 1909 г. Эйнштейн, продолжая исследования законов излучения, показывает, что свет обладает одновременно и волновыми, и корпускулярными свойствами.
Теория атома Н. Бора. Принцип соответствия.
В 1909—1910 гг. Э. Резерфордом были проведены экспериментальные исследования рассеяния ос-частиц тонким слоем вещества. Результаты исследований позволили Резерфорду в 1911 г. сформулировать планетарную модель атома. Более совершенную квантовую модель атома предложил в 1913 г. молодой датский физик Н. Бор, работавший в лаборатории Резерфорда. Бор взял за основу модель атома Резерфорда и дополнил ее новыми гипотезами, которые не следуют или даже противоречат классическим представлениям. Эти гипотезы известны как постулаты Бора:
1. Каждый электрон в атоме может совершать устойчивое орбитальное движение по определенной орбите, с определенным значением энергии, не испуская и не поглощая электромагнитного излучения. Всякое изменение энергии в результате поглощения или испускания электромагнитного излучения может происходить только скачком из одного состояния в другое.
2. Электрон способен переходить с одной стационарной орбиты на другую. Только в этом случае он испускает или поглощает определенную порцию энергии монохроматического излучения определенной частоты.
Идеи и понятия квантовой механики. Принцип неопределенности. В 1925 г. В. Гейзенберг построил так называемую матричную механику; а в 1926 г. Э. Шрёдингер разработал волновую механику. Вскоре выяснилось, что и матричная механика, и волновая механика — различные формы единой теории, получившей название квантовой (нерелятивистской) механики.
Теория атомных явлений, по Гейзенбергу, должна ограничиваться установлением соотношений между величинами, которые непосредственно измеряются в экспериментальных исследованиях («наблюдаемыми» величинами, в терминологии Гейзенберга) – частотой излучения спектральных линий, их интенсивностью, поляризацией и т.п. А «ненаблюдаемые» величины, такие, как координаты электрона, его скорость, траектория, по которой он движется, и т.д., не следует использовать в теории атома. Вместо координат и скоростей электрона в его схеме фигурировали абстрактные алгебраические величины - матрицы. Матрицы соотносились с наблюдаемыми величинами простыми правилами.
Анализируя закономерности измерения величин в квантовой механике, Гейзенберг приходит к важному принципиальному результату о невозможности одновременного точного измерения двух канонически сопряженных величин и устанавливает так называемое соотношение неопределенностей:
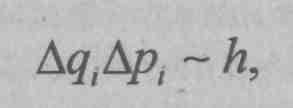
где ∆qi – точность измерения какой-либо из координат частицы; ∆рi, – точность одновременного измерения соответствующего импульса; h – постоянная Планка. Этот принцип является основой физической интерпретации квантовой механики, ее математического аппарата, играет большую эвристическую роль.
Второе направление в создании квантовой механики опиралась на идею Л. де Бройля о волновой природе материальных частиц. Особенно сильное влияние эти идеи оказали на Э. Шрёдингера, который увидел в них основу для создания волнового варианта теории квантовых процессов. В 1926 г. Шрёдингер, развивая идеи де Бройля, построил так называемую волновую механику, в основе которой представление о том, что квантовые процессы следует понимать как некие волновые процессы, характеризуемые волновой функцией ψ. Функция ψ определяется дифференциальным уравнением («уравнение Шрёдингера»).
Кроме того, Шрёдингер поставил вопрос о связи его теории с теорией Гейзенберга и показал, что при всем различии исходных физических положений они математически эквивалентны. Иначе говоря, в квантовой механике разница между полем и системой частиц исчезает. Например, электрон, вращающийся вокруг ядра, можно представить как волну, длина которой зависит от ее скорости. Там, где укладывается целое число длин волн электрона, волны складываются и образуют боровские разрешенные орбиты.
Возможности аппарата квантовой механики возросли, когда анализ спектров атомов привел к представлению о том, что электрону (и всем элементарным частицам) кроме заряда и массы присуща еще одна внутренняя характеристика — спин (собственный момент количества движения, имеющий квантовую природу). Представление о спине позволило В. Паули (1925) сформулировать принцип запрета (согласно которому в произвольной физической системе не может быть двух электронов, находящихся в одном и том же квантовом состоянии), который имел фундаментальное значение для построения теории атома, квантовой химии, теории твердого тела и др.
Вслед за основополагающими работами Шрёдингера по волновой механике были предприняты первые попытки релятивистского обобщения квантово-механических закономерностей, и уже в 1928 г. П. Дирак заложил основы релятивистской квантовой механики.
Параллельно со становлением квантовой механики открывались новые элементарные частицы. К открытию в конце XIX в. первой элементарной частицы — электрона — добавились открытия фотона (теоретически предсказан А. Эйнштейном, 1905, экспериментально обнаружен Р. Милликеном, 1915), протона (Э. Резерфорд, 1919), нейтрона (Дж. Чедвик, 1932), позитрона (К. Андерсон, 1932), мюонов (К. Андерсон и др., 1936); в 1930 г. В. Паули было предсказано существование нейтрино, — частицы, которая была экспериментально обнаружена лишь в 1953 г.
Проблема интерпретации квантовой механики. Принцип дополнительности. А. Эйнштейн и ряд физиков считали, что квантово-механическое описание физической реальности существенно неполно. Иначе говоря, созданная теория не является фундаментальной теорией, а лишь промежуточной ступенью по отношению к ней, поэтому квантовую механику необходимо дополнить принципиально новыми постулатами и понятиями, т.е. дорабатывать ту часть оснований новой теории, которая связана с ее принципами.
Другие физики (Н. Бор, В. Гейзенберг, М. Борн и др.) считали, что новая теория является фундаментальной и дает полное описание физической реальности. Завершение выработки этой интерпретации означало и завершение научной революции в физике, начавшейся в конце XIX в.
Основной отличительной особенностью экспериментальных исследований в области квантовой механики является фундаментальная роль взаимодействия между физическим объектом и измерительным устройством. Это связано с корпускулярно-волновым дуализмом. И свет, и частицы проявляют в различных условиях противоречивые свойства, в связи с чем о них возникают противоречивые представления.
Поэтому первая задача разрешается введением требования описывать поведение прибора на языке классической физики, а принципиально статистическое поведение микрочастиц – на языке квантово-механических формализмов. Вторая задача разрешается с помощью принципа дополнительности: волновое и корпускулярное описания микропроцессов не исключают и не заменяют, а взаимно дополняют друг друга. При одном представлении микрообъекта используется причинное описание соответствующих процессов, в другом случае – пространственно-временное. Единая картина объекта синтезирует эти два описания.
Квантовая механика — теоретическая основа современной химии
Основные представления и методы квантовой химии. Квантовая механика привела к созданию квантовой химии и таким образом выступила в качестве теоретического базиса современной химической картины мира. Атомов известно лишь немногим более 100 видов, т.е. столько, сколько химических элементов. А вот молекул – свыше 18 млн. Столь богатое разнообразие определяется двумя обстоятельствами. Во-первых, тем, что почти все виды атомов, взаимодействуя друг с другом, способны объединяться в молекулы. И, во-вторых, тем, что молекулы могут содержать разное число атомов.
Квантовая химия – это область современной химии, в которой принципы и понятия квантовой механики и статистической физики применяются к изучению атомов, молекул и других химических объектов и процессов. Основной метод квантовой химии состоит в применении уравнения Шрёдингера для атомов и молекул. При этом учитываются все виды энергии составляющих систему частиц (кинетическая, энергия взаимодействия атомных ядер и электронов, энергия взаимодействия с внешними полями).
Основные представления квантовой теории атома. Важным достижением квантовой механики явилось создание квантовой теории строения атома. Многочисленные эксперименты показали, что атомы (размер примерно 10-8 см) состоят из тяжелого, обладающего положительным электрическим зарядом ядра (примерно 10-13 см) и окружающих его отрицательно заряженных легких электронов (-е), образующих определенным образом расположенные оболочки атома. Важнейшая характеристика атома — заряд его ядра; она определяет принадлежность ядра тому или иному химическому элементу. Заряд ядра определяется количеством протонов (имеющих заряд +е) в нем.
Потеря одного или нескольких электронов превращает нейтральный атом в положительный ион, а приобретение электронов — в отрицательный ион. Масса атома определяется в основном массой его ядра, так как масса электрона почти в 2000 раз меньше массы протона (и нейтрона). Ядра с разным числом нейтронов, а значит и различным массовым числом, называются изотопами.
Являясь микрообъектом, атом подчиняется квантово-механическим закономерностям. Так, его полная энергия принимает лишь дискретные значения, изменяется скачкообразно в ходе квантового перехода из одного стационарного состояния в другое, поглощая или излучая квант света (фотон) определенной частоты (Еi — Еj= hv). Совокупность частот возможных переходов определяет спектры (поглощения и испускания) атома. В основном состоянии атом может находиться сколь угодно долго, обладая способностью поглощать фотоны.
Поглощение фотонов переводит его в возбужденное состояние, при котором он может или еще поглощать фотоны, или испускать их. Время жизни атома в возбужденном состоянии ограниченно. Так или иначе, но возбужденный атом — за очень короткое время — спонтанно испускает фотон и переходит на более низкий энергетический уровень, стремясь к основному состоянию.
В соответствии с этим принципом электроны заполняют электронные слои и оболочки строго определенным образом. Так, в первом, наиболее близком к ядру, слое может быть только два электрона; во втором и третьем — 8 (в оболочках — 2 и 6), в четвертом и пятом — 18 (в оболочках — 2, 6, 10), в шестом и седьмом — 32 (в оболочках — 2, 6, 10, 14).
Создание квантово-механической теории атома имело не только фундаментальное теоретическое, но и практическое значение. Во-первых, оно придало мощный импульс развитию атомной энергетики (высвобождению атомной энергии, созданию атомных электростанций и энергетических установок). Во-вторых, оно стало стимулом для работ по искусственному расширению человеком границ мира атомов.
Молекула как система атомов. Понятие химической связи и ее типы. Важная часть квантовой химии — теория молекулярного строения вещества. Как и атомы, молекулы — это квантовые системы.
Понятие о молекулярном строении вещества утвердилось в химии в середине XIX в. в связи с развитием термодинамики и теории газов, и окончательно было подтверждено экспериментами Ж.Б. Перрена, проводившимися над явлением броуновского движения (беспорядочного движения малых частиц, взвешенных в жидкости или газе, вызванного движением ударов молекул окружающей среды) в 1906 г. Эти эксперименты подтверждали теорию броуновского движения как флуктуаций давления окружающих молекул, разработанную в 1905—1906 гг. А. Эйнштейном и М. Смолуховским.
Молекулы как атомные системы характеризуются составом (из атомов каких элементов они состоят), молекулярной массой и структурной формулой, указывающей последовательность химических связей атомов. Некоторые молекулы, обладая одинаковым составом, тем не менее различаются расположением атомов, последовательностью химических связей. Такие молекулы называются изомерами и изображаются разными структурными формулами. Их химические свойства обычно также значительно разнятся. В любом случае расположение атомов в молекуле всегда симметрично.
Молекула — это сложная, находящаяся в постоянном движении квантовая система. Атомы входят в состав молекулы и в то же время совершают непрерывные колебательные движения. Причем в многоатомной молекуле колебания различных атомов зависят друг от друга, и каждое характеризуется своей частотой. Кроме того, сами молекулы как целое, например в газах, совершают еще и поступательные, и вращательные движения. В квантовой химии состояние молекулы как квантовой системы также описывается уравнением Шрёдингера. Решение этого уравнения обычно распадается на два уравнения — для электронов и для ядер.
Химическая связь — это та связь между атомами, которая приводит к образованию молекул. Для возникновения химической связи абсолютным является одно условие: образование молекулы из атомов возможно в том случае, когда внутренняя энергия молекулы оказывается ниже суммарной энергии этих атомов в изолированном состоянии.
Химическая связь устанавливается исключительно за счет электромагнитного взаимодействия электронов и ядер, входящих в молекулу атомов. Ионная связь образуется за счет переноса электронов с одного атома на другой и образования при этом положительных и отрицательных ионов, которые связываются друг с другом электростатически (например, NaCl). Ковалентная связь образуется в результате обобществления электронов (обычно электронных пар) соседними атомами; иначе говоря, электроны верхнего слоя двух (и большего количества) атомов становятся общими для этих атомов (например, в молекулах Н2, О2, СО и др.).
И, наконец, в металлах преобладает тип химической связи, который называется металлической связью. Она реализуется за счет большой концентрации в кристаллах свободных электронов («электронный газ»), которые удерживают положительные ионы на определенных расстояниях друг от друга, осуществляя коллективное взаимодействие атомов.
