
- •1 Вопрос
- •Вопрос 12:Фруктозо-1,6-дисфосфатный путь (гликолиз)
- •Вопрос 13: Окисление пирувата
- •Вопрос 15: Метаболизм-обмен веществ.
- •Катаболизм-распад,получение энергии Амфиболизм-промежуточный обмен Анаболизм-построение, затрата энергии
- •1) Эндоспоры
- •5) Формирование покровов споры и экзоспориума
- •2) Экзоспоры
- •3) Миксоспоры
- •4) Цисты
- •8. Основные типы брожения:
- •25. Круговорот углерода в мире микроорганизмов. Зависимость судьбы углерода от наличия кислорода в окружающей среде. Полное и неполные окисления. Автотрофы и гетеротрофы. Метаногены, метилотрофы
- •Превращение различных форм азота микроорганизмами. Аммонификация белков. Ассимиляционная и диссимиляционная нитратредукция. Аммонификация нитрата. Азотфиксация. Нитрификация.
- •27. Нитратное дыхание. Микроорганизмы, ведущие диссимиляционную нитратредукцию. Механизмы реакций и ферменты процесса нитратного дыхания. Условия процесса. Энергетические возможности процесса.
- •1 Окисление аммиака до нитрит-аниона
- •2 Окисление нитрит-аниона до нитрат-аниона
- •32. Симбиоз в мире микроорганизмов. Виды симбиоза. Примеры комменсализма, мутуализма, паразитизма. Облигатные и факультативные симбионты.
8. Основные типы брожения:
Спиртовое брожение: пировиноградная кислота в результате её окислительного декарбоксилирования образуется ацетальдегид , который становится конечным акцептором водорода . В итоге из 1 молекулы гексозы образуются 2 молекулы этилового спирта и молекулы углекислоты. Процесс получил название спиртового брожения.
Процесс спиртового брожения суммарно можно выразить следующим образом:
С 6Н12О6+
2Фн+2АДФ
2СН3-СН2ОН+2СО2+2АТФ+2Н2О.
6Н12О6+
2Фн+2АДФ
2СН3-СН2ОН+2СО2+2АТФ+2Н2О.
1 молекула глюкозы приводит к образованию 2 молекул АТФ.
Происходит межмолекулярное размежевание на восттановленные (этиловый спирт) и окисленные (СО2) молекулы.
Дрожжи:S.cerevisiae, Kloeckra. Sarcina venriculi, Zymomonas mobilis.
Молочное брожение:
Гомоферментативное молочнокислое брожение . Гомоферментативные молочнокислые бактерии образуют практически только одну молочную кислоту. Катаболизм глюкозы происходит у них по фруктозобисфосфатному пути, а водород , отщепляющийся при дегидрирование глицеральдегид-3-фосфата, передается на пируват. Лишь небольшая часть пирувата декарбоксилируется, превращаясь в уксусную кислоту, этанол и СО2, а также в ацетоин. Количество образующихся побочных продуктов зависит, по-видимому, от доступа кислорода.
С 6Н12О6 2СН3-СНОН-СООН
Streptococcus lactis, S. faecalis, L.lactis,S. cremoris, Pediococcus cerevisiae и т.д.
Гетероферментативное молочнокислое брожение. При гетероферментативном молочнокислом брожении образуется больше продуктов: молочная кислота, уксусная кислота, этанол, двуокись углерода. Тип брожения, в основе которого лежит гексозомонофосфатный путь сбраживания пентоз или гексоз с образованием в качестве акцепторов электронов пирувата и ацетилфосфата. Пируват восстанавливается до лактата (СН3-СНОН-СООН),а ацетилфосфат, в зависимости от активности энергетического метаболизма бактерий, у одних (род Lactobacillus) превращается а ацетат(СН3СООН) и СО2, а у других (род Leuconostoc) – через ацетил-КоА и ацетальдегид (СН3-СНО) восстанавливается в этанол(С2Н2ОН). Энергетический выход процесса при образовании этанола составляет одну молекулу АТФ на одну молекулу окисленной глюкозы, а при образовании ацетата-две молекулы АТФ.
Leuconostoc mesenteroides, Lactobacillus brevis и т.д.
Б рожение маслянокислое-тип брожения, осуществляемый «сахаролитическими» анаэробными клостридиями-Clostridium butyricum,C. Pasteurianum и другими , сбраживающими крахмал, целлюлозу и пектин по пути гликолиза с образованием пирувата (СН3-СО-СООН), который подвергается ферредоксинзависимому окислительному декарбоксилированию с образованием ацетил-КоА.Далее в реакции конденсации типа С2+С2 С4 из двух молекул ацетил-КоА формируется четырехуглеродный скелет-ацетоацетил-КоА. Дальнейшие превращения ацетоацетил-КоА сводятся к реакциям дегидратации, восстановления, декарбоксилирования и дезактивации . В результате этих реакций доминирующими продуктами брожения становятся бутират (СН3-СН2-СН2-СООН), ацетат (СН3-СООН), СО2 и Н2. Энергетический выход маслянокислого сбраживания глюкозы составляет три молекулы АТФ(две образуется на стадии гликолиза и одна на стадии регенерации ацетата).
Уксуснокислое брожение. Уксуснокислым брожением называется окисление этилового спирта в уксусную кислоту под влиянием уксуснокислых бактерий. Оно может быть выражено таким суммарным уравнением:
С2Н5ОН +О2= СН3СООН+ Н2О
Это брожение, как и спиртовое, известно с давних времен. Человек с давних пор наблюдал, что на поверхности вина или пива, оставленных в открытом сосуде, образуется сероватая пленка, а содержимое превращается в уксус. Микробиологическая природа этого процесса была впервые установлена в 1862 г. Пастером.
Возбудителями уксуснокислого брожения являются уксуснокислые бактерии, составляющие многочисленную группу палочковидных, бесспоровых, аэробных бактерий. Среди них встречаются подвижные и неподвижные формы. Различаются они также размерами клеток, разной устойчивостью к спирту и способностью накапливать больше или меньше уксусной кислоты.
Ruminococcus albus и т.д.
Основные продукты пропионовокислого брожения, вызываемого несколькими видами бактерий из рода Propionibacterium, — пропионовая (CH3CH2OH) и уксусная кислоты и CO2. Химизм пропионовокислого брожения сильно изменяется в зависимости от условий. Это, по-видимому, объясняется способностью пропионовых бактерий перестраивать обмен веществ, например, в зависимости от аэрации. При доступе кислорода они ведут окислительный процесс, а в его отсутствии расщепляют гексозы путём брожения. Пропионовые бактерии способны фиксировать CO2, при этом из пировиноградной кислоты и CO2 образуется щавелевоуксусная кислота, превращающаяся в янтарную кислоту, из которой декарбоксилированием образуется пропионовая кислота.
Основное энергетическое значение для пропионовокислых бактерий имеют так называемые ключевые реакции пропионовокислого брожения.
Под пропионовокислым брожением подразумевают биохимический процесс превращения бактериями сахара, молочную кислоту и ее солей в пропионовую кислоту. В этом брожении, кроме пропионовой кислоты, образуются и такие продукты, как уксусная кислота, углекислый газ, янтарная кислота, ацетоин, диацетил, другие летучие ароматические соединения - диметилсульфид, ацетальдегид, пропионовый альдегид, этанол и пропанол. Химизм данного брожения подобен типичному молочнокислому брожению с той разницей, что образовавшаяся молочная кислота в этом брожении не конечный продукт, а промежуточный. От других типов брожения пропионовокислое отличается высоким выходом АТФ, участием некоторых уникальных ферментов и реакций.
Propionibacterium freudenreichii
Муравьинокислое брожение, или смешанное брожение-тип брожения, вызываемый энтеробактериями и протекающий по пути гликолиза с образованием газов(Н2,СО2), кислот(ацетат, лактат, сукцинат, формиат) и нейтральных (ацетоин, этанол, 2,3 –бутандиол) продуктов , главным из которых выступает формиа(НСООН).1. Пируват подвергается расщеплению с образованием формиата и ацетил-КоА, который превращается в ацетат. Это позволяет энтеробактериям ассимилировать энергию в форме АТФ путем фосфорилирования АДФ на уровне субстрата. Энергетический выход процесса составляет три молекулы АТФ. 2. Ацетолактат превращается в ацетоин, который может восстановиться до 2,3-бутандиола , либо окисляться в диацетил. Этанол образуется из ацетил-КоА, а СО2 и Н2-из формиата.
К энтеробактериям относятся прдеставители филы Proteobacteria: Proteus, Serratia, Escherichia, Klebsiella.
Реакции и ферменты субстратного фосфорилирования.
Субстратное фосфорилирование =фосфатная группа + АДФ. Фосфат отщепляется от субстрата.
1,3- фосфоглицераткиназа, Фосфоенолпируваткиназа, Ацетилфосфаткиназа, Бутирилфосфаткиназа
Окислительная и восстановительная фазы брожения.
Собственно энергетической стороной процессов брожения является их окислительная часть, поскольку реакции, ведущие к выделению энергии, — это реакции окисления.
При брожениях конечными акцепторами электронов служат в основном органические соединения: метаболиты, образующиеся из исходных субстратов(ПВК, ацетальдегид.
Восстановленные соединения, акцептировашие электроны, выделяются из клеток в окружающую среду и накапливаются в незначительных количествах. Брожение-способ получения энергии , при котором АТФ образуется в процессе анаэробного окисления органических субстратов в реакциях субстратного фосфорилирования.
Вопрос Брожение как механизм получения энергии в анаэробных условиях. Промышленно важные типы брожения и микроорганизмы, их ведущие. Спиртовое брожение с помощью эу- и прокариот.
Броже́ние - это метаболический процесс, при котором регенерируется АТФ, а продукты расщепления органического субстрата могут служить одновременно и донорами, и акцепторами водорода. Брожение — это анаэробный метаболический распад молекул питательных веществ, например глюкозы
В результате окислит.-восстановит. р-ций при брожении освобождается энергия (гл. обр. в виде АТФ) и образуются соед., необходимые для жизнедеятельности организма. Нек-рые бактерии, микроскопич. грибы и простейшие растут, используя только ту энергию, к-рая освобождается при брожении. Общий промежут. продукт у мн. видов брожения - пировиноградная к-та СН3С(О)СООН, образование к-рой из углеводов в большинстве случаев протекает таким же путем, как в гликолизе. Нек-рые виды брожения, происходящие анаэробно под действием микроорганизмов, имеют важное практич. значение
Спиртовое брожение:
дрожжами. Сбраживание глюкозы до этанола и СО2 дрожжами(Saccharomyces cerevisiae) осуществляется по фруктозодифосфатному пути. Превращение пирувата в этанол происходит в два этапа. Сначала пируват декарбоксилируется пируватдекарбоксилазой при участии тиаминпирофосфата до ацетальдегида, а затем ацетальдегид восстанавливается алкогольдегидрогеназой в этанол при участии NADH2.Переносится при этом водород, образующийся при дегидрировании триозофосфата; окислительно-восстановительный баланс, таким образом, сохраняется.
Бактериями.Из пульке - бродящего сока агавы (Agave mexicana) в Мексике была выделена палочковидная подвижная бактерия с полярными жгутиками, образующая этанол. Эта бактерия Zymomonas mobilis разлагает глюкозу по 2-кето-3-дезокси-6-фосфоглюконатному пути и расщепляет пируват с помощью пируватдекарбоксилазы на ацетальдегид и двуокись углерода. Ацетальдегид восстанавливается до этанола. Единственными продуктами этого брожения являются этанол, СО2 и небольшие количества молочной кислоты.
Молочнокислое брожение
Процесс превращения глюкозы до пировиноградной кислоты у гомоферментатавных молочнокислых бактерий протекает как и у дрожей при спиртовом брожении. Далее ввиду отсутствия у этих бактерий пируватдекарбоксилазы, пировиноградная кислота не подвергается расщеплению, она является в этом брожении конечным акцептором водорода. Пировиноградная кислота вступает во взаимодействие с восстановленным НАД Н2 (кофермент) - образуется молочная кислота. -.. СНзСОСООН + НАД Н2- СНзСНОНСООН Превращение глюкозы гетероферментативными бактериями происходит по-иному. Отсутствие у них фермента адьдолазы меняет начальный путь превращения глюкозы. После фосфорилирования гексоза окисляется (отщепляется водород) и декарбоксилируется (отщепляется углекислый газ), превращаясь в пентозофосфат. Пентозофосфат при участии фермента фосфокеталазы расщепляется на фосфоглицериновый альдегид. Фосфорглицериновый альдегид превращается в пировиноградную кислоту, которая восстанавливается в молочную. Гексоза ----пентофасфат----фосфоглицери новый альдегид----пируват---молочная кислота
Молочнокислый стрептококк ( Streptococcus lactis
Ацидофильная палочка (Lactobact. Acidophilus
. Сливочный стрептококк (Str. Cremoris)
Пропионовокислое брожение идет под действием пропио-новокислых бактерий: где SKoA-остаток кофермента A (KoASH), ФАДН и ФАД - соотв. восстановленная и окисленная формы флавинадениндинуклеотида, ~ высокоэргич. связь. Синтез пропионил-КоА катализируется метилмалонил-КоА-карбоксилтрансферазой (кофермент - биотин), а пропионовой к-ты -транстиоэстеразой. Образующийся сукцинил-КоА под действием L-метилмалонил-КоА-мутазы (кофермент - витамин В12) превращается в метилмалонил - КоА, к-рый снова вовлекается в процесс. Параллельно с основными р-циями под действием пируватдегидрогеназы происходит окислит. декарбоксилирование пировиноградной к-ты: Пропионовокислое брожение используется в молочной пром-сти при изготовлении мн. твердых сыров
Маслянокислое брожение - это процесс превращения сахара маслянокислыми бактериями в анаэробных условиях с образованием масляной кислоты, углекислого газа и водорода. . С Н О - СН СН СН СООН +2СО2 + 2Н Кроме основных продуктов брожения получаются и побочные продукты - бутиловый спирт, ацетон, этиловый спирт. Как и при спиртовом брожении маслянокислое брожение претерпевает те же превращения до образования пировиноградной кислоты. Затем пировиноградная кислота декарбоксилируется с образованием углекислого газа и уксусного альдегида. Далее в отличии от спиртовового брожения под действием фермента карболигазы уксусный альдегид конденсируется и из 2 молекул уксусного альдегида образуется - ацетальдоль СН СНОНСН СНО - СН СН СН СООН Возбудители брожения- маслянокислые бактерии относятся к роду Clostridium семейству Bacillaceae
22 вопрос)Механизмы окисления гексоз при брожении. Окислительная фаза и получение энергии при брожении. Восстановительная фаза и получение конечных продуктов брожения. Гомоферментативное и гетероферментативное молочнокислое брожение. Его роль в промышленности и сельском хозяйстве.
Брожение - ферментативный метаболический процесс превращения органических соединений в отсутствии кислорода, в котором синтезируется АТФ, а продукты расщепления органического субстрата служат одновременно донорами и акцепторами водорода. Реакции, приводящие к фосфорилированию АДФ, являются реакциями окисления. От окисленного углерода клетка избавляется, выделяя СО2. Отдельные этапы окисления представляют собой дегидрирование, при котором водород переносится на NAD. Акцепторами водорода, находящегося в составе NADH2, служат промежуточные продукты расщепления субстрата. При регенерации NAD последние восстанавливаются, а продукты восстановления выводятся из клетки. При брожении образуются такие продукты, как этанол, лактат, пропионат, формиат, бутират, сукцинат, капронат, ацетат, н-бутанол, 2,3-бутандиол, ацетон, 2-пропанол, СО2, Н2.
Энергетическими ресурсами для бактерий, осуществляющих брожения, в большинстве случаев служат моносахара (в первую очередь, глюкоза) и дисахара (мальтоза, лактоза). В процессе подготовки к энергетическим преобразованиям дисахара ферментативным путем расщепляются до моносахаров. Различные моносахара, прежде чем подвергнуться преобразованиям, должны превратиться в глюкозо-6-фосфат. Момент унификации, т. е. превращения различных субстратов в один, исходный для дальнейшего его метаболизирования по данному пути, очень важен. От того, что служит исходным энергетическим ресурсом, зависит общий энергетический баланс процесса. Несколько путей ведут от глюкозы к С3-соединениям и среди них к пирувату - одному из важнейших промежуточных продуктов метаболизма. Чаще других используется путь распада через образование фруктозо-1,6-бисфосфата; его называют фруктозобисфосфатным путем, гликолитическим расщеплением, гликолизом или (по имени изучивших его исследователей) путем Эмбдена - Мейергофа - Парнаса. Другой ряд реакций, к осуществлению которых способно большинство организмов, образует цикл, известный под названием окислительного пентозофосфатного пути, гексозомонофосфатного пути или схемы Варбурга-Диккенда-Хореккера. Обратная последовательность реакций этого пути включает важные этапы, ведущие к регенерации акцептора С02 при автотрофной фиксации углекислоты. Только у бактерий встречается, видимо, путь Энтнера - Дудорова, или, как его еще называют, КДФГ-путь (по характерному промежуточному продукту-2-кето-3-дезокси-6-фосфоглюконату, КДФГ). Другие сходные механизмы распада гексоз имеют более специальное значение.
Глюкоза в клетке сначала фосфорилируется обычно в положении 6 при участии гексокиназы как катализатора и АТФ как донора фосфата. Глюкозо-6-фосфат представляет собой метаболически активную форму глюкозы в клетке и служит исходным пунктом для любого из трех упомянутых путей распада.
В зависимости от того, какие продукты образуются при сбраживании глюкозы – только молочная кислота (лактат) или также другие органические продукты и CO2, - молочнокислые бактерии принято подразделять на гомоферментативные и гетероферментативные. Это деление отражает коренные различия в путях катаболизма сахаров. Гомоферментативное молочнокислое брожение. Гомоферментативные молочнокислые бактерии образуют практически одну только молочную кислоту (она составляет не менее 90% всех продуктов брожения). Катаболизм глюкозы происходит у них по фруктозобисфосфатному пути (бактерии обладают всеми необходимыми для этого ферментами, включая альдолазу), а водород, отцепляющийся при дегидрировании глицеральдегид-3-фосфата, передается на пируват. Молочная кислота образуется непосредственно из пировиноградной в НАД-зависимой реакции, катализируемой лактатдегидрогеназой.
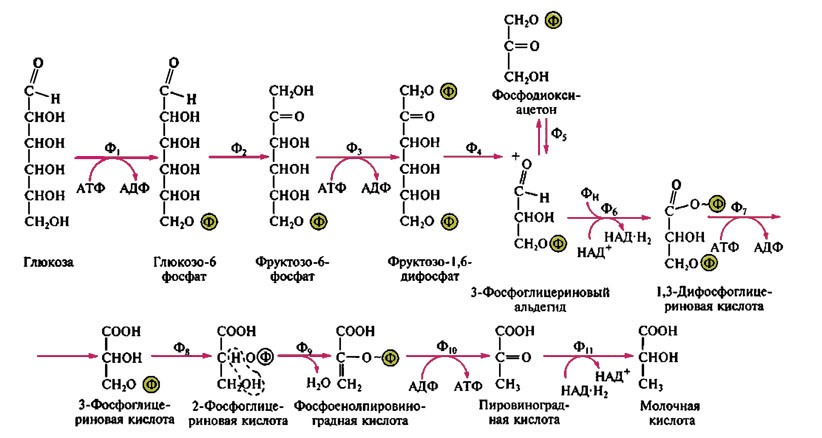
Гомоферментативное молочнокислое брожение: Ф1 — гексокиназа; Ф2 — глюкозофосфатизомераза; Ф3 — фофсофруктокиназа; Ф4 — фруктозо-1,6-дифосфатальдолаза; Ф5 — триозофосфатизомераза; Ф6 — 3-ФГА-дегидрогеназа; Ф7 — фофсоглицерокиназа; Ф8 — фосфоглицеромутаза; Ф9 — енолаза; Ф10 — пируваткиназа; Ф11 — лактатдегиброгеназа.
Собственно гликолиз — это определенная последовательность ферментативных реакций от углевода до пировиноградной кислоты, поэтому, строго говоря, "гликолиз" не является синонимом "гомоферментативного молочнокислого брожения", но 10 из 11 реакций у этих процессов идентичны.
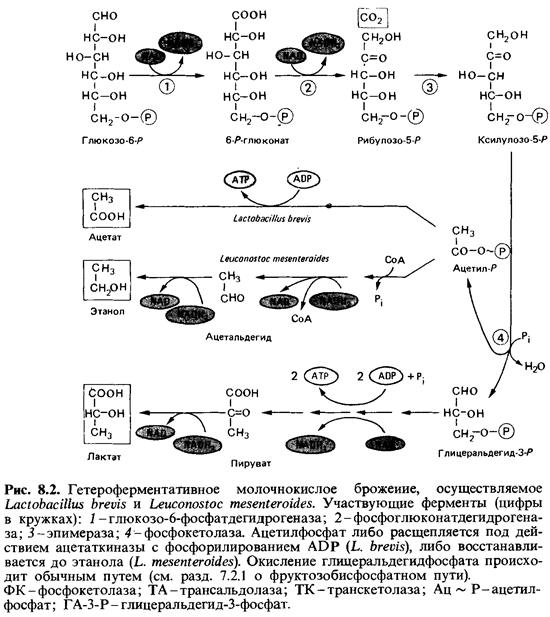
Гетероферментативное молочнокислое брожение.
К гетероферментативным молочнокислым бактериям, сбраживающим сахара с образованием молочной кислоты, CO2, этанола и/или уксусной кислоты, относятся представители рода Leuconostoc и бактерии, объединенные в подрод Betabacterium рода Lactobacillus (L. fermentum, L. brevis). У них отсутствует ключевой фермент гликолитического пути — фруктозодифосфатальдолаза, и поэтому сбраживание субстратов они могут осуществлять только по окислительному пентозофосфатному пути, т. е. являются облигатно гетероферментативными формами. Кроме того, представители подрода Streptobacterium (L. casei, L. plantarum, L. xylosis) этого же рода сбраживают гексозы по гликолитическому пути, а пентозы по окислительному пентозофосфатному пути, осуществляя в первом случае гомоферментативное, а во втором — гетероферментативное молочнокислое брожение.
Начальное превращение глюкозы при гетероферментативном молочнокислом брожении идет исключительно по пентозофосфатному пути, т.е. через глюкозо-6-фосфат, 6-фосфоглюконат и рибулозо-5-фосфат. Рибулозо-5-фосфат под действием эпимеразы превращается в ксилулозо-5-фосфат, который в результате тиаминпирофосфат-зависимой реакции, катализируемой пентозофосфокетолазой, расщепляется с образованием глицеральдегидфосфата и ацетилфосфата. Бактерии переводят ацетилфосфат частично или целиком в уксусную кислоту, что сопровождается переносом высокоэнергетической фосфатной связи на АДФ с образованием АТФ. Избыток водорода передается в этом случае глюкозе, на которой образуется маннитол. Глицеральдегидфосфат через пируват превращается в лактат.
При гетероферментативном брожении могут образовываться молочная кислота, уксусная кислота, этиловый спирт и CO2, а также небольшое количество ароматических. веществ -диацетил, эфиры и т.д.
Молочнокислые бактерии служат для приготовления силоса, кислой капусты, молочнокислых продуктов, чистой молочной кислоты.
Молочный продукт |
Культуры, входящие в состав закваски |
Температура и длительность инкубации |
Сметана |
Streptococccus lactis, S. Cremoris, Leuconostoc cremoris, S. diacetilactis |
22ºC, 18 ч |
Йогурт |
S. thermophilus, Lactobacillus bulgaricus |
45ºС, 3 ч |
Биогурт |
S. lactis, S. cremoris, L. acidophilus |
37ºС, 24 ч |
Кефир |
Streptococcus, Lactobacillus, дрожжи |
До 22ºС, до 36 ч |
Творог |
S. lactis, S. cremoris, Leuconostoc cremoris |
32ºС, 18 ч 35ºС, 5 ч |
23 вопрос: В настоящее время процессы брожения используют почти во всех сферах жизнедеятельности: в сельском хозяйстве, в молочной промышленности, в производстве вина, спирта, пива, а также в производстве хлебобулочных изделий.
Молочное брожение:Lactobacillaceae: Аэротолерантные, метаболические «инвалиды», так как к ним добавляют тиамин, пурины, пиримидины, дрожжевые экстракты (дополнительные питательные вещества). Встречаются в желудочно-кишечном тракте, в молочно-кислых продуктах, на растениях. В сельском хозяйстве используются молочнокислые бактерии для приготовления силоса (происходит молочнокислое брожение).
Для приготовления различных молочных продуктов (кефир, йогурт, биогурт, используют молочнокислые бактерии). Кефир принадлежит к молочнокислым продуктам, содержащим кислоты и этанол; его получают из молока (закваску готовят на кефирных зернах, которые состоят из лактобацилл, дрожжей, стрептококк). Йогурт получают из пастеризованного гомогенезированного цельного молока. Биогурт - кислое молоко, сквашенное L.acidophilus
Стерилизованное и пастеризованное молоко или сливки сбраживают, прибавляя в качестве закваски чистые культуры молочнокислых бактерий. Кисломолочное масло готовят из сливок, сквашенных с помощью Streptococcus lactis и др. Для приготовления молочнокислых продуктов в качестве заквасок также используются стартовые культуры молочнокислых бактерий, образующих кислоту и придающие определенный запах.
Молочнокислые бактерии (различные лактобациллы и стрептококки) ведут как уже отмечалось молочнокислое брожение. Молочнокислые бактерии способны размножаться ускоренно, вытесняя другие МКО. Поэтому их достаточно легко культивировать на элективных средах и легко выделять.
Пекарские дрожжи (Saccharomyces cerevisiae) также участвуют в процессе брожения, поднимая тесто в результате образования СО2. Их выращивают в чанах при сильной аэрации. В качестве побочного продукта образуется этанол.
-
Молочный продукт
Культура МКО
Температура, время
Сметана
Streptococcus lactis, S. Cremoris, S.diacetibaetis
22ОС, 18 ч
Йогурт
S. thermophitus, Leuconostoe bulgaricus
45ОС, 3 ч
Биойогурт
S. lactis,S. cremoris, L. acidophilus
37ОС, 24 ч
Кефир
S. lactis, дрожжи
22ОС, 36 ч
творог
S. lactis, S.cremoris, L.cremoris
32ОС,18 ч 35ОС, 5ч
Для получения спирта путем брожения используют сахара и картофель. Большое количество дешевого спирта получают из отходов бумажных фабрик и гидрализатов древесины лиственных пород. Например, kloeckra – винные дрожжи, которые применяются для производства немецких вин.
Многие немецкие вина получают в результате спонтанного брожения виноградного сока. Для подавления неконтролируемого брожения, которое вызывается дикими дрожжами, вносят чистые культуры дрожжей, которые подбираются в специальных районах. Важное значение имеет сорт винограда, условия его произрастания и тд
Ацетонобутиловое брожение – тип брожения, который осуществляется некоторыми представителями рода Clostridium с образование целой серии конечных продуктов - ацетата, ацетона, бутанола, бутирата, изопропанола, этанола, СО2, Н2. Ацетонобутиловое брожение имеет двухфазный характер и основано на катаболизме сахаров по пути гликолиза до образования пирувата, который подвергается ферредоксинзависимому декарбоксилированию с образование ацетил-СоА. В первую фазу сбраживания глюкозы часть ацетил-КоА расходуется на образование кислот – ацетата и бутирата, что сопровождается синтезом АТФ в реакции фосфорилирования АДФ на уровне субстрата и увеличением общей кислотности среды. Это угнетает развитие клостридиев. Во вторую фазу, не связанную с синтезом АТФ, другая часть ацетил-КоА превращается в нейтральные продукты (бутанол, этанол) следствием чего является благоприятное для бактерий защелачивание окружающей среды.
Производство масляной кислоты. Типичными представителями клостридиев, осуществляющих маслянокислое брожение, являются С. butyricum и С. pasteurianum. Они сбраживают сахара с образованием масляной и уксусной кислот, СО2 и Н2. Для маслянокислого брожения четко показана его зависимость от рН среды. . Маслянокислое брожение в производственных условиях может вестись на разных углеводсодержащих средах. Обычно используют среды, содержащие кукурузную, пшеничную или ржаную муку, также применяют некоторые другие дешевые вещества. Сбраживаемые углеводы не подвергают предварительному осахариванию. Поэтому содержащие их среды именуются заторами (в отличие от сусла – осахаренной среды спиртового брожения). Для выращивания чистой культуры С. butyricum пользуются запасом спор бактерии, заготовляемым обычно на шестимесячный (и более) период работы завода. Заготовку спор проводят на 6%-ном заторе кукурузной или ржаной муки путем массового высева. Для этого около 100 пробирок со свежим стерильным затором засевают культурой бактерии и весь цикл брожения, заканчивающийся образованием спор, проводят при 37°С.
Производство уксусной кислоты. При биохимическом производство уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта. Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
СН3СН2ОН + О2 → СН3СООН + Н2О
Некоторые роды анаэробных бактерий близки к клостридиям по продуктам брожения: они, однако, не образуют спор и близки к грам- формам. Большинство таких бактерий образующих масляную уксусную кислоты, было выделено из рубца, где они участвуют в разложении целлюлозы, крахмала и других углеводов.
24 вопрос. Техника исследования микроорганизмов. Типы микроскопии. Развитие методов окрашивания и совершенствование красителей. Выделение и поддержание чистых культур . Методы исследования генетического материала и белков микроорганизмов. Фракционирование, гибридизация, электрофорез. Полимеразная цепная реакция. Микрочипы.
Техника исследования микроорганизмов.
Микробиологическая техника, совокупность методов и аппаратуры для изучения микроорганизмов в лабораторных условиях. Специфика микроорганизмов, обусловленная их малыми размерами, особенностями морфологии и физиологии, потребовала разработки методов их обнаружения, идентификации, выделения, выращивания, подсчёта и описания. Основы М. т. были заложены во второй половине 19 в. работами Л. Пастера, Р. Коха, С. Н. Виноградского, М. Бейеринка и др.
Для изучения морфологии микроорганизмов, их подвижности, характера размножения и строения пользуются различными видами микроскопии. Получение фиксированных и окрашенных препаратов микроорганизмов, а также избирательные методы окраски их спор или внутриклеточных структур — ядра, клеточной стенки, жгутиков, различных включений (метахроматические гранулы, липиды и др.), помогают идентифицировать микроорганизмы, изучить их состав и строение. Для исследования антигенных, физиологических и биохимических свойств микробов, их патогенности, вирулентности, наследственной изменчивости применяют различные методы иммунологического, физико-химического, биохимического и генетического анализов.
Разработаны ускоренные методы обнаружения микробов во внешней среде, в выделениях инфекционных больных, а также методы индикации их в исследуемом материале. Большое значение приобрёл люминесцентно-серологический метод, который заключается в обработке препарата с исходным материалом флуоресцирующими иммуноглобулинами. Последние, адсорбируясь соответствующими микробами, обусловливают их свечение при рассматривании в люминесцентный микроскоп.
Типы микроскопии.
Микроскопия- совокупность методов изучения микроскопических объектов с помощью микроскопа.
Микроскоп-оптический прибор, используемый для обнаружения и изучения микроорганизмов. Позволяет получить увеличенное изображение объекта в сотни раз (световой микроскоп) и в десятки –сотни тысяч раз (электронный микроскоп).
Световой (оптический) микроскоп:
Световой микроскоп – это оптический прибор, позволяющий получить увеличенное изображение трудноразличимых невооруженным глазом или вообще невидимых объектов (либо деталей их структуры). В общем случае микроскоп состоит из штатива, предметного столика и подвижного тубуса с окуляром и объективом. Современные приборы оснащаются также специальной осветительной системой.
Максимальное увеличение: в 1500-2000раз. Разрешающая способность:0,2 мкм. Длина световой волны: 0,4-0,7 мкм. Используется видимый свет.
Ультрафиолетовая микроскопия: пропускает ультрафиолет –свет с короткой длиной волны.
-распределение веществ в клетке.
-кварцевая оптика используется(ртутная дуга-источник ульрафиолетового излучения).
Фазово-контрастная микроскопия: для микроскопии неокрашенных препаратов, делает их видимыми. Превращает в амплитудные изменения, которые уже различимы. Не увеличивает разрешающую способность.
Темнопольная микроскопия: на темном фоне видимы белые неокрашенные объекты. Рассеивание света микроскопическими объектами. В том числе объекты меньше разреш. Способность светового микроскопа. В объектив попадают только лучи света, рассеинными объектом при боковом освещении. Прямые лучи от осветителя в объектив не попадают. Можно увидеть даже крупные вирусы.
Флюоресцентный (люминесцентный) микроскоп: некоторые вещества способны светить при поглощении энергии света.
Правило Стокса:
-цвет люминесценции смещен в более длинноволновую часть спектра по сравнению с возбуждающим её светом.
Первичная флюоресценция –собственная флюоресценция , вещества ей присущее. Вторичная- это когда, например, добавляют флуофоры.
Трансмисионный (просвечивающий) микроскоп: электроны проникают сквозь образец.
Сканирующий(растровый): пучок электронов , сканируют образец.
Атомно-силовая микроскопия: один из видов сканирующего микроскопа. Вандервальские взаимодействия зонд с поверхностью образца. Зонд(игла, шип). Шип крепится к кантилеверу. Кантилевер скользит по поверхности образца и сканирует его. На кантилевере есть зеркальная площадка, и от этого идет зеркальные отражения. Луч лазера отклоняется (регистрирует фотодетектор). Иголка в каждый момент времени сталкивается с образцом ( с атомами образца). В результате можно построить трёхмерное изображение.
Развитие методов окрашивания и совершенствование красителей.
Для окрашивания бактерий чаще используют основные красители: метиловый синий, кристаллический фиолетовый, основной фуксин, тионин. Широко используют щелочной раствор метиленового синего — краситель Леффлера, позволяющий выявить многие детали формы и структуры микробов.
Однако для выявления спор, капсул, жгутиков, различных структур и органелл, а также сходных по форме бактерий использование для окрашивания только одного красителя (простой способ окраски) бывает недостаточно. Поэтому существуют сложные, специальные методы окрашивания, удовлетворяющие различным требованиям.
Способ окраски по Граму позволяет дифференцировать сходные по форме и размерам бактерии, относящиеся к разным видам и родам. Мазок, приготовленный из исследуемого материала, окрашивают вначале кристаллическим фиолетовым в течение 1—2 мин, а затем раствором Люголя 1—2 мин. Все микроорганизмы, находящиеся в мазке, приобретают темно-фиолетовый цвет.
После этого мазок обрабатывают 96 % этиловым спиртом в течение 30 с— 1 мин, смывая остатки спирта водой. Под влиянием спирта одни бактерии обесцвечиваются, а другие сохраняют фиолетовую окраску, приданную Им комплексом красителя с йодом. Те виды микробов, которые сохраняют фиолетовую окраску, называют грамположительными, а обесцвечивающиеся — грамотрицательными.
Приготовление окрашенного препарата состоит из следующих этапов: приготовление мазка, его высушивание, фиксация и окраска. Для приготовления мазка на середину чистого предметного стекла наносят небольшую каплю воды и с помощью бактериальной петли помещают в нее исследуемый материал. Материал равномерно распределяют на стекле таким образом, чтобы образовался тонкий мазок круглой или овальной формы размером 1-2 см2. Затем препарат высушивают либо при комнатной температуре на воздухе, либо в струе теплого воздуха высоко над пламенем горелки. Высушенный мазок подвергают фиксации, вследствие чего он прикрепляется к стеклу (фиксируется), микробы инактивируются и становятся безопасными, возрастает их восприимчивость к окраске. Применяют различные способы фиксации. Наиболее простым и самым распространенным способом является фиксация жаром - нагреванием на пламени горелки (препарат несколько раз проводят через наиболее горячую часть пламени горелки). В нек-рых случаях прибегают к фиксации препарата этиловым или метиловым спиртом, ацетоном, смесью равных объемов этилового спирта и эфира (по Никифорову). После фиксации производят окраску мазка. Наиболее пригодными для окраски микробов являются основные и нейтральные анилиновые красители. Окрашенный препарат промывают водой и высушивают. На высушенный мазок наносят каплю иммерсионного масла и микроскопируют, пользуясь иммерсионной системой микроскопа.
Выделение и поддержание чистых культур .
Чистая культура - масса клеток, состоящая из микроорганизмов, принадлежащих одному виду и полученных как потомство одной клетки. Чистую культуру обычно получают путем пересева на стерильную питательную среду клеток, взятых из отдельно стоящей колонии бактерий.
Выделение отдельных видов бактерий (чистой культуры) из исследуемого материала, содержащего, как правило, смесь различных микроорганизмов, является одним из этапов любого бактериологического исследования. Чистой культурой микробов получают из изолированной микробной колонии.
Этапы выделения чистой культуры бактерий
I этап (нативный материал)
Микроскопия (ориентировочное представление о микрофлоре).
Посев на плотные питательные среды (получение колоний).
II этап (изолированные колонии)
Изучение колоний (культуральные свойства бактерий).
Микроскопическое изучение микробов в окрашенном мазке
(морфологические свойства бактерий).
Посев на скошенный питательный агар для выделения чистой культуры.
III этап (чистая культура)
Определение культуральных, морфологических, биохимических
и других свойств для идентификации культуры бактерий.
* Метод Пастера - последовательное разведение исследуемого материала в жидкой питательной среде до концентрации одной клетки в объеме.
Метод Коха («пластинчатые разводки») - последовательное разведение исследуемого материала в расплавленном агаре (температура 48-50 ° С), с последующим разливом в чашки Петри, где агар застывает.
* Метод Шукевича - применяется для получения чистой культуры протея и других микроорганизмов обладающих «ползущим» ростом.
Метод Дригальского - широко применяется в бактериологической практике, при этом исследуемый материал разводят в пробирке стерильным физиологическим раствором или бульоном.
Для длительного поддержания культуры микрооганизмов ее периодически пересевают на свежую питательную среду или замораживают и высушивают под вакуумом (лиофилизируют).
Методы исследования генетического материала и белков микроорганизмов.
С начала 40-х гг. микроорганизмы становятся объектом интенсивных генетических исследований. Именно на них были решены многие кардинальные вопросы современные генетики. Так, первое указание на то, что материальным носителем наследственности служит дезоксирибонуклеиновая кислота (ДНК), было получено в опытах на пневмококках (американские генетики О. Т. Эйвери, К. Мак-Леод и М. Маккарти).
Примерно в то же время были начаты интенсивные генетические исследования на хлебной плесени — нейроспоре. Изучение многочисленных биохимических мутантов нейроспоры (Дж. У. Бидл и Э. Л. Тейтем, США) привело к установлению очень важного положения: "один ген — один фермент" (ныне это положение более точно формулируется так: "один ген — одна полипептидная цепь"). Генетические исследования микроорганизмов особенно интенсивно стали развиваться после того, как американские генетики С. Лурия М. Дельбрюк показали на кишечной палочке (Escherichia coli), что и бактерии подчиняются мутационным закономерностям.
В 1946 был открыт половой процесс у бактерий (конъюгация), что позволило применить для их исследования генетический анализ. В результате установлены наличие у бактерий рекомбинации, существование у них генетических групп сцепления и построены генетические карты их хромосом.
Вскоре в генетические исследования были вовлечены бактериофаги и др. вирусы (в частности, вирус табачной мозаики — ВТМ). Был открыт эффект переноса генетической информации от одной бактериальной клетки к другой при посредстве бактериофага — генетической трансдукция, что положило начало изучению генетических взаимоотношений в системе "фаг — бактерия" (Дж. Ледерберг, Н. Зиндер, США). Вслед за тем была обнаружена рекомбинация у фагов (А. Херши и М. Дельбрюк, США). Если использование бактерий в качестве объекта генетических исследований резко повысило разрешающую способность генетическиого анализа, то благодаря фагам удалось перейти к изучению явлений наследственности на молекулярном уровне.
Методом, нашедшим широкое применение в исследованиях по таксономии и характеристике штаммов микроорганизмов, является электрофорез экстрактов общего белка клетки, который используется также в целях ускоренной идентификации микроорганизмов. Результатом экспрессии генома микроорганизма является продуцирование в клетке более чем 2000 белковых молекул. Эти белки легко экстрагируются кипячением и подвергаются одномерному электрофорезу в геле.
Многочисленные проекты по полному секвенированию геномов позволяют идентифицировать большинство генов в различных организмах. Для примерно 50% процентов белков можно сделать предположения об их функции путем сравнения аминокислотной последовательности с ранее характеризованными белками.
Фракционирование, гибридизация, электрофорез.
Гибридизация-1. Отжиг в реакции ПЦР двух полинуклеотидных цепей, часто из разных источников , с образованием ДНК/РНК- или ДНК/ДНК-гибридов , стабилизируемых водородными связями; 2. Процесс , в результате которого две комплементарные одноцепочечные нити ДНК образуют стабильную двуцепочечную спираль. Используется для выявления специфических нуклеотидных последовательностей в молекуле ДНК.
Электрофорез-метод разделения заряженных молекул(ДНК, РНК или белки), основанный на разной скорости их перемещения в электрическом поле.
Фракционирование- (ректификация), разделение смеси веществ посредством КРИСТАЛЛИЗАЦИИ (фракционная кристаллизация) или дистилляции (фракционная дистилляция). При фракционной кристаллизации смесь растворяется в горячем растворителе. При фракционной дистилляции жидкая смесь кипит, а пар направляют по длинному вертикальному конденсатору, называемому РЕКТИФИКАЦИОННОЙ КОЛОННОЙ. Компоненты смеси с самой низкой точкой кипения (наиболее летучие) поднимаются вверх, а менее летучие остаются внизу.
Полимеразная цепная реакция.
ПЦР - это метод, который позволяет найти в исследуемом клиническом материале небольшой участок генетической информации любого организма среди огромного количества других участков и многократно размножить его. Метод ПЦР основан на принципе естественной репликации ДНК. Включающем расплетение двойной спирали ДНК, расхождение нитей ДНК и комплиментарное дополнение обеих. Репликация ДНК может начаться не в любой точке, а только в определенных стартовых блоках - коротких двунитевых участках. Суть метода заключается в том, что маркировав такими блоками специфический только для данного вида (но не для других видов) участок ДНК, можно многократно воспроизвести (амплифицировать) именно этот участок.
Микрочипы.
Наиболее широкое применение нашли микрочипы, изготовленные на твердой поверхности. В качестве подложки используют стекло, пластик, металл, мембрана и т.п. На этой подложке могут быть иммобилизованы различные биологические макромолекулы, в первую очередь ДНК, а также РНК или белки. По устоявшейся терминологии, иммобилизуемые молекулы принято называть зондами, а те молекулы, которые находятся в исследуемом образце и подвергаются анализу, – мишенями. Как правило, зонды наносят на поверхность микрочипа в определенной последовательности; таким образом, микрочип представляет собой упорядоченную матрицу, в которой каждый элемент заранее задан и определен. В процессе гибридизации происходит специфическое взаимодействие молекул-зондов и молекулы-мишени по принципу комплементарности, а для того чтобы выявлять стабильные гибридизационные структуры и определить, с каким зондом произошло взаимодействие, молекулы-мишени предварительно метят флюоресцентным красителем. Таким образом, картина гибридизации представляет собой картину распределения флюоресцентных сигналов, наиболее ярких в точках специфического связывания зонда и мишени.
