- •1 Вопрос
- •Вопрос 12:Фруктозо-1,6-дисфосфатный путь (гликолиз)
- •Вопрос 13: Окисление пирувата
- •Вопрос 15: Метаболизм-обмен веществ.
- •Катаболизм-распад,получение энергии Амфиболизм-промежуточный обмен Анаболизм-построение, затрата энергии
- •1) Эндоспоры
- •5) Формирование покровов споры и экзоспориума
- •2) Экзоспоры
- •3) Миксоспоры
- •4) Цисты
- •8. Основные типы брожения:
- •25. Круговорот углерода в мире микроорганизмов. Зависимость судьбы углерода от наличия кислорода в окружающей среде. Полное и неполные окисления. Автотрофы и гетеротрофы. Метаногены, метилотрофы
- •Превращение различных форм азота микроорганизмами. Аммонификация белков. Ассимиляционная и диссимиляционная нитратредукция. Аммонификация нитрата. Азотфиксация. Нитрификация.
- •27. Нитратное дыхание. Микроорганизмы, ведущие диссимиляционную нитратредукцию. Механизмы реакций и ферменты процесса нитратного дыхания. Условия процесса. Энергетические возможности процесса.
- •1 Окисление аммиака до нитрит-аниона
- •2 Окисление нитрит-аниона до нитрат-аниона
- •32. Симбиоз в мире микроорганизмов. Виды симбиоза. Примеры комменсализма, мутуализма, паразитизма. Облигатные и факультативные симбионты.
Вопрос 13: Окисление пирувата
Пируват занимает центральное положение в промежуточном метаболизме и может служить предшественником разнообразных продуктов. Многие организмы окисляют большую часть образующегося в ходе катаболизма пирувата до ацетилкофермента А. Важнейшую роль у бактерий играют три реакции:
(Fd-ферредоксин)
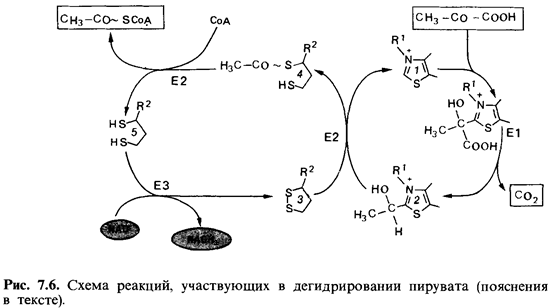
Реакция (1) катализируется мультиферментным комплексом пируват-дегидрогеназой. Этот фермент имеется почти у всех аэробных организмов и служит главным образом для образования ацетил-СоА, который поступает затем в цикл трикарбоновых кислот (рис. 7.6); его функция будет подробно описана ниже. Реакцию (2) катализирует пируват : ферредоксин-оксидоредуктаза - фермент, который у многих анаэробных бактерий (например, у клостридиев) имеет особое значение. Реакцию (3) катализирует пируват: формиатлиаза. Этот фермент есть у многих анаэробных бактерий, выделяющих муравьиную кислоту («муравьинокислое брожение»), в частности у Enterobacteriaceae, но встречается также у фототрофных бактерий. У дрожжей и некоторых бактерий, образующих этанол, имеется четвертый фермент, окисляющий пируват: (4) Пируват -> Ацетальдегид + СО2 Этот фермент - пируватдекарбоксилаза - расщепляет пируват на ацетальдегид и СО2. Ацетальдегид затем восстанавливается до этанола. Дегидрирование пирувата пируватдегидрогеназой. Этот мультиферментный комплекс при участии кофакторов превращает пируват в ацетилкофермент А и СО2 [см. реакцию (1) выше и рис. 7.6]. В состав мультиферментного комплекса входят три белка: пируватдегидро-геназа (Е1), дигидролипоамид-трансацетилаза (П2) и дигидролипоамид-дегидрогеназа (ЕЗ): На начальном этапе (Е1) пируват взаимодействует со 2-м углеродным атомом тиазольного кольца (7) тиаминпирофосфата (ТПФ), в результате чего отщепляется СО2- Образующийся гидроксиэтил-ТПФ (2) реагирует с присоединенным к Е2 липоатом (3), который при этом восстанавливается, а у вторичной SH-группы удерживает ацетильный остаток (4). Затем Е2 катализирует перенос ацетильной группы на кофермент А: при этом остается дигидролипоат (5), который снова окисляется при помощи ЕЗ до липоата при одновременном восстановлении NAD. У строго анаэробных бактерий пируватдегидрогеназный мультиферментный комплекс отсутствует.
|
Вопрос 14: Цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот. Суть цикла трикарбоновых кислот (ЦТК) – окисление двухуглеродного фрагмента (ацетата) до 2х молекул СО2 с образованием энергии. ЦТК является тем центром, в котором сходятся практически все метаболические пути.
Энергетический расчет:
Метаболический путь |
Фермент |
Место образования АТФ и сопряженный процесс |
Число АТФ на 1 моль глюкозы |
Цикл Кребса |
Изоцитратдегидрогеназа |
Окисление НАДН в дых.цепи |
6 |
α-кетоглутаратдегидрогеназа |
Окисление НАДН в дых.цепи |
6 |
|
Сукцинил-КоА-синтетаза |
Субстратное фосфорилирование |
2 |
|
Сукцинатдегидрогеназа |
Окисление 2 ФАДН2 в дых.цепи |
4 |
|
Малатдегидрогеназа |
Окисление 2 НАДН в дых.цепи |
6 |
Итого: 24 молекулы АТФ
Анаэробные дегидрогеназы - это двухкомпонентные ферменты, коферментом которых может быть НАД+ (никотинамидадениндинуклеотид)
При окислении субстрата НАД+ превращается в восстановленную форму НАДH, а второй протон субстрата диссоциирует в среду (НАДH+ Н+). К анаэробным НАД-зависимым дегидрогеназам относятся такие ферменты, как лактатдегидрогеназа, малатдегидрогеназа и др. Коферментом анаэробных дегидрогеназ может быть также НАДФ+ (никотинамидадениндинуклеотидфосфат), содержащий на одну фосфатную группировку больше, чем НАД + . НАДФ- зависимыми дегидрогеназами являются изоцитратдегидрогеназа, глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа и др.
Окисленные и восстановленные формы коферментов анаэробных дегидрогеназ могут взаимопревращаться в реакции, катализируемой ферментом НАД(Ф)-трансгидрогеназой:
НАДФH + НАД+ = НАДФ+ + НАДH
Анаэробные дегидрогеназы передают водород, т. е. электроны и протоны, различным промежуточным переносчикам и аэробным дегидрогеназам.