
- •Тестовые задания
- •Содержание
- •Глава 1. Строение атома
- •Глава 2. Химическая связь
- •Глава 5. Способы выражения концентрации растворов
- •Минерализующая функция слюны связана с ее пересыщенностью по ионам
- •Глава 11. Окислительно-восстановительные реакции
- •Глава 12. Адсорбция. Поверхностные явления
- •Глава 14. Органическая химия.
- •Для получения из бензола м-нитротолуола
- •Литература
- •Учебное издание
- •Тестовые задания
- •Издается в авторской редакции
Глава 14. Органическая химия.
α-аминокислота, которая при декарбоксилировании превращается в этиламин,
А. аминоуксусная
* Б. 2-аминопропановая
В. аминоэтановая
Г. глицин
* Д. аланин
Структурный изомер бензилового спирта, который взаимодействует с NaOH,
* А. n-крезол
* Б. о-крезол
В. n-ксилол
Г. метоксибензол
Д. стирол
Высшие жирные кислоты, входящие в состав нейтральных жиров и фосфолипидов, как правило, имеют
* А. неразветвленный углеродный скелет
Б. разветвленный углеродный скелет
* В. изолированные двойные связи
* Г. цис-конфигурацию углеродного скелета
Д. сопряженные двойные связи
Цис-конфигурация углеродного скелета характерна для
* А. малеиновой кислоты
* Б. арахидоновой кислоты
В. фумаровой кислоты
* Г. линоленовой кислоты
Д. каротина
Оптическая изомерия возможна для
* А. молочной кислоты
Б. глицина
* В. яблочной кислоты
Г. янтарной кислоты
Д. уксусной килоты
Межклассовыми изомерами могут быть
А. альдегиды и спирты
* Б. одноатомные спирты и простые эфиры
* В. одноосновные карбоновые кислоты и сложные эфиры одноосновных карбоновых кислот
Г. одноатомные спирты и сложные эфиры
Д. аминокислоты и карбоновые кислоты
Рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот
А. находятся в пиранозной форме
Б. находятся в открытой форме
* В. находятся в фуранозной форме
Г. имеют
![]() -конфигурацию
аномерного атома углерода
-конфигурацию
аномерного атома углерода
* Д. имеют
![]() -конфигурацию
аномерного атома углерода
-конфигурацию
аномерного атома углерода
Асимметрический атом углерода в α-глицерофосфате
* А. имеет такую же конфигурацию, как α-углеродный атом в молекуле аланина
Б. имеет такую же конфигурацию, как концевой асимметрический атом углерода в молекуле D-глюкопиранозы
* В. имеет L-кофигурацию
Г. имеет D-конфигурацию
Мальтоза и целлобиоза
* А. дисахариды
Б. моносахариды
В. не обладают восстанавливающими свойствами
* Г. обладают восстанавливающими свойствами
Д. не могут гидролизоваться
Молекулы лактозы и молекулы мальтозы
А. содержат β-1,4-гликозидную связь
Б. содержат α-1,4-гликозидную связь
* В. состоят из двух моносахаридных фрагментов, связанных 1-4-гликозидной связью
Г. содержат экваториально расположенную гликозидную связь
* Д. способны к цикло-оксо-таутомерии
Линейное строение целлюлозы обусловлено
* А. β-1,4-гликозидными связями между моносахаридными фрагментами
Б. α-1,4-гликозидными связями между моносахаридными фрагментами
* В. экваториальным расположением гликозидных связей
Г. аксиальным расположением гликозидных связей
* Д. первичной и вторичной структурой ее молекул
В пептидной группе
А. атом
углерода находится в состоянии
![]() -гибридизации
-гибридизации
* Б. атом
углерода находится в состоянии
![]() -гибридизации
-гибридизации
* В. атомы углерода, кислорода и азота образуют сопряженную систему и находятся в одной плоскости
Г. возможно свободное вращение вокруг связи С-N
* Д. затруднено свободное вращение вокруг связи С-N
И коламин , и глицин
* А. гетерофункциональные соединения
Б. содержат карбоксильную группу
* В. содержат аминогруппу
* Г. содержат одинаковое число атомов углерода
Д. участвуют в образовании пептидов
Стерины ( холестерин, эргостерин ) содержат
А. карбоксильную группу
Б. сложноэфирную группу
В. первичную спиртовую группу
* Г. вторичную спиртовую группу
Д. третичную спиртовую группу
В полипептидной цепи между остатками α-аминокислот осуществляются
А. ангидридные связи
Б. сложноэфирные связи
В. водородные связи
* Г. пептидные связи
* Д. амидные связи
В полинуклеотидной цепи между мононуклеотидами осуществляются
А. ангидридные связи
* Б. сложноэфирные связи
* В. фосфодиэфирные связи
Г. Ν-гликозидные связи
Д. пептидные связи
В мононуклеотиде
* А. между углеводом и нуклеиновым основанием связь Ν-гликозидная
Б. между углеводом и нуклеиновым основанием связь О-гликозидная
В. между углеводом и остатком фосфорной кислоты связь ангидридная
* Г. между углеводом и остатком фосфорной кислоты связь сложноэфирная
Д. между углеводом и остатком фосфорной кислоты связь Ν-гликозидная
Водородная связь принимает участие в формировании
А. первичной структуры нуклеиновых кислот
* Б. вторичной структуры нуклеиновых кислот
В. первичной структуры белков и пептидов
* Г. вторичной структуры белков и пептидов
* Д. пространственной структуры белковой молекулы
Аналогией вторичной структуры обусловлены общие свойства целлюлозы и фибриллярных белков:
А. глобулярное строение
* Б. волокнистое строение
В. хорошая растворимость в воде
* Г. плохая растворимость в воде
Д. способность к образованию коллоидных растворов
Водородные связи приводят к спирализации макромолекул
* А. амилозы
* Б. глобина
В. целлюлозы
* Г. альбумина
Д. β-кератина
Двойная спираль ДНК стабилизируется
* А. водородными связями между комплементарными основаниями двух полинуклеотидных цепей
* Б. Ван-дер-Ваальсовыми силами взаимодействия между основаниями, расположенными друг под другом
В. сложноэфирными связями между мононуклеотидами
Г. водородными связями между парами пуриновых оснований
Д. водородными связями между парами пиримидиновых оснований
Две цепи ДНК между собой
А. идентичны
Б. параллельны
* В. антипараллельны
* Г. комплементарны
В отличие от цереброзидов, ганглиозиды содержат
А. сфингозин
Б. глицерин
* В. олигосахарид
Г. жирную кислоту
α- и β-аномеры D-глюкопиранозы являются
* А. изомерами
* Б. диастереомерами
В. энантиомерами
* Г. эпимерами
Химическая основа мутаротации
А. цис-транс-изомерия
* Б. цикло-оксо-таутомерия
* В. подвижное равновесие между ациклической и циклической формами моносахаридов
В водном растворе D-глюкозы наиболее устойчива
А. α-D-глюкопираноза
* Б. β-D-глюкопираноза
В. α-D-глюкофураноза
Г. β-D-глюкофураноза
Д. открытая форма D-глюкозы
В конформации « кресла» для D-глюкопиранозы наиболее устойчив β-аномер, т.к. у него все объемные заместители занимают
* А. эваториальное положение
Б. аксиальное положение
В. поочередно экваториальное и аксиальное положение
В сравнении с альдогексозами у соответствующих кетогексоз число асимметрических атомов углерода
А. на один больше
* Б. на один меньше
В. одинаково
Количество стереоизомеров одинаково у
А. альдопентоз и альдогексоз
* Б. альдопентоз кетогексоз
В. альдогексоз и кетогексоз
В циклической форме моносахаридов
А. присутствует карбонильная группа
* Б. отсутствует карбонильная группа
* В. присутствует гликозидный гидроксил
Г. отсутствует гликозидный гидроксил
Для толуола характерны реакции
* А. ![]()
* Б.
![]()
В. ![]()
Г. ![]()
Для стирола характерны реакции
А. по радикалу
Б. ![]() по радикалу
по радикалу
* В. по бензольному кольцу
Г. по бензольному кольцу-
* Д. по радикалу
Устойчивость карбокатиона
 по
сравнению с
по
сравнению с

* А. выше
Б. ниже
В. одинакова
К нуклеофильным реагентам относятся
* А. ![]()
* Б. ![]()
В. ![]()
* Г. ![]()
Д. ![]()
Ароматическая система содержит
А. неплоский замкнутый цикл
Б. обязательно бензольное кольцо
* В. плоский
замкнутый цикл и сопряженную систему
из
![]() электронов
электронов
Г. открытую сопряженную систему из электронов
Взаимодействие алканов с галогенами сопровождается
* А. гомолитическим разрывом связи C-H
Б. гомолитическим разрывом связи С-С
В. гетеролитическим разрывом связи С-Н
Г. гетеролитическим разрывом связи С-С
2-хлорбутан можно получить при
* А. галогенировании н-бутана
Б. галогенировании изобутана
* В. гидрогалогенировании бутена-1
* Г. гидрогалогенировании бутена-2
В молекулах фенола и этилового спирта гидроксильная группа
А. электронодонорный заместитель
Б. электроноакцепторный заместитель
* В. соответтвенно электронодонорный и электроноакцепторный заместитель
Г. соответственно электроноакцепторный и электронодонорный заместитель
 -группа
является
-группа
является
А. донорным заместителем в насыщенном радикале
* Б. донорным заместителем в сопряженной системе
* В. акцепторным заместителем в насыщенном радикале
Г. акцепторным заместителем в сопряженной системе
Причина кето-енольной таутомерии карбонильных соединений
А. наличие асимметрического атома углерода
* Б. подвижность водорода у α-углеродного атома
В. наличие нескольких двойных связей в радикале
* Г. наличие С-Н-кислотного центра у α-углеродного атома
К числу кетоновых тел относятся
А. молочная кислота
* Б. ацетон
* В. ацетоуксусная кислота
Г. пировиноградная кислота
* Д. β-оксимасляная кислота
Кето-енольная таутомерия невозможна для
* А. метаналя
Б. этаналя
В. пропаналя
Г. бутаналя
* Д. 2.2-диметилпропаналя
Продукт альдольной конденсации пропаналя
А. 3-гидроксигексаналь
Б. 2-гидроксигексаналь
* В. 3-гидрокси-2-метилпентаналь
* Г. содержит одновременно карбонильную и гидроксильную группу
Д. содержит одновременно карбоксильную и гидроксильную группу
В результате термического разложения 2-гидроксипропан-1.2.3-трикарбоновой кислоты образуется
А. 2 вещества
Б. 3 вещества
* В. 4 вещества
Г. 5 веществ
Д. 6 веществ
Для осуществления превращения
 необходимо
необходимо
А. растворить альдегид в воде
Б. окислить альдегид
* В. восстановить альдегид
Г. провести реакцию дегидрирования
* Д. провести реакцию гидрирования
При одинаковых углеводородных радикалах кислотность в водном растворе возрастает в ряду
* А. углеводороды, амины, спирты, тиолы
Б. тиолы, спирты, амины, углеводороды
В. углеводороды, спирты, амины, тиолы
Г. спирты, тиолы, углеводороды, амины
В соединении
 наибольшую
кислотность проявляет группа
наибольшую
кислотность проявляет группа
А. С-Н
* Б. О-Н
Кислотность алифатических спиртов в водном растворе
* А. увеличивается при введении в радикал электроноакцепторных заместителей
Б. увеличивается при введении в радикал электронодонорных заместителей
* В. уменьшается при введении в радикал электронодонорных заместителей
Г. увеличивается при введении в радикал электронодонорных заместителей
Кислотность алифатического спирта в сравнении с фенолом
А. выше
* Б. ниже
В. одинакова
Коламин
 образует
устойчивую соль с HCl за
счет группы
образует
устойчивую соль с HCl за
счет группы
А. ![]()
Б. ![]()
* В. ![]()
Насыщенные монокарбоновые кислоты
* А. обладают большей кислотностью, чем насыщенные одноатомные спирты
Б. обладают меньшей кислотностью, чем насыщенные одноатомные спирты
В. вступают в реакции как альдегиды
* Г. вступают
в реакции
![]() в отличие от альдегидов
в отличие от альдегидов
* Д. образуют димеры за счет межмолекулярных водородных связей
Холевая кислота и холестерин
А. образуют амиды с глицином и таурином
Б. содержат карбоксильную группу
* В. содержат гидроксильную группу
* Г. содержат скелет стерана
* Д. содержат одинаковое число атомов углерода
Мальтобионовая кислота
А. образуется при взаимодействии мальтозы со свежеприготовленным гидроксидом меди (II) при комнатной температуре
* Б. образуется при взаимодействии мальтозы со свежеприготовленным гидроксидом меди (II) при нагревании
* В. содержит гликозидную связь
Г. не содержит гликозидную связь
Д. содержит сложноэфирную связь
Гликозидные связи содержат молекулы
А. глюкозы
Б. фруктозы
* В. сахарозы
* Г. аденозина
* Д. целлюлозы
Молекула АТФ содержит
А. О-гликозидную связь
* Б. N-гликозидную связь
* В. сложноэфирную связь
Г. фосфодиэфирную связь
* Д. ангидридную связь
В результате превращения этанола в диэтиловый эфир основность О-основного центра
* А. увеличивается
Б. уменьшается
В. не изменяется
Дифильны молекулы
А. нейтрального жира
* Б. фосфолипида
В. стерана
* Г. желчной кислоты
Д. глицерина
Стеариновая и олеиновая кислоты
* А. содержат одинаковое число атомов углерода
Б. содержат одинаковое число атомов водорода
* В. имеют неразветвленный углеродный скелет
Г. имеют разветвленный углеродный скелет
Д. хорошо растворимы в воде
Фосфатидилэтаноламин
А. может содержать одновременно остатки стеариновой и пальмитиновой кислот
* Б. может содержать одновременно остатки стеариновой и олеиновой кислот
* В. имеет дифильную молекулу
Г. имеет неполярную молекулу
Д. неомыляемый липид
Аденозин-
 -монофосфат
-монофосфат
А. может входить в состав ДНК
* Б. может входить в состав РНК
* В. содержит N-гликозидную связь
Г. содержит О-гликозидную связь
В результате последовательного декарбоксилирования аспарагиновой кислоты образуются
А. α-аминопропионовая кислота и этиламин
* Б. β-аминопропионовая кислота и этиламин
В. γ-аминобутановая кислота и пропиламин
Г. α-аминобутановая кислота и пропиламин
Положительную биуретовую реакцию дают
* А. любые белки
* Б. только кислые белки
В. только основные белки
Г. любые аминокислоты
* Г. любые трипептиды
При кипячении щелочного раствора цистеина с ацетатом свинца образуются
А. сульфат свинца
* Б. сульфид свинца
В. аспарагиновая кислота
* Г. серин
* Д. ацетат натрия
Ксантопротеиновая реакция служит для обнаружения α-аминокислот, содержащих в радикале
А. тиольные группы
Б. гидроксильные группы
В. аминогруппы
* Г. циклы ароматического характера
Д. карбоксильные группы
Из перечисленных кислот легко окисляются
А. уксусная
* Б. муравьиная
* В. щавелевая
Г. масляная
Д. бензойная
Ацетилсалициловая кислота в отличие от фенилсалицилата
А. производное салициловой кислоты
* Б. сложный эфир салициловой кислоты по гидроксильной группе
В. сложный эфир салициловой кислоты по карбоксильной группе
Г. содержит бензольное кольцо
Салициловая кислота
А. монофункциональное соединение
* Б. гетерофункциональное соединение
В. проявляет свойства кислоты в реакциях с кислотами
* Г. проявляет свойства кислоты в реакциях со спиртами и фенолами
* Д. проявляет свойства спирта в реакциях с ангидридами кислот
Если изоэлектрическая точка лизина находится при рН=9.74, то в сильнокислой среде
А. преобладает
форма
![]()
* Б. преобладает
форма
![]()
* В. он является трехосновной кислотой
Г. преобладает анионная форма
* Д. преобладает катионная форма
В растворе аспарагиновой кислоты преобладает
А. катионная форма при рН=7
Б. биполярные ионы при рН=7
* В. анионная форма при рН=7
* Г. катионная форма при рН<2.7
* Д. анионная форма при рН>7
В форме
 аланин
находится
аланин
находится
А. при рН=6.0
* Б. при рН>6.0
В. при рН<6.0
* Г. в щелочной среде
* Д. при физиологическом значении рН крови
При окислительном дезаминировании α-аминокислоты получается щавелевоуксусная кислота. При монодекарбоксилировании исходной аминокислоты получается
А. этаноламин
Б. холин
* В. β-аминопропионовая кислота
Г. α-аминопропионовая кислота
Д. молочная кислота
В результате окислительного дезаминирования и последующего восстановления α-аминокислоты получается молочная кислота. Из солянокислого раствора исходной кислоты выделяется
* А. солянокислый аланин
Б. солянокислый глицин
В. солянокислый валин
Г. хлорангидрид аланина
Д. хлорангидрид валина
Кадаверин получается в результате
А. окислительного дезаминирования лизина
Б. неокислительного дезаминирования лизина
* В. декарбоксилирования лизина
Г. декарбоксилирования аланина
Д. декарбоксилирования аспарагина
Пировиноградная кислота получается в результате
А. восстановления молочной кислоты
* Б. окисления молочной кислоты
В. неокислительного дезаминирования аланина
* Г. окислительного дезаминирования аланина
Д. декарбоксилирования аланина
Если при полном β-окислении 1 моль жирной кислоты получилось 9 моль ацетилкофермента, то триглицерид этой кислоты
А. содержит остатки пальмитиновой кислоты
Б. трипальмитин
* В. тристеарин
* Г. содержит остатки стеариновой кислоты
Из перечисленных нейтральных жиров иодное число выше всего у
А. трипальмитоилглицерина
Б. тристеароилглицерина
В. 1-олеоил-2-стеароил-3-пальмитоилглицерина
Г. 1,2-диолеоил-3-пальмитоилглицерина
* Д. триолеоилглицерина
В схеме превращений фумаровая к-та
 лимонная
к-та
лимонная
к-та
А. X-щавелевая кислота, Y-ацетоуксусная кислота
* Б. X-яблочная кислота, Y-щавелевоуксусная кислота
В. X-яблочная кислота, Y-ацетоуксусная кислота
Г. X-молочная кислота, Y-пировиноградная кислота
Реакциями декарбоксилирования являются превращения
* А. ацетоуксусной кислоты в ацетон
Б. щавелевевоуксусной кислоты в лимонную
* В. пировиноградной кислоты в ацетилкофермент
* Г. гистидина в гистамин
Д. аланина в пировиноградную кислоту
В цикле трикарбоновых кислот в результате дегидратации и последующей гидратации лимонной кислоты получается
А. ацетон и диоксид углерода
Б. лимонная кислота
* В. изолимонная кислота
Г. цис-аконитовая кислота
Д. винная кислота
Фумаровая кислота в отличие от малеиновой
А. образует кислые и средние соли
Б. образует циклический ангидрид
* В. не образует циклический ангидрид
Г. является цис-изомером
* В. является транс-изомером
В схеме превращений молочная к-та
 вещество Y
вещество Y
А. глицерофосфат
Б. фосфорный ангидрид
В. ангидрид пировиноградной и фосфорной кислоты
* Г. фосфоенолпировиноградная кислота
Изоэлектрическая точка трипептида лежит в кислой среде. После отщепления с N-конца одной α-аминокислоты изоэлектрическая точка сместилась в нейтральную область. Образовавшийся дипептид дает желтое окрашивание с концентрированной азотной кислотой. С-концевая α-аминокислота не содержит функциональных групп в радикале. Вероятное название трипептида
А. асп-фен-тир
* Б. асп-тир-ала
* В. асп-тир-вал
Г. ала-тир-асп
Д. фен-асп-ала
В более кислой среде лежит изоэлектрическая точка дипептида
А. ала-фен
Б. гли-цис
* В. асп-глу
Г. лиз-глу
Д. лиз-фен
В крови при физиологическом значении рН
* А. основные аминокислоты находятся в катионной форме
Б. основные аминокислоты находятся в анионной форме
В. кислые аминокислоты находятся в катионной форме
* Г. кислые аминокислоты находятся в анионной форме
В схеме превращений
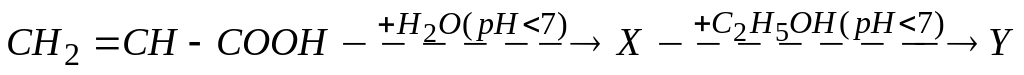 вещество Y
вещество Y
А. этиловый эфир молочной кислоты
Б. этиловый эфир α-гидроксипропионовой кислоты
* В. этиловый эфир β-гидроксипропионовой кислоты
Г. α-этоксипропионовая кислота
Д. β-этоксипропионовая кислота
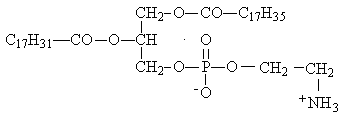
Если при омылении фосфолипида получились: глицерин, стеарат натрия, олеат натрия, фосфат натрия, этаноламин, то его формула
* А.
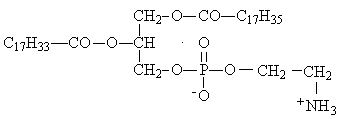
Б.
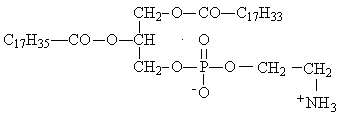
В.
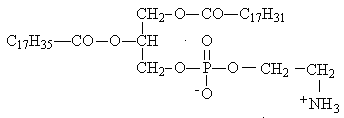
Г.
В схемах превращений
 вещества X,
Y, Z
cоответственно
вещества X,
Y, Z
cоответственно
А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
В схеме превращений
 вещество Z
вещество Z
А.
* Б.
В.
Г.
Галогенопроизводное органического соединения и галогеноводород получаются в результате взаимодействия
А. этилена с хлором
* Б. этана с хлором при освещении
* В. бензола с хлором в присутствии хлорида железа (III)
* Г. фенола с бромной водой
Д. бутадиена с хлором
Если при действии металлического натрия на вещество
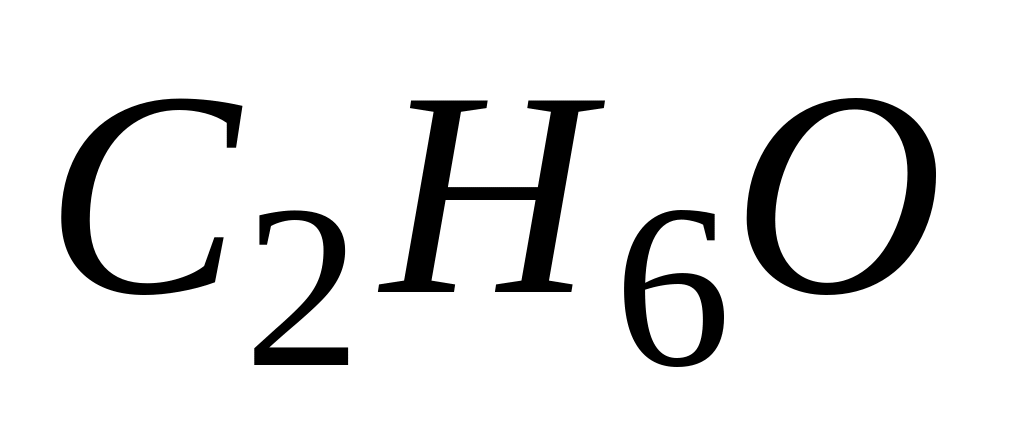 выделяется
газообразный водород, то в схеме
превращений
выделяется
газообразный водород, то в схеме
превращений
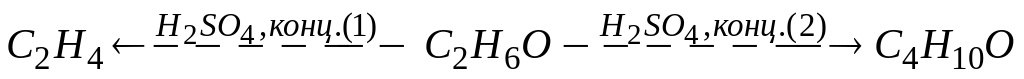
А. реакция-1- дегидрирование, продукт-этилен
* Б. реакция-1- внутримолекулярная дегидратация, продукт-этилен
В. реакция-2- внутримолекулярная дегидратация, продукт-бутанол
* Г. реакция-2- межмолекулярная дегидратация, продукт-диэтиловый эфир
Д. реакция-2- этерификация, продукт-этилацетат
Если вещество X состава
 может восстанавливаться с обра зованием
вещества Y и дает реакцию
“серебряного зеркала”,то
может восстанавливаться с обра зованием
вещества Y и дает реакцию
“серебряного зеркала”,то
А. X-ацетон, Y- пропанол-2
* Б. X-пропаналь, Y-пропанол-1
В. X-пропанон, Y-пропанол-2
Г. X-пропаналь, Y- пропанол
Д. X- пропанол, Y- пропионовая кислота
В схеме превращений

А. X-уксусная кислота, Y- этанол
Б. X-молочная кислота, Y-масляная кислота
В. X-этанол, Y-масляная кислота
* Г. X-этанол, Y-молочная кислота
Д. X- пропанол, Y- пропионовая кислота
В схеме превращений

* А. X - D-глюкаровая кислота, Y и Z - D-глюконовая кислота
Б. X – D-глюкаровая кислота, Y – D-глюконовая кислота, Z – D-глюкуроновая кислота
В. X – D-глюконовая кислота, Y – D-глюкаровая кислота, Z – D-глюконовая кислота
Г. X, Y, Z – D-глюконовая кислота
Д. X и Z– D-глюкаровая кислота, Y – D-глюконовая кислота
В схеме превращений

А. X-2-метил-β-D-глюкопираноза, Z- β-D-глюкуроновая кислота
* Б. X- метил-β-D-глюкопиранозид, Z- β-D-глюкуроновая кислота
В. X- 6-метил-β-D-глюкопираноза, Z- β-D-глюкуроновая кислота
Г. X- 1, 2, 3, 4, 6-пентаметил-β-D-глюкопираноза, Z- D-глюконовая киcлота
При гидролизе дисахарида образуется только глюкоза. Гликозидная связь в его молекуле расположена аксиально. При действии на дисахарид гидроксида меди (II) выпадает осадок красно-коричневого цвета и образуется
А. целлобионовая кислота
* Б. мальтобионовая кислота
В. лактобионовая кислота
Г. глюкуроновая кислота
Г. глюконовая кислота
В схеме превращений
 лимонная
кислота исходное вещество А
лимонная
кислота исходное вещество А
А. аланин
Б. коламин
В. лизин
* Г. аспарагиновая кислота
Д. глутаминовая кислота
В схеме превращений
 …
…
 исходным веществом X
является:
исходным веществом X
является:
А. ацетилен
Б. пропанол-1
В. этан
* Г. этилен
Д. уксусная кислота
Вещество X в схеме превращений

* А. 2,4,6-триброманилин
Б. нитробензол
В. 2,4,6-трибромнитробензол
Г. 4-броманилин
Д. 3-броманилин
При кислотном гидролизе структурного изомера масляной кислоты получаются два вещества, молекулы которых содержат одинаковое число атомов углерода. Одно из этих веществ легко реагирует со щелочью, а другое практически не взаимодействует с ней. Оба вещества могут реагировать с металлическим натрием. Исходное вещество
А. изомасляная кислота
Б. диэтиловый эфир
* В. этилацетат
Г. бутанол-1
Д. метилпропионат
Если в результате омыления 1 моль триацилглицерина образуется 2 моль олеата натрия и 1 моль стеарата натрия, то для полного гидрирования 1 моль этого липида необходимо
А. 4
моль
![]()
Б. 3 моль
* В. 2 моль
Г. 1 моль
Согласно правилу Марковникова HCl присоединяется к
А. ![]()
Б. ![]()
* В. ![]()
* Г. ![]()
Д. ![]()
Реакции
 легче всего протекают для
легче всего протекают для
А.
Б. ![]()
* В. ![]()
Г. ![]()
Д.
Бромную воду обесцвечивают
* А. этилен
Б. бензол
В. пропан
* Г. анилин
* Д. фенол
Реакции альдольной конденсации
* А. ![]()
Б. ![]()
В. ![]()
Г. ![]()
Д. ![]()
Соединение состава
 не дает реакцию «серебряного зеркала»,
не восстанавливает гидроксид меди
(II). При каталитическом
восстановлении этого соединения
образуется
не дает реакцию «серебряного зеркала»,
не восстанавливает гидроксид меди
(II). При каталитическом
восстановлении этого соединения
образуется
А. пропанол-1
* Б. пропанол-2
* В. изопропиловый спирт
Г. пропаналь
Д. пропанон
Продукты щелочного гидролиза фенилсалицилата
* А. салицилат натрия
Б. салициловая кислота
В. бензоат натрия
Г. бензойная кислота
* Д. фенолят натрия
Фенол и этанол взаимодействуют с
* А. металлическим натрием
Б. гидроксидом натрия
В. бромной водой
Г. хлороводородом
В реакциях
 наиболее активно соединение
наиболее активно соединение
А. этилен
Б. бензол
В. бензойная кислота
* Г. анилин
Д. нитробензол
Для холестерина возможны реакции
* А. этерификации с кислотами
Б. этерификации со спиртами
* В. присоединения водорода
Г. омыления
Д. альдольной конденсации
Желчные кислоты
* А. производные циклопентанпергидрофенантрена
* Б. гидроксикислоты
В. входят в состав фосфолипидов
* Г. поверхностно-активные вещества
Д. поверхностно-инактивные вещества
Углеводород состава
 обесцвечивает бромную воду, а при
гидратации образует третичный спирт.
Название углеводорода
обесцвечивает бромную воду, а при
гидратации образует третичный спирт.
Название углеводорода
А. метилциклопропан
Б. циклобутан
В. бутен-1
Г. бутен-2
* Д. метилпропен
Углеводород состава
 содержит четвертичный атом углерода
и обесцвечивает бромную воду.
Цис-транс-изомерия для этого углеводорода
содержит четвертичный атом углерода
и обесцвечивает бромную воду.
Цис-транс-изомерия для этого углеводорода
А. возможна
* Б. не возможна
Изомер пентана, который при хлорировании дает только одно монохлорпроизводное
А. н-пентан
Б. метилбутан
* В. диметилпропан
Г. изопентан
Монокарбонильное соединение с пятью атомами углерода в молекуле реагирует с аммиачным раствором оксида серебра (I) и при восстановлении образует спирт состава
 ,
содержащий три атома углерода в главной
цепи. Название соединения
,
содержащий три атома углерода в главной
цепи. Название соединения
А. пентаналь
Б. 2-метилбутаналь
В. 3-метилбутаналь
* Г. диметилпропаналь
Д. пентанон-2
Вещество состава
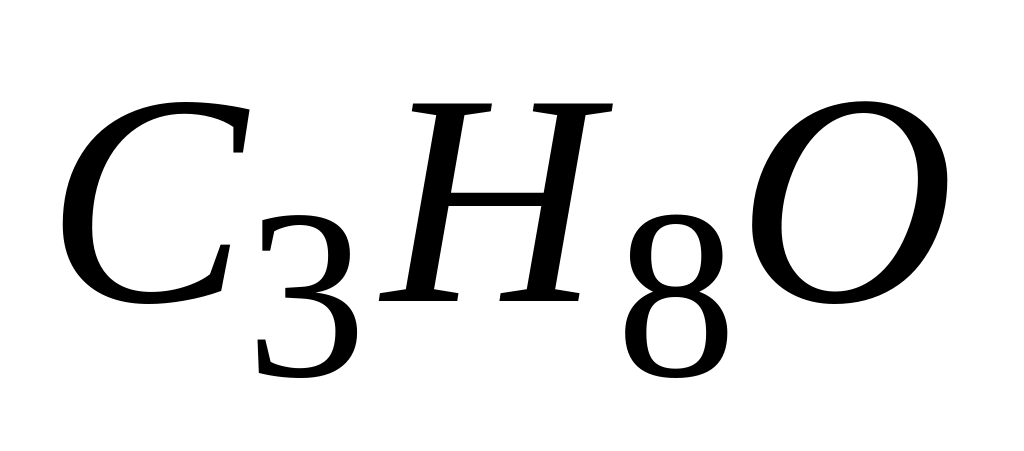 может быть окислено оксидом меди(II)
в вещество А, которое при взаимодействии
с аммиачным раствором оксида серебра(I)
превращается в пропионовую кислоту.
Исходное вещество
может быть окислено оксидом меди(II)
в вещество А, которое при взаимодействии
с аммиачным раствором оксида серебра(I)
превращается в пропионовую кислоту.
Исходное вещество
А. метоксиэтан
* Б. пропанол-1
В. пропанол-2
В схеме превращений
 вещество Z
вещество Z
* А. метилпропанол-2
* Б. изобутиловый спирт
В. метилпропен
Г. метилпропанол-1
В схеме превращений
 вещества
X и Y
соответственно
вещества
X и Y
соответственно
А. бутанол-2 и бутен-1
* Б. бутен-2 и 2,3-дибромбутан
В. бутадиен-1,3 и бутандиол-2,3
Г. октан и бутанол-1
В схеме превращений
 вещество X
вещество X
* А. 3,4-диметилгексан
Б. гексан
В. октан
Г. 2-бромбутан
Д. 2,3-диметилбутан
В схеме превращений
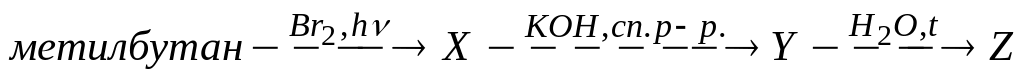 вещество Z
вещество Z
А. бутанол-1
Б. бутанол-2
* В. 2-метилбутанол-2
Г. 3-метилбутанол-2
Д. 3-метилбутанол-1
В схеме превращений
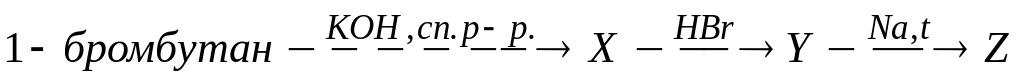 вещество Z cодержит
атомов углерода
вещество Z cодержит
атомов углерода
А. меньше, чем исходное вещество
Б. столько же, сколько исходное вещество
* В. больше, чем исходное вещество
Г. четыре
* Д. восемь
В схеме превращений
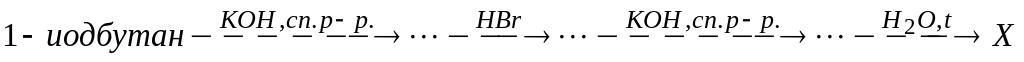 вещество X
вещество X
А. первичный спирт
* Б. вторичный спирт
В. третичный спирт
* Г. бутанол-2
Д. изобутанол
В схеме превращений
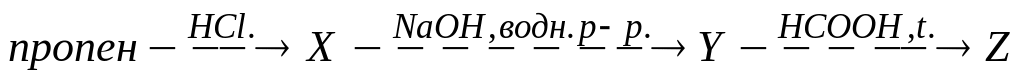 вещество Z
вещество Z
А. пропилацетат
Б. изопропилацетат
В. пропилформиат
* Г. изопропилформиат
Д. метоксипропан
В схеме превращений
 вещество Z
вещество Z
А. глицин
Б. аланин
* В. метиламин
Г. этиламин
Д. этилендиамин
Продукт взаимодействия метакриловой кислоты с этиленгликолем
* А. может полимеризоваться
Б. не может полимеризоваться
* В. может образовать полуацеталь с альдегидом
Г. не может образовать полуацеталь с альдегидом
* Д. является сложным эфиром
С водой
А. этан взаимодействует
* Б. этан не взаимодействует
* В. этилен взаимодействует
Г. этилен не взаимодействует
Д. бензол взаимодействует
Для получения из бензола n-нитротолуола
А. заместители можно вводить в бензольное кольцо в любом порядке
Б. сначала в бензольное кольцо вводится нитрогруппа, а затем- метильная группа
* В. сначала в бензольное кольцо вводится метильная группа, а затем- нитрогруппа
* Г. сначала в бензольное кольцо вводится ориентант I –рода, а затем- ориентант II-рода
Д. сначала в бензольное кольцо вводится ориентант II-рода, а затем- ориентант I-рода
