
- •Тестовые задания
- •Содержание
- •Глава 1. Строение атома
- •Глава 2. Химическая связь
- •Глава 5. Способы выражения концентрации растворов
- •Минерализующая функция слюны связана с ее пересыщенностью по ионам
- •Глава 11. Окислительно-восстановительные реакции
- •Глава 12. Адсорбция. Поверхностные явления
- •Глава 14. Органическая химия.
- •Для получения из бензола м-нитротолуола
- •Литература
- •Учебное издание
- •Тестовые задания
- •Издается в авторской редакции
Минерализующая функция слюны связана с ее пересыщенностью по ионам
* А.
* Б.
* В. составляющим гидроксиапатит
Г.
При подкислении слюны до pH = 6.0
* А. снижается степень насыщения ее по гидроксиапатиту
Б. повышается степень насыщения ее по гидроксиапатиту
* В. уменьшаются ее минерализующие свойства
Г. усиливаются ее минерализующие свойства
При pH < 6.0 слюна
* А. ненасыщена по гидроксиапатиту
Б. пересыщена по гидроксиапатиту
* В. теряет минерализующие свойства
* Г. является деминерализующей жидкостью
При увеличении pH слюны выше значения 7.0
А. снижаются ее минерализующие свойства
* Б. повышаются ее минерализующие свойства
* В. образуется зубной камень
Г. растворяется зубная эмаль
Профилактическое действие фторид-ионов, входящих в состав зубной пасты, связано с протеканием реакции
*А.
![]()
Б.
![]()
Большой избыток фторид-ионов в слюне приводит
А. к укреплению зубной эмали
* Б. к разрушению зубной эмали
* В.
к образованию практически нерастворимого
![]()
* Г. к превращению гидроксиапатита зубной эмали в еще более малорастворимое соединение – фторид кальция
Д. к превращению гидроксиапатита зубной эмали в еще более малорастворимый фторгидроксиапатит
Использование фторсодержащих зубных паст (содержащих оптимальное количество фторид-ионов) способствует превращению гидроксиапатита зубной эмали
* А. в менее растворимый фторгидроксиапатит
Б. в менее растворимый фторид кальция
В. в более растворимый фосфат кальция
Г. в более растворимый дигидрофосфат кальция
Соединения магния не играют значительной роли в построении скелета и зубной ткани, так как его фосфаты и основные карбонаты
А. менее растворимы, чем соответствующие соли кальция
* Б. более растворимы, чем соответствующие соли кальция
Возможность замещения ионов в костной и зубной тканях на ионы
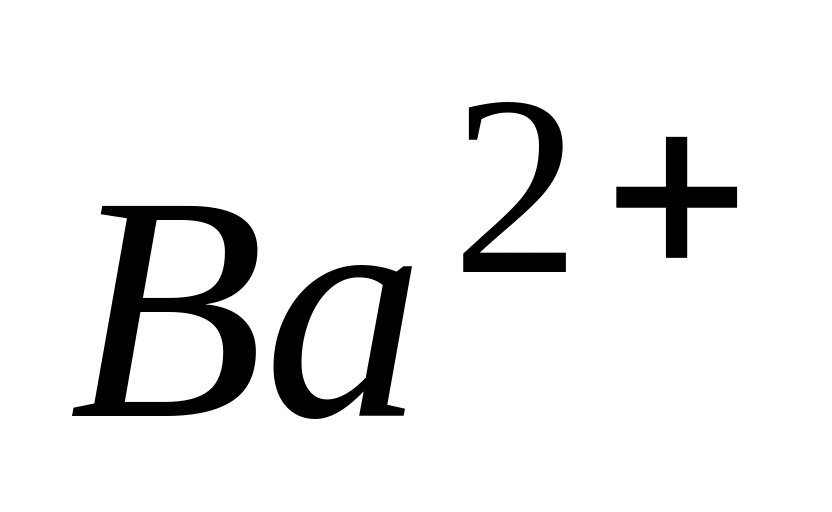 и
связана:
и
связана:
А. с
увеличением растворимости фосфатов в
ряду
![]()
* Б. с уменьшением растворимости фосфатов в ряду
* В. со
смещением равновесия вправо в реакциях
![]() и
и
![]()
Г. со
смещением равновесия влево в реакциях
![]() и
и
![]()
Кальций, вводимый с пищей, всасывается в кишечнике на 50%, что можно объяснить образованием в желудочно-кишечном тракте труднорастворимых
А. хлоридов кальция
Б. нитратов кальция
* В. фосфатов кальция
* Г. кальциевых солей высших жирных кислот
Д. ацетатов кальция
Использование как рентгеноконтрастного вещества связано с его
А. растворимостью в соляной кислоте желудочного сока
* Б. нерастворимостью в соляной кислоте желудочного сока
В. склонностью к гидролизу
* Г. отсутствием склонности к гидролизу
* Д. способностью поглощать рентгеновские лучи
В крови, которая используется при переливании, в виде малорастворимых цитратов осаждают
А. ионы
Б.
ионы
![]()
В.
ионы
![]()
* Г.
ионы
![]()
Д.
ионы
![]()
Избыток ионов в организме может привести к отложению “камней” в виде малорастворимых
* А. оксалатов
* Б. фосфатов
* В. основных карбонатов
Г. сульфатов
Д. хлоридов
Действие тиосульфата натрия при отравлении соединениями ртути и свинца связано с образованием нерастворимых нетоксичных
А. тиосульфатов
Б. сульфидов
В. сульфатов
* Г. сульфитов
Слабая токсичность соединений Sb(II) и Bi(III) обусловлена
* А. их гидролизом с образованием малорастворимых продуктов в пищеварительном тракте
Б. их высокой растворимостью
В. накапливанием их в щитовидной железе
Осадок может выпасть в
А. насыщенном растворе
Б. ненасыщенном растворе
* В. пересыщенном растворе
Более крупные кристаллы получают из растворов
А. ненасыщенных
Б. с большой степенью пересыщения
* В. с небольшой степенью пересыщения
Чем больше степень пересыщения раствора, тем
* А. больше центров кристаллизации
Б. меньше центров кристаллизации
В. больше размеры кристаллов
* Г. меньше размеры кристаллов
Чем меньше степень пересыщения раствора, тем
А. больше центров кристаллизации
* Б. меньше центров кристаллизации
* В. больше размеры кристаллов
Г. меньше размеры кристаллов
В процессе образования кристаллических осадков частицы, из которых образуется осадок, сначала
А. сольватируются
* Б. десольватируются
В. объединяются в крупные агрегаты
* Г. объединяются в центры кристаллизации по 10-100 частиц
При формировании зубной эмали центры кристаллизации гидроксиапатита находятся
А. в слюне
* Б. на нерастворимой белковой матрице
Уменьшение pH слюны
А. усиливает ее минерализующую функцию
* Б. ослабляет ее минерализующую функцию
В. способствует укреплению зубной эмали
* Г. способствует растворению зубной эмали
* Д.
смещает равновесие
![]() вправо
вправо
При pH<4 в слюне
* А.
возможно образование иона
![]()
* Б.
возможно образование гидратов растворимой
соли
![]()
В. преобладает образование нерастворимых гидроксиапатитов
Г. возможно образование зубного камня
* Д. низко содержание ионов
Образование зубного камня наиболее вероятно при pH
А. меньше 4,0
Б. 4,2-6,2
В. 7,06
* Г. больше 7,25
Насыщенный раствор карбоната кальция содержит
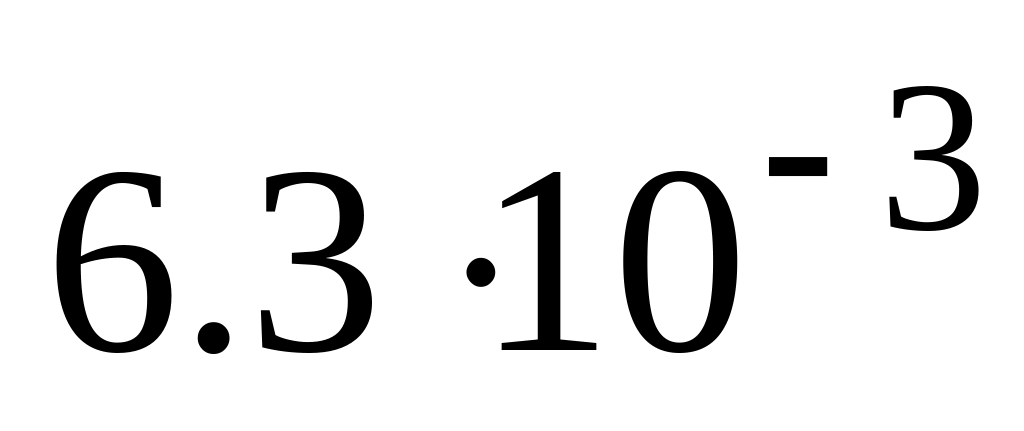 г
соли в литре. Произведение растворимости
карбоната кальция составляет
г
соли в литре. Произведение растворимости
карбоната кальция составляет
А.
Б.
![]()
В.
![]()
Г.
![]()
* Д.
![]()
Г лава 10. Комплексные соединения
В структуре комплексных соединений центральный атом более прочно связан
А. с ионами внешней сферы
* Б. с лигандами
* В. с молекулами и ионами внутренней сферы
Характер связи между центральным атомом и лигандами
А. только электростатический
Б. только донорно-акцепторный
* В. электростатический и донорно-акцепторный
Г. межмолекулярный
Ионы внешней сферы
А. связаны непосредственно с центральным атомом
* Б. непосредственно не связаны с центральным атомом
* В. электростатически связаны с внутренней сферой
Г. несут заряд того же знака, что и заряд внутренней сферы
* Д. несут заряд, противоположный по знаку с зарядом внутренней сферы
Наибольшей способностью к комплексообразованию обладают
* А. катионы переходных металлов
Б. анионы неметаллов
В. катионы щелочных металлов
Г. нейтральные молекулы
Способность к комплексообразованию в семействах периодической системы уменьшается в ряду
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Биогенные s-элементы Na, K, Ca, Mg комплексные соединения
А. образуют с любыми лигандами
Б. не образуют
* В. образуют только с лигандами определенной структуры
* Г. образуют только с полидентатными лигандами
* Д. образуют с краун-эфирами
Основные причины, по которым ионы d-и f-элементов чаще всего выступают в роли комплексообразователей
* А. наличие свободных орбиталей на d-и f-подуровнях
* Б. наличие неподеленных пар электронов на d-и f-подуровнях
В. наличие неспаренных электронов на внешнем уровне
Г. склонность к образованию кратных связей
В комплексных ионах
 и
и

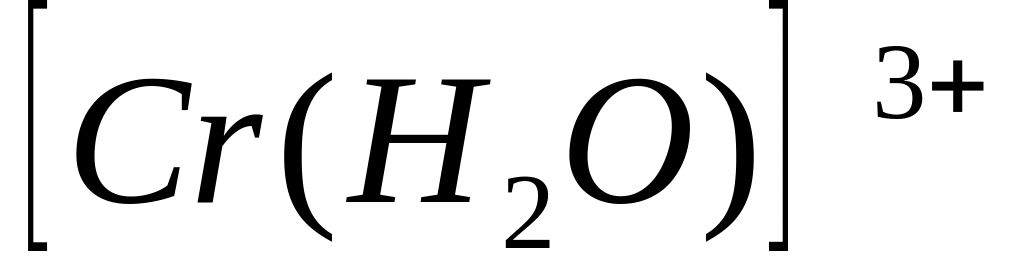 центральный атом
центральный атом
А. донор электронных пар
* Б. акцептор электронных пар
В комплексном ионе
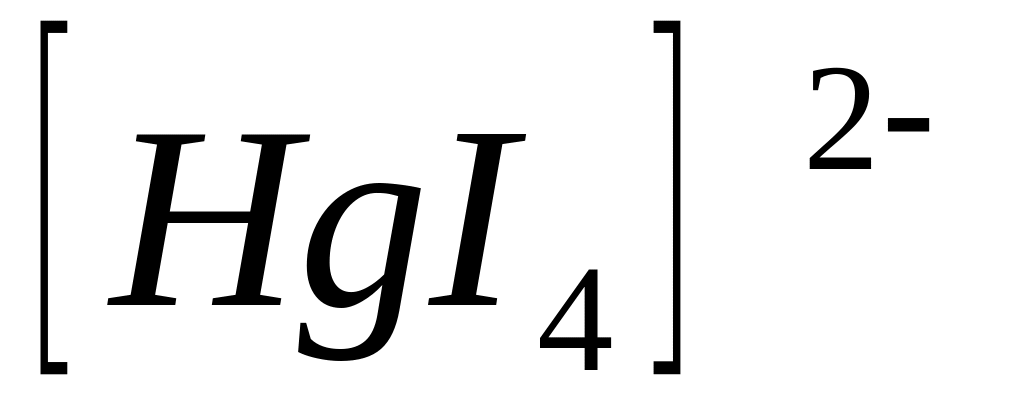
* А. центральный атом – донор электронных пар
Б. центральный атом – акцептор электронных пар
В. лиганды – доноры электронных пар
* Г. лиганды – акцепторы электронных пар
Лигандами могут быть частицы
* А.
* Б. ![]()
* В.
Г.
Д. ![]()
Координационное число центрального атома
А. всегда равно числу связанных с ним лигандов
* Б. равно числу связанных с ним лигандов, если лиганды монодентатные
* В. не равно числу связанных с ним лигандов, если лиганды полидентатные
Г. равно числу связанных с ним лигандов, если лиганды полидентатные
Бидентатными могут быть лиганды
* А. ![]()
Б.
В.
* Г. ![]()
Число лигандов равно координационному числу центрального атома в комплексах
А. гемоглобин
Б. хлорофилл
* В. сульфат тетраамминмеди (II)
* Г. гексафтороалюминат (III) натрия
Координационное число железа в гемоглобине
А. 2
Б. 3
В. 4
* Г. 6
Д. 8
Биологические функции гемоглобина
* А. перенос кислорода, координированного железом, из легких мышцам
Б. перенос метаболического , координированного железом, в легкие
* В. перенос метаболического , связанного с концевыми аминогруппами, в легкие
Г. перенос кислорода, связанного с концевыми аминогруппами, из легких мышцам
Гемоглобин – комплексное соединение
А. ![]() с монодентатными лигандами
с монодентатными лигандами
Б. ![]() с монодентатными лигандами
с монодентатными лигандами
В. с бидентатным и тетрадентатным лигандами
* Г. с двумя монодентатными и одним тетрадентатным лигандами
Д. с двумя монодентатными и одним тетрадентатным лигандами
Хелатный эффект может проявляться в комплексных соединениях
А. с монодентатными лигандами
* Б. с полидентатными лигандами
* В. с порфириновыми лигандами
* Г. с комплексонами
Хелатный эффект
* А. приводит к повышению устойчивости комплексных соединений
Б. приводит к понижению устойчивости комплексных соединений
В. не влияет на устойчивость комплексных соединений
К аквакомплексам относятся
* А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Катионные комплексы
А. ![]()
* Б. ![]()
* В. ![]()
Г. ![]()
Ацидокомплексы
А. ![]()
* Б. ![]()
* В. ![]()
* Г. ![]()
Названию сульфат тетраамминмеди (II) соответствует формула
* А. ![]()
Б. ![]()
В. ![]()
Соединение
 называется
называется
А. гексацианоферрат(II) калия
* Б. гексацианоферрат(III) калия
Заряд комплексного иона
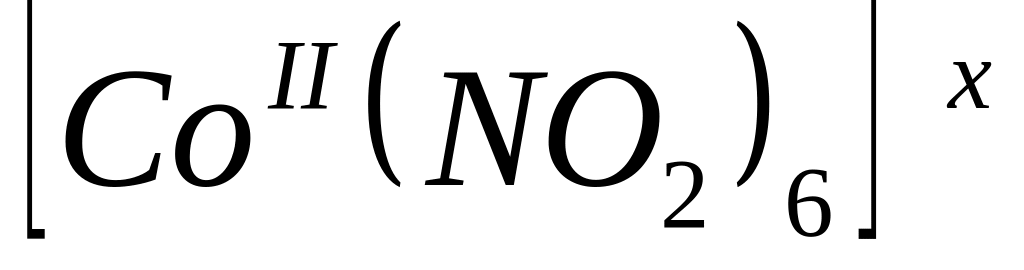 равен
равен
А. 0
Б. 2-
* В. 4-
Г. 2+
Д. 4+
Координационное число центрального атома в комплексном соединении
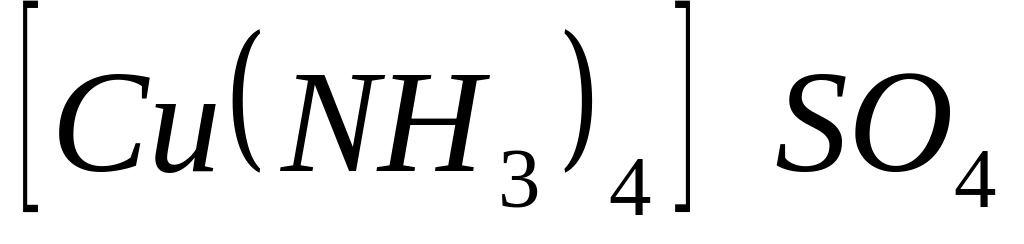 равно
равно
А. 8
Б. 6
В. 5
* Г. 4
Д. 2
Если координационное число иона комплексообразователя
 равно двум, то его аммиачный и цианидный
комплексы
равно двум, то его аммиачный и цианидный
комплексы
А. катионные
Б. нейтральные
В. анионные
Г. анионный и катионный соответственно
* Д. катионный и анионный соответственно
Координационные числа центральных атомов в комплексных соединениях
 ,
,
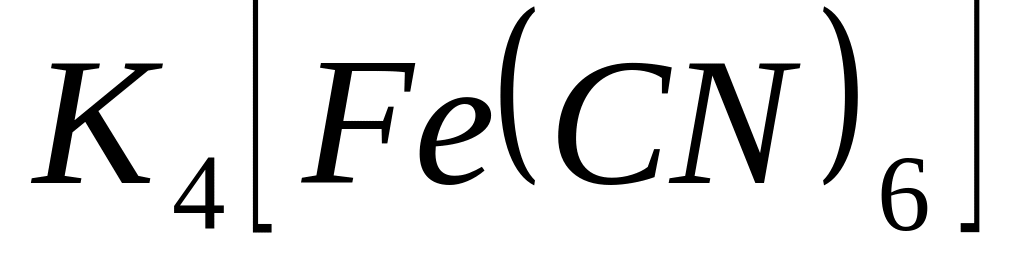 и
и
 равны
равны
* А. двум, шести и четырем соответственно
Б. четырем, шести и четырем соответственно
В. двум, шести и восьми соответственно
Одинаковые степени окисления имеет железо в комплексных соединениях
* А. гемоглобин и
Б. гемоглобин и
В. и
Медь может образовывать
А. только катионные комплексы
Б. только анионные комплексы
* В. катионные и анионные комплексы
В формировании внутренней сферы комплексного соединения
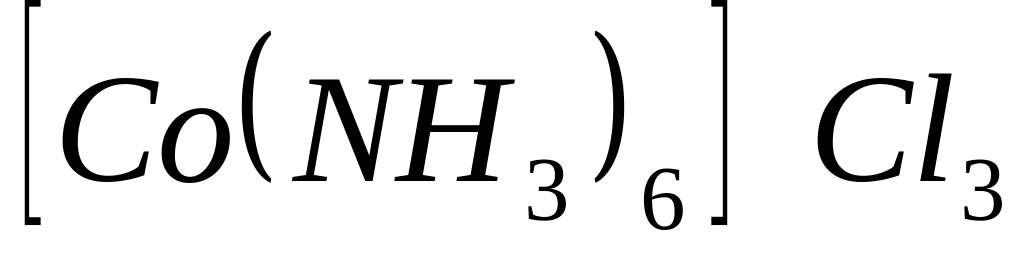 участвуют частицы
участвуют частицы
А.
* Б. ![]()
* В.
Г.
В комплексном соединении
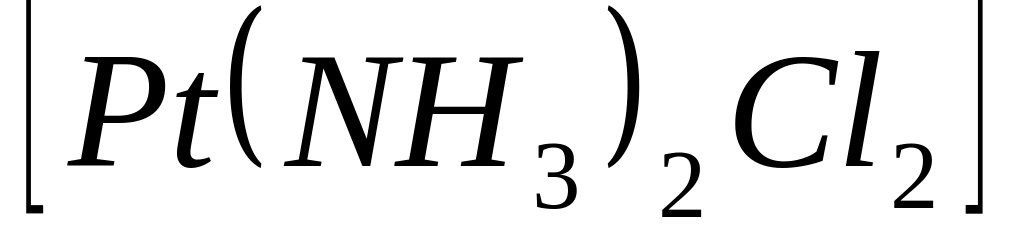 степень окисления центрального атома
равна
степень окисления центрального атома
равна
А. +6
Б. +4
* В. +2
Г. 0
В результате растворения хлорида серебра в аммиаке получается комплексное соединение
* А. хлорид диамминсеребра(I)
Б. хлорид тетраамминсеребра(I)
В. хлорид диаквасеребра(II)
* Г.
Д. ![]()
Галогениды серебра(I) и меди(I)
* А. не растворяются в воде
Б. растворяются в воде
* В. растворяются в аммиаке с образованием комплексных соединений
Г. не растворяются в аммиаке
Гидроксид меди(II) можно растворить
А. в воде
* Б. в аммиаке
* В. в кислотах
Г. в щелочах
Растворение оксида и гидроксида золота(III) в щелочи приводит к образованию
А. аквакомплексов золота(III)
* Б. гидроксокомплексов золота(III)
Токсическое действие растворимых солей меди связано со склонностью ионов
* А. к образованию нерастворимых хелатных соединений с белками-ферментами
Б. ускорять реакцию разложения супероксид-иона
В. к образованию ферментов-оксидаз
* Г. коагулировать белки
В составе цинкосодержащего фермента карбоангидразы ион
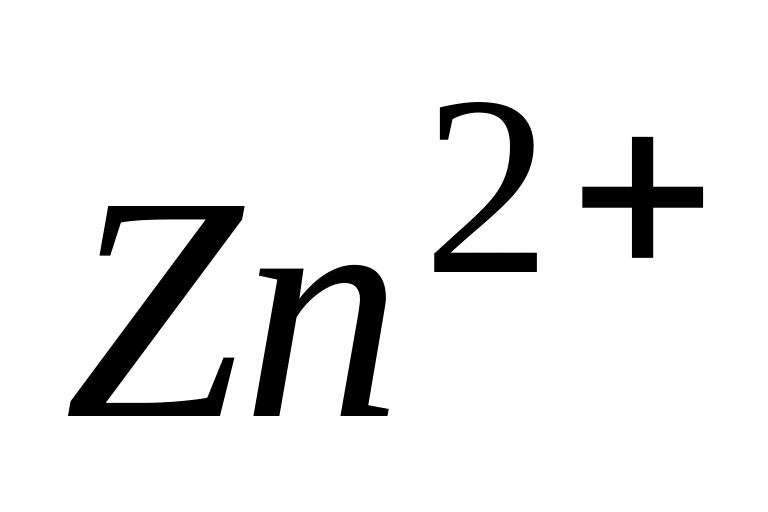 имеет координационное число, равное
имеет координационное число, равное
А. двум
* Б. четырем
В. шести
Г. восьми
В биокластерах центральный атом связан
* А. с донорными группировками макроциклических лигандов внутри полости кластера
Б. с донорными группировками макроциклических лигандов снаружи кластера
В. с акцепторными группировками макроциклических лигандов внутри полости кластера
Г. с акцепторными группировками макроциклических лигандов снаружи кластера
Комплексные соединения меди(II) с аммиаком, этилендиамином и порфирином
* А. имеют одинаковое квадратное строение
Б. разное строение
* В. сходную электронную конфигурацию
Г. различные электронные конфигурации
В результате первичной диссоциации в растворе комплексной соли
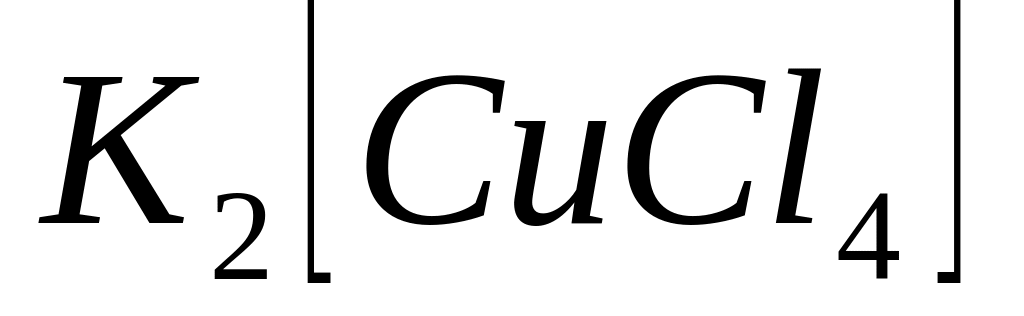 присутствуют ионы
присутствуют ионы
* А. ![]()
Б.
В.
* Г. ![]()
Иодид ртути(II) растворяется в избытке KI с образованием
* А. тетраиодомеркурата (II) калия
* Б. ![]()
В. ![]()
Г. гексаиодомеркурата (II) калия
В результате обменной реакции между гексацианоферратом(II) калия и сульфатом меди в осадок выпадает комплексное соединение
А. ![]()
* Б. ![]()
В. ![]()
Возможный продукт гипотетической реакции комплексообразования
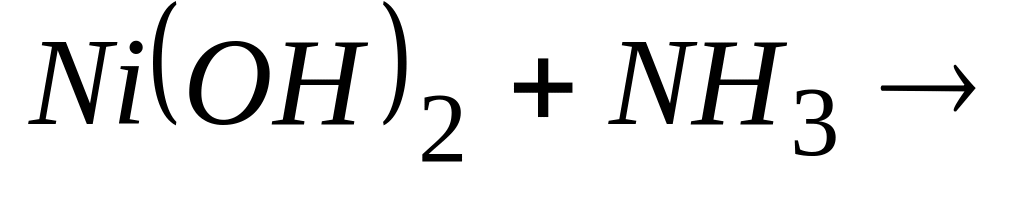
* А. ![]()
Б. ![]()
В. ![]()
Г. ![]()
При растворении золота в царской водке образуется соединение с комплексным ионом
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Цианид железа(II) растворяется в цианиде калия по схеме
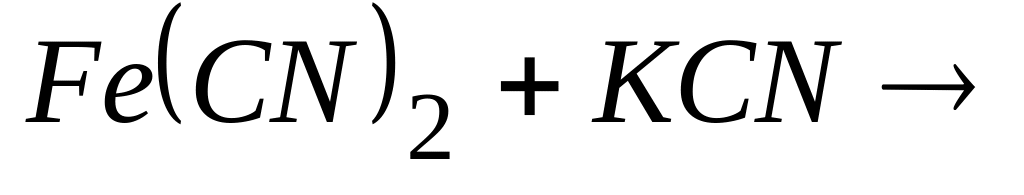 с образованием
с образованием
А. гексацианоферрата(III) калия
* Б. гексацианоферрата(II) калия
* В.
Г. ![]()
* Д. желтой кровяной соли
Если координационное число центрального атома равно 6, то в результате реакции
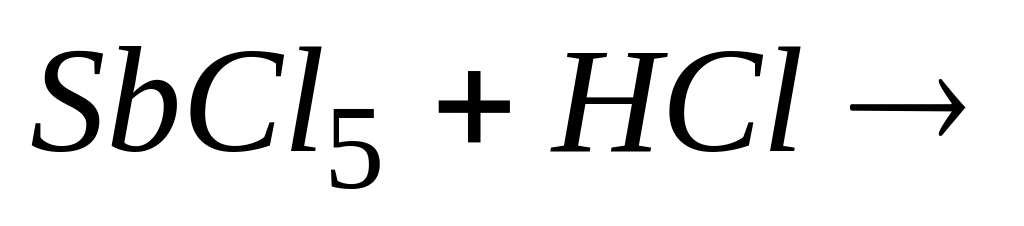 получается комплексное соединение с
комплексным
получается комплексное соединение с
комплексным
А. катионом
* Б. анионом
Берлинская лазурь получается при взаимодействии
* А. ионов и желтой кровяной соли
Б. ионов и желтой кровяной соли
В. ионов и красной кровяной соли
При одинаковых молярных концентрациях наибольшую электропроводность имеет раствор
А. ![]()
* Б. ![]()
В. ![]()
При одинаковых молярных концентрациях наибольшее число частиц в растворе комплексного соединения
* А. ![]()
Б. ![]()
В. ![]()
Если в растворе соли состава
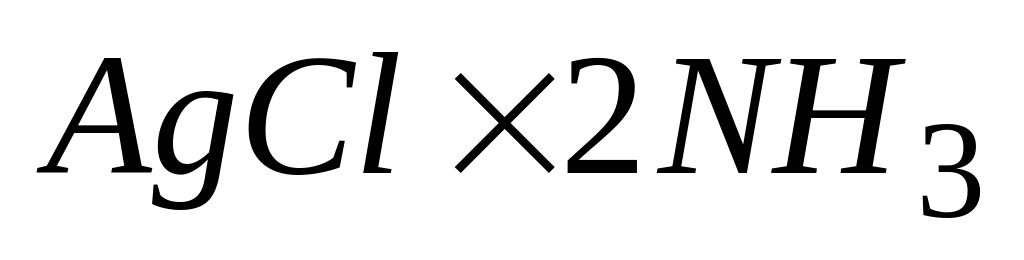 не
обнаружено свободного аммиака и ионов
серебра, а ион хлора осаждается нитратом
серебра, то координационная формула
соли
не
обнаружено свободного аммиака и ионов
серебра, а ион хлора осаждается нитратом
серебра, то координационная формула
соли
* А. ![]()
Б. ![]()
В. ![]()
Если из раствора комплексной соли состава
 нитрат серебра осаждает весь хлор, то
координационная формула соли
нитрат серебра осаждает весь хлор, то
координационная формула соли
А. ![]()
* Б. ![]()
В. ![]()
Из водного раствора комплексной соли
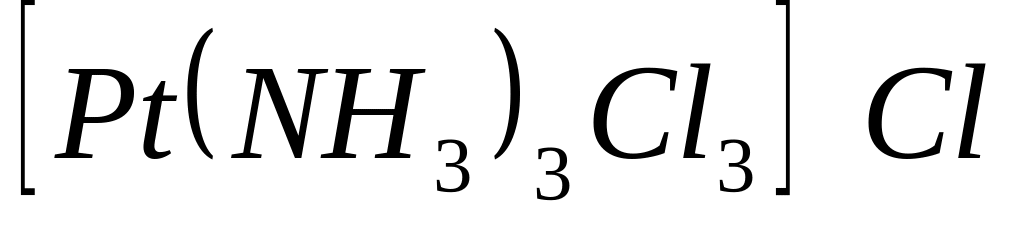 нитратом серебра
нитратом серебра
А. осаждается 3/4 хлорид-ионов, содержащихся в комплексной соли
* Б. осаждается 1/4 хлорид-ионов, содержащихся в комплексной соли
В. осаждаются все хлорид-ионы
Если соединение
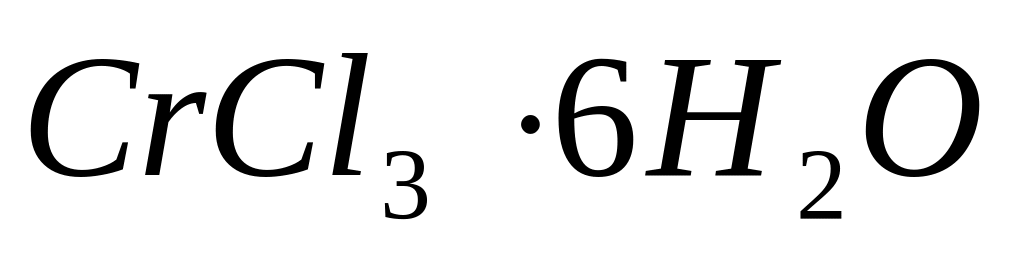 не изменяет своего состава при
дегидратации серной кислотой, а при
действии на его раствор избытка нитрата
серебра осаждается 3 моль AgCl на 1 моль
соединения, то его координационная
формула
не изменяет своего состава при
дегидратации серной кислотой, а при
действии на его раствор избытка нитрата
серебра осаждается 3 моль AgCl на 1 моль
соединения, то его координационная
формула
А ![]()
Б. ![]()
* В.
В растворе комплексной соли
 присутствуют ионы
присутствуют ионы
* А.
Б.
В.
Г. ![]()
* Д. ![]()
В результате первичной диссоциации одного моль гексацианоферрата (II) калия в растворе образуется
А. три моль ионов калия и один моль ионов гексацианоферрата (II)
* Б. четыре моль ионов калия и один моль ионов гексацианоферрата (II)
* В. пять моль ионов
Г. четыре моль ионов
Д. одиннадцать моль ионов
В растворе комплексной соли качественной реакцией с тиоцианатом калия наличие ионов обнаружить
* А. нельзя
Б. можно
Общая константа нестойкости комплексного иона
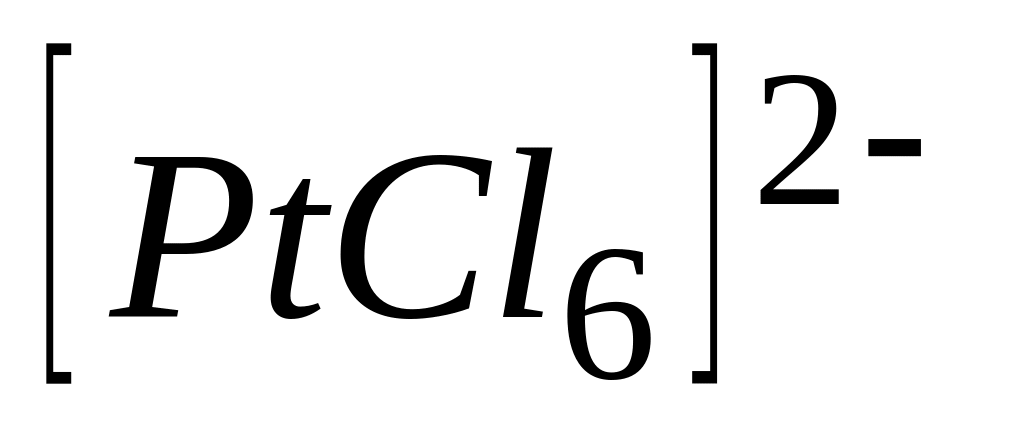 рассчитывается
по уравнению
рассчитывается
по уравнению
А. 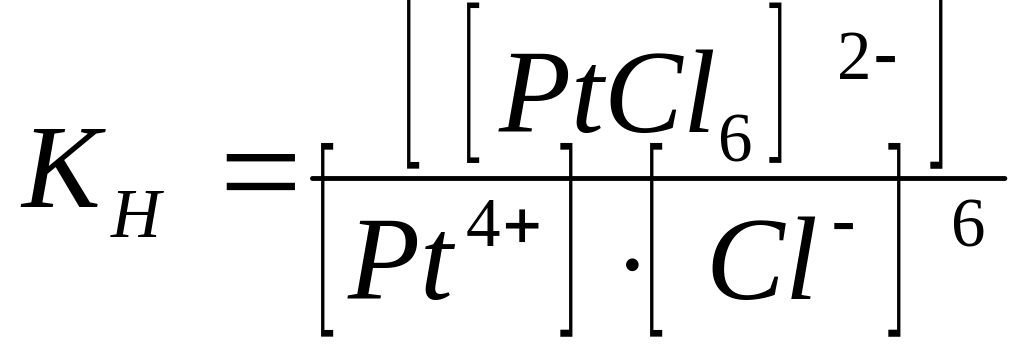
Б. 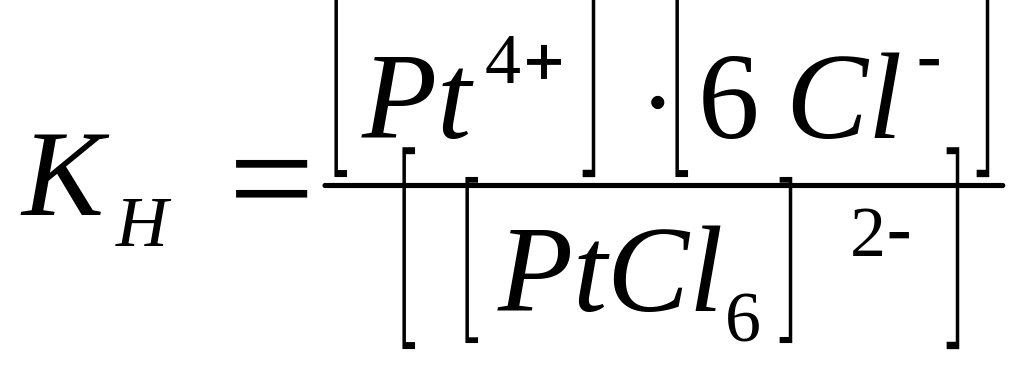
В. 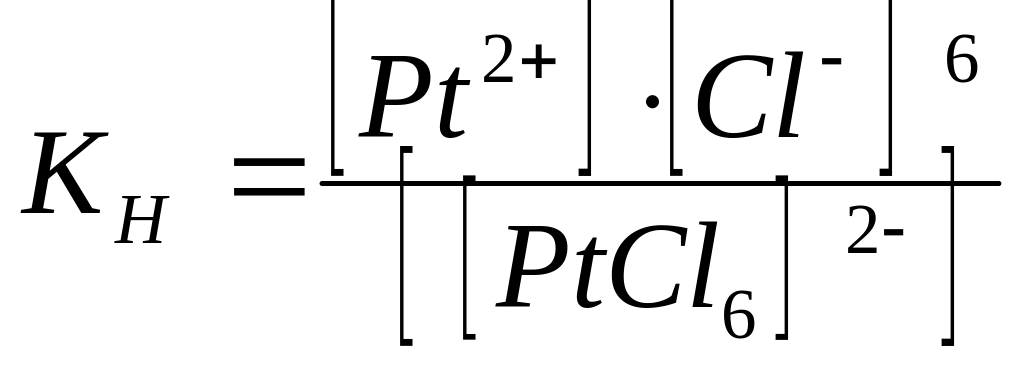
* Г. 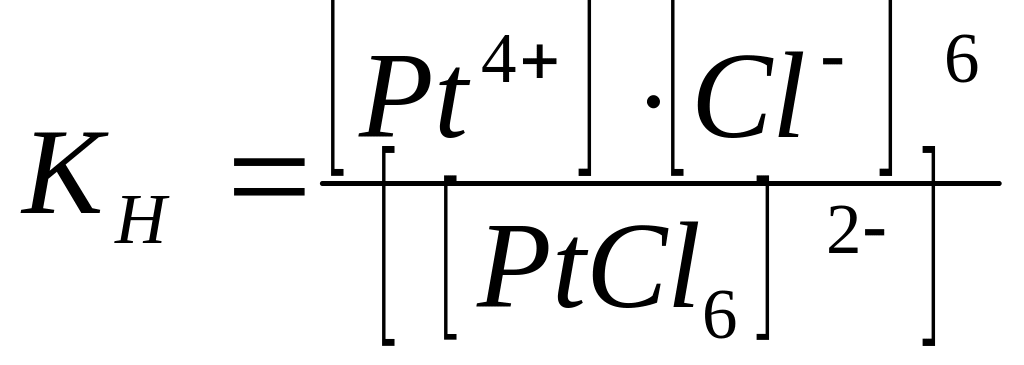
Константа нестойкости характеризует
* А. термодинамическую устойчивость комплекса
* Б. прочность связи между центральным атомом и лигандами
В. прочность связи между внутренней и внешней сферами комплексного соединения
Чем ниже значение константы нестойкости комплекса, тем
А. он менее устойчив
* Б. он более устойчив
* В. более прочной является связь между центральным атомом и лигандами
Г. менее прочной является связь между центральным атомом и лигандами
Если
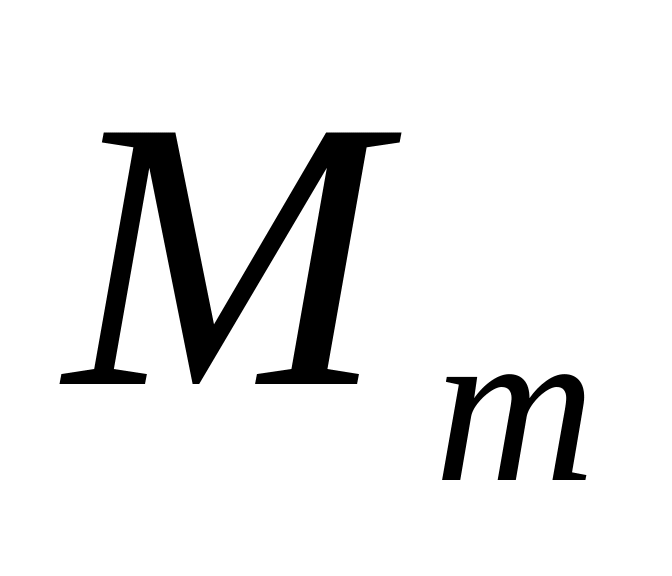 – тяжелый металл,
– тяжелый металл,
 –
биогенный металл,
–
биогенный металл,
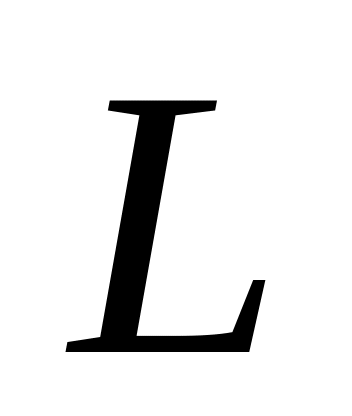 –
лиганд, то токсическое действие тяжелых
металлов на организм обусловлено
–
лиганд, то токсическое действие тяжелых
металлов на организм обусловлено
* А. большей
прочностью комплекса
![]() по сравнению с
по сравнению с
![]()
Б. меньшей прочностью комплекса по сравнению с
В. протеканием
реакции
![]()
* Г. протеканием
реакции
![]()
Использование в медицинской практике комплексонов (ЭДТА, трилон Б) основано на том, что они образуют
* А. более
прочные комплексы с ионами
![]() ,
,
![]() ,
,
![]() ,
чем комплексы этих ионов с тиогруппами
белков
,
чем комплексы этих ионов с тиогруппами
белков
Б. менее прочные комплексы с ионами , , , чем комплексы этих ионов с тиогруппами белков
* В. с ионами , , комплексы с малыми константами нестойкости
Г. с ионами , , комплексы с большими константами нестойкости
Деминерализующее действие натриевой соли ЭДТА на зубную эмаль связано с
* А. протеканием
реакции
![]()
Б. протеканием
реакции
![]()
* В. образованием
более прочного чем
![]() ,
комплексоната
,
комплексоната
![]()
Г. образованием менее прочного чем , комплексоната
В комплексонате
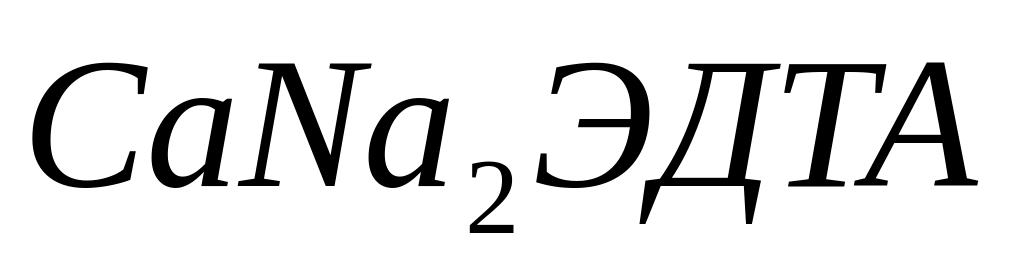 ион
ион
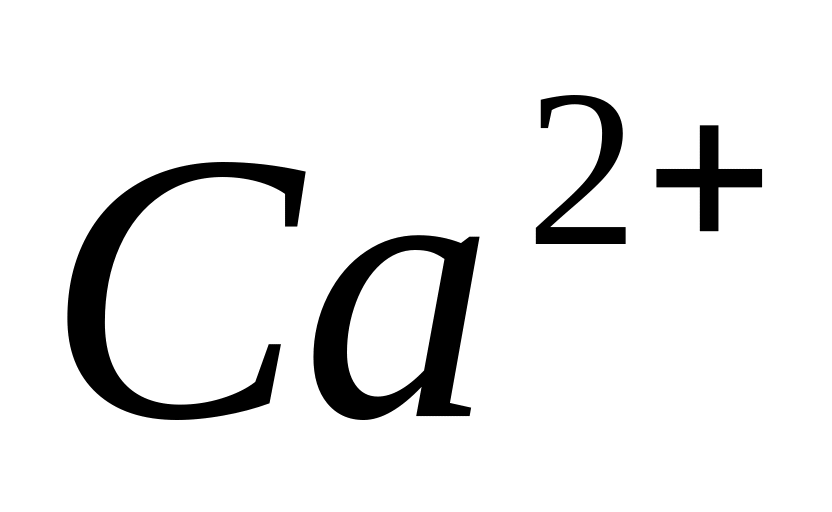 может замещаться на ионы
может замещаться на ионы
А.
* Б.
* В. ![]()
Г.
С увеличением кислотности среды устойчивость комплексного иона
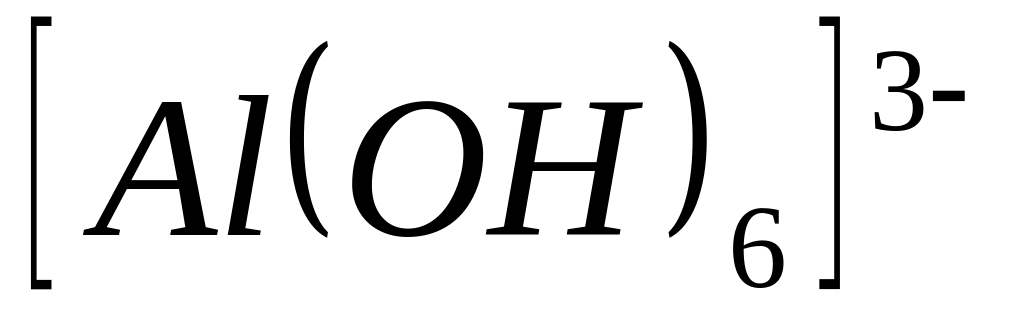
А. возрастает
* Б. уменьшается
В. не изменяется
При увеличении рН в растворе тетрагидроксоцинката(II) натрия концентрация комплексных ионов
* А. увеличивается
Б. уменьшается
В. не изменяется
Концентрация свободных катионов меди в растворе при пропускании аммиака
А. увеличивается
* Б. уменьшается
В. не изменяется
При одинаковых молярных концентрациях растворов концентрация свободных катионов серебра больше в растворе соли
А.
Б. ![]()
* В. ![]()
Г. ![]()
Если при взаимодействии одного моля комплексной соли с избытком нитрата серебра осаждается два моля хлорида серебра, то этим комплексным соединением может быть
А. хлорид тетраамминдихлорокобальт(III)
Б. триамминтрихлорокобальт(III)
* В. хлорид пентаамминхлорокобальт(III)
В 1 моль соединения
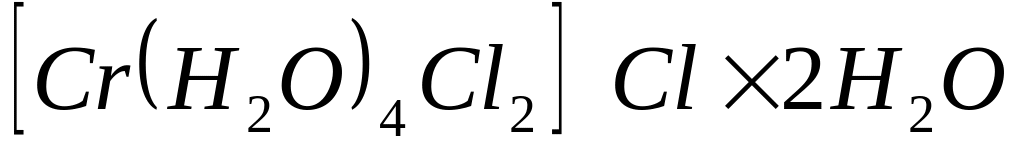 кристаллизационной воды содержится
кристаллизационной воды содержится
* А. 2 моль
Б. 4 моль
В. 6 моль
Если значения констант нестойкости комплексных ионов
 и
и
 примерно одинаковы, то в растворах
одинаковой молярной концентрации
примерно одинаковы, то в растворах
одинаковой молярной концентрации
А. ![]() >
>
![]()
Б. ![]()
* В. <
Если комплексный ион
 более устойчив, чем
более устойчив, чем
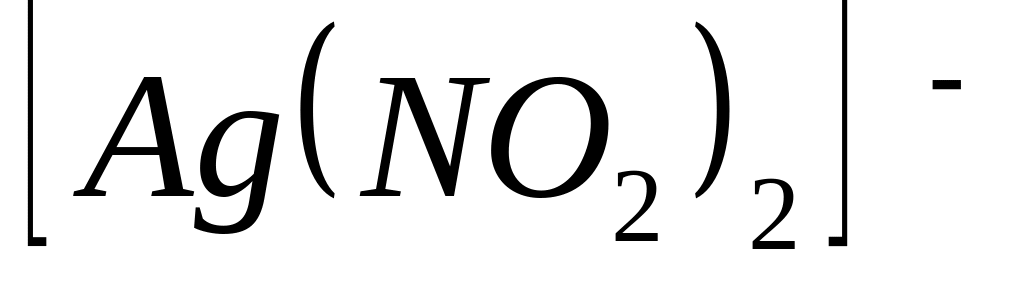 ,
то справедливо неравенство
,
то справедливо неравенство
А. ![]() >
>![]()
* Б. <
Если константа нестойкости иона
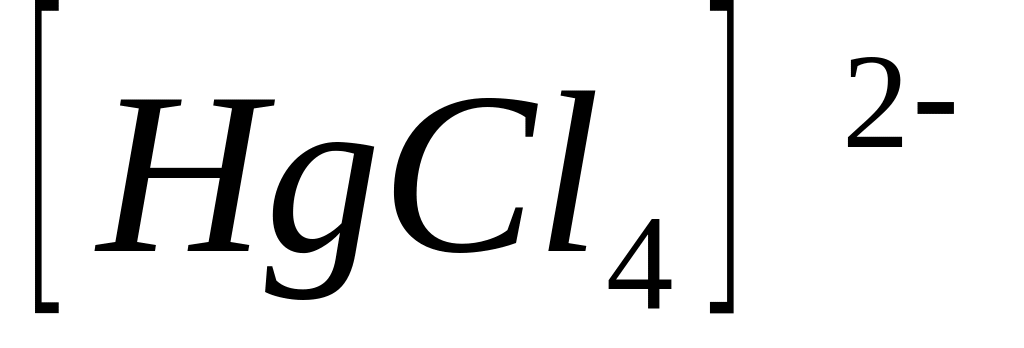 больше, чем константа нестойкости иона
больше, чем константа нестойкости иона
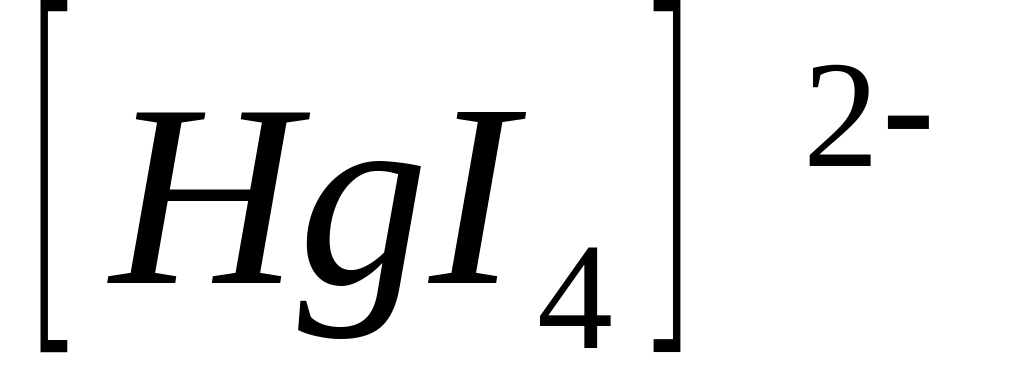 ,
то при одинаковых молярных концентрациях
комплексов свободных катионов ртути
больше в растворе
,
то при одинаковых молярных концентрациях
комплексов свободных катионов ртути
больше в растворе
* А.
Б. ![]()
Изомерами являются
А. и
Б. ![]() и
и
![]()
* В.
и
![]()
* Г. ![]() и
и
![]()
* Д. ![]() и
и
![]()
Соединения
 и
и
 отличаются
отличаются
А. координационными числами центрального атома
* Б. распределением молекул воды между внутренней и внешней сферами
* В. распределением ионов хлора между внутренней и внешней сферами
Г. степенью окисления центрального атома
Из раствора комплексной соли

А. можно
осадить ионы
![]() действием нитрата серебра
действием нитрата серебра
* Б. нельзя осадить ионы действием нитрата серебра
* В. можно осадить ионы действием хлорида бария
Г. нельзя осадить ионы действием хлорида бария
Реакции, в которых происходит обмен внешнесферными ионами, протекают между веществами
* А. ![]() и
и
* Б. ![]() и
и
![]()
В. ![]() и
и
![]()
Г. ![]() и Cl2
и Cl2
Д. ![]() и
и
![]()
Первичная диссоциация комплексных соединений показана в схемах
А. ![]()
Б. ![]()
* В. ![]()
* Г. ![]()
В результате первичной диссоциации одного моль хлорида тетраамминмеди (II) в растворе образуется
А. 1моль ионов и 1моль ионов тетраамминмеди (II)
* Б. 2моль ионов и 1моль ионов тетраамминмеди (II)
В. 1моль ионов и 2моль ионов тетраамминмеди (II)
Г. 2моль ионов
* Д. 3моль ионов
При одинаковой молярной концентрации в результате первичной диссоциации общее число ионов больше в растворе
* А. желтой кровяной соли
Б. красной кровяной соли
В. гексацианоферрата (III) калия
* Г. гексацианоферрата (II) калия
Вторичная диссоциация – это
* А. диссоциация комплексного иона
Б. диссоциация комплексного соединения на внутреннюю и внешнюю сферу
* В. диссоциация внутренней сферы
Г. диссоциация внешней сферы
Уравнение, отражающее вторичную диссоциацию комплексного соединения
* А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Схема отражает
А. первичную диссоциацию комплексного иона
* Б. вторичную диссоциацию комплексного иона
В. ступенчатую диссоциацию комплексного иона
* Г. полную диссоциацию комплексного иона
Реакция
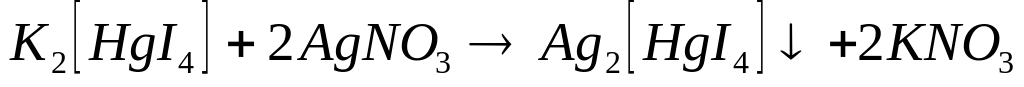 свидетельствует
свидетельствует
* А. о высокой устойчивости комплексного иона
* Б. о высокой прочности связи между комплексообразователем и лигандами
В. о небольшой прочности связи между комплексообразователем и лигандами
* Г. о легкости первичной диссоциации тетраиодомеркурата(II) калия
