
- •Тестовые задания
- •Содержание
- •Глава 1. Строение атома
- •Глава 2. Химическая связь
- •Глава 5. Способы выражения концентрации растворов
- •Минерализующая функция слюны связана с ее пересыщенностью по ионам
- •Глава 11. Окислительно-восстановительные реакции
- •Глава 12. Адсорбция. Поверхностные явления
- •Глава 14. Органическая химия.
- •Для получения из бензола м-нитротолуола
- •Литература
- •Учебное издание
- •Тестовые задания
- •Издается в авторской редакции
Глава 5. Способы выражения концентрации растворов
Массовая доля растворенного вещества в растворе может принимать значения
А. 150%
Б. 100%
В. 0%
* Г. 10%
* Д. 15%
Массовая доля вещества в растворе показывает
А. число молей растворенного вещества в 1 л раствора
Б. число молей растворенного вещества в 10 г раствора
* В. число граммов растворенного вещества в 100 граммах раствора
Г. число граммов растворенного вещества в 100 граммах растворителя
Физиологический (0,89%) раствор хлорида натрия содержит
* А. 0,89 г в 100 г раствора
Б. 0,89 г в 100 г воды
* В. 0,89 г в 99.11 г воды
Г. 8,9 г в 100 г раствора
* Д. 8,9 г в 1000 г раствора
Водный раствор гидроксида натрия с массовой долей 0,5 содержит
* А. одинаковые массы гидроксида натрия и воды
Б. воды вдвое больше (по массе), чем гидроксида натрия
В. воды вдвое меньше (по массе), чем гидроксида натрия
* Г. в 100 г раствора 50 г гидроксида натрия
Раствор, содержащий 50г глюкозы и 200г воды, имеет массовую долю
А. 0,80
Б. 0,40
В. 0.25
* Г. 0.20
После добавления 300 г воды к 100 г 10 мас.% раствора его концентрация
А. уменьшилась в 3 раза
* Б. уменьшилась в 4 раза
В. увеличилась в 4 раза
Г. стала равной 3,3%
* Д. стала равной 2,5%
Для получения 10 мас.% раствора
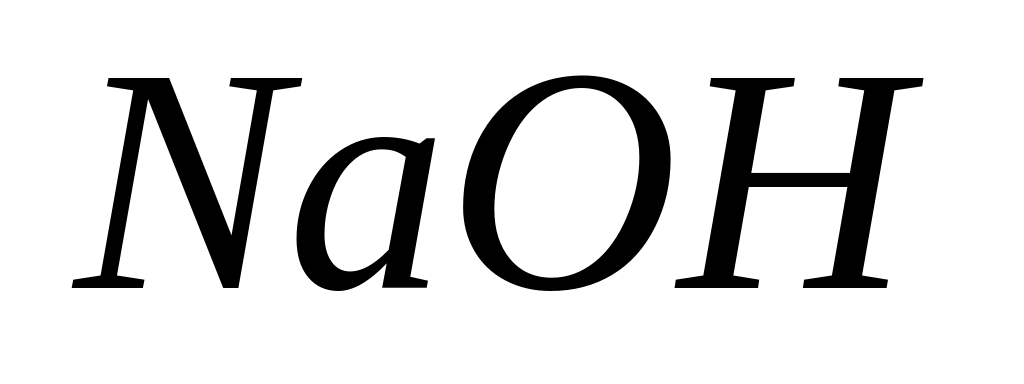 к
300г воды необходимо добавить 30 мас.%
раствора
:
к
300г воды необходимо добавить 30 мас.%
раствора
:
А. 200 г
* Б. 150 г
В. 100 г
Г. 50 г
Раствор, содержащий 0,25 моль и 5 моль
 ,
имеет массовую долю растворенного
вещества
,
имеет массовую долю растворенного
вещества
А. 0,50
Б. 0,33
В. 0.11
* Г. 0,10
Д. 0.05
После разбавления вдвое 100г раствора, содержащего 0,1 моль , его массовая доля стала равна
А. 0,20
Б. 0,05
* В. 0,02
Г. 0.005
Из 10г хлорида натрия можно приготовить 10 мас.% раствора
* А. вдвое больше, чем 20мас.% раствора
Б. вдвое меньше, чем 20мас.% раствора
В. столько же, сколько и 20мас.% раствора
Из 10г глюкозы можно приготовить физиологического (5 мас.%) раствора
А. 2 литра
Б. 2 кг
* В. 200 г
Г. 50 г
Для получения 10 мас.% раствора к 90г вещества необходимо добавить воды
А. 10г
Б. 90г
* В. 810г
Г. 800г
Д. 1000г
Размерность молярной концентрации
А. моль/кг
* Б. моль/л
В. моль/100г
Г. г/мл
Децимолярный раствор соляной кислоты содержит
А. 1 моль в 1 л раствора
Б. 0,1 г в 1 л раствора
В. 0,1 моль в 1 л воды
* Г. 0,1 моль в 1 л раствора
В 100 мл сантимолярного раствора
 содержится
содержится
А. 0,01 моль
* Б. 0,001 моль
В. 0,56 г
* Г. 0,056 г
Д. 5,6 г
Массы растворенного вещества в одинаковых объемах децимолярных растворов хлорида натрия и бромида натрия
А. одинаковы
* Б. не одинаковы
Число моль растворенного вещества в одинаковых объемах децимолярных растворов хлорида натрия и бромида натрия
* А. одинаковы
Б. не одинаковы
После разбавления 500 мл одномолярного раствора серной кислоты водой до 1 л концентрация раствора стала равной
А. 2 М
Б. 1 М
* В. 0,5 М
Г. 0,1 М
Децимолярный раствор объемом 500 мл разделили на две части – 300 мл и 200 мл. Концентрация в полученных растворах:
А. 0,06 М и 0,04 М соответственно
Б. 0,03 М и 0,02 М соответственно
* В. одинакова и составляет 0,1 М
Децимолярный раствор объемом 500 мл разделили на две части – 300 мл и 200 мл. Число моль в полученных растворах
А. 0,06 моль и 0,04 моль соответственно
* Б. 0,03 моль и 0,02 моль соответственно
В. одинаково и составляет 0,1 моль
Численное значение молярной концентрации при повышении температуры
А. не изменяется
Б. увеличивается
* В. уменьшается
Численное значение моляльной концентрации при повышении температуры
* А. не изменяется
Б. увеличивается
В. уменьшается
Если известны массы растворенного вещества и растворителя, то для расчета молярной концентрации численное значение плотности раствора
* А. необходимо знать
Б. не обязательно знать
Численные значения молярной и эквивалентной концентраций
А. всегда совпадают
Б. никогда не совпадают
* В. могут совпадать и не совпадать
Численные значения молярной и эквивалентной концентраций совпадают для растворов
* А. азотной кислоты
* Б. гидроксида натрия
В. серной кислоты
Г. фосфорной кислоты
Д. сульфата алюминия
Для расчета молярной и эквивалентной концентраций раствора сульфата меди используют формулы
А.
![]()
* Б.
![]()
В.
![]()
* Г.
![]()
Д.
![]()
Масса растворенного вещества в одинаковых объемах децимолярных растворов сульфата меди и сульфата алюминия
А. одинакова
* Б. не одинакова
Масса сульфата натрия в одинаковых объемах его сантимолярного и сантинормального растворов
А. одинакова
* Б. не одинакова
Для приготовления 1л 0,2н раствора серной кислоты необходимо взять 2м раствора
* А. 0,05л
Б. 0,1л
В. 0,2л
Г. 100мл
* Д. 50мл
Для децимолярных растворов хлорида натрия и бромида натрия, в предположении, что их плотности одинаковы, верно соотношение
А.
![]()
Б.
![]()
* В.
![]()
Для децимолярных растворов серной и ортофосфорной кислоты, в предположении, что их плотности одинаковы, верно соотношение
* А.
![]()
Б.
![]()
В.
![]()
Число моль HCl в 100г 36,5масс.% раствора
А. 36,50
Б. 0,36
В. 2,00
* Г. 1,00
Д. 0,1
Растворы серной кислоты и гидроксида натрия одинаковой эквивалентной концентрации реагируют между собой в объемном отношении
* А. 1:1
Б. 2:1
В. 1:2
Растворы серной кислоты и гидроксида натрия одинаковой молярной концентрации реагируют между собой в объемном отношении
* А. 1:2
Б. 2:1
В. 1:1
Объемы реагирующих растворов
А. прямо пропорциональны их молярным концентрациям
Б. прямо пропорциональны их эквивалентным концентрациям
* В. обратно пропорциональны их эквивалентным концентрациям
Г. обратно пропорциональны их массовым долям
Однонормальный раствор гидроксида бария является
А. одномолярным
Б. двумолярным
* В. пятьдецимолярным
Одномолярный раствор ортофосфорной кислоты является
А. однонормальным
* Б. трехнормальным
В. трехдецинормальным
Титр раствора показывает
А. массу растворенного вещества в 1 л раствора
Б. массу растворенного вещества в 100 г раствора
В. массу растворенного вещества в 100 мл раствора
* Г. массу растворенного вещества в 1 мл раствора
Для децимолярных растворов серной и ортофосфорной кислоты, в предположении, что их плотности одинаковы, верно соотношение
* А.
![]()
Б.
![]()
В.
![]()
Для децинормальных растворов серной и ортофосфорной кислоты, в предположении, что их плотности одинаковы, верно соотношение
А.
* Б.
В.
Титр прямо пропорционален
* А. массе растворенного вещества
* Б. эквивалентной концентрации раствора
В. объему раствора
Моляльная концентрация имеет размерность
А. моль/л
* Б. моль/кг
В. моль/100г
Г. г/мл
В децимоляльном растворе 0,1 моль растворенного вещества содержится в
А. 1 л раствора
Б. 100 г раствора
В. 100 г растворителя
* Г. 1000г растворителя
Моляльность раствора, полученного растворением 0,1 моль сахарозы (М = 342 г/моль) в 1 кг воды:
* А. 0,1 моль/кг
Б. 0,096 моль/кг
В. 0,0342 г/мл
Г. 3,42 г/кг
Д. 34,2 г/кг
При определении молярных масс криоскопическим или эбулиоскопическим методом используют
А. молярную концентрацию
* Б. моляльную концентрацию
В. массовую долю
Г. титр
Способ выражения концентрации – мольная доля
* А. безразмерная величина
Б. имеет размерность моль/л
В. имеет размерность моль/кг
Г. имеет размерность г/мл
Мольная доля NaOH в растворе, содержащем 20г NaOH и 90г воды, составляет
А. 2/9
Б. 2/11
В. 1/10
* Г. 1/11
Д. 1/2
Изменение температуры не влияет на величину
А. эквивалентной концентрации
Б. молярной концентрации
* В. моляльной концентрации
Г. титра
* Д. мольной доли
При изменении температуры меняются численные значения:
* А молярной концентрации
Б. моляльной концентрации
* В. эквивалентной концентрации
Г. массовой доли
* Д. титра
Если в 1 л раствора сульфата натрия содержится 4 моль катионов натрия, то молярная концентрация сульфата натрия в растворе
А. 8 М
Б. 4 М
* В. 2 М
Г. 1 М
В 1 л децимолярного раствора хлорида алюминия всего ионов
А. 0,1 моль
Б. 4 моль
В. 0,2 моль
* Г. 0,4 моль
При диссоциации хлорида меди(II) в 1 л раствора образовалось 0,06 моль ионов, следовательно, молярная концентрация хлорида меди в растворе
А. 0,06 М
Б. 0,03 М
* В. 0,02 М
Молярная концентрация сульфат-ионов в децимолярном растворе сульфата алюминия
А. 0,1 М
Б. 0,2 М
* В. 0,3 М
Г. 0,5 М
Д. 0,6 М
Количество всех ионов в децимолярном растворе сульфата алюминия
А. 0,1 моль-ион/л
Б. 0,2 моль-ион/л
В. 0,3 моль-ион/л
* Г. 0,5 моль-ион/л
Д. 0,6 моль-ион/л
Из перечисленных растворов концентрация ионов больше в
А. 0,1 М растворе
* Б. 0,1 М растворе
В.
0,1 М растворе
![]()
Концентрации ионов в слюне 2,5 ммоль/л соответствует содержание
А. 2,5 мг/л
Б. 0,25 мг/дл
В. 100 мг/дл
* Г. 10 мг/дл
Концентрации ионов
 в плазме крови 142 ммоль/л, соответствует
содержание ионов
в плазме крови 142 ммоль/л, соответствует
содержание ионов
* А. 3,27 г/л
Б. 0,142 г/л
В. 14,2 мг/дл
* Д. 327 мг/дл
Содержание магния выше 21.6 мг/дл в крови может привести к глубокому наркозу, следовательно, пороговая величина концентрации магния в крови составляет
А. 216 ммоль/л
Б. 21,6 ммоль/л
* В. 9 ммоль/л
Г. 0,9 ммоль/л
В норме содержание ионов
 составляет 16-19мг в 100г сыворотки крови
(плотность 1,025г/мл). Концентрация ионов
(ммоль/л)
составляет 16-19мг в 100г сыворотки крови
(плотность 1,025г/мл). Концентрация ионов
(ммоль/л)
А. 16-19
* Б. 4,2-5,0
В. 1,6-1,9
Г. 42-50
Д. 0,16-0,19
Содержание активного кальция в слюне составляет
 г/л. Это соответствует концентрации
:
г/л. Это соответствует концентрации
:
* А.
![]() моль/л
моль/л
* Б.
![]() ммоль/л
ммоль/л
В. моль/л
Г.
![]() ммоль/л
ммоль/л
Содержание однозамещенного фосфата в слюне составляет 0.146 г/л. Это соответствует концентрации
А. 146 мг/дл
* Б. 14,6 мг/дл
* В. 0,146 мг/мл
* Г. 146 мг/л
Концентрация кальция, связанного с белками в слюне, составляет 0.17 ммоль/л. Это соответствует содержанию кальция
* А. 6,8 мг/л
Б. 6,8 г/л
* В. 0,68 мг/дл
Г. 68 мг/дл
Среднее содержание фтора в зубном налете составляет 6 мг/кг. Если в 1 г зубного налета содержится 0,004 ммоль фтора, то
* А. фтор в избытке
Б. фтор в норме
В. фтор в недостатке
При pH = 7.25 концентрация гидрофосфат-иона в слюне составляет
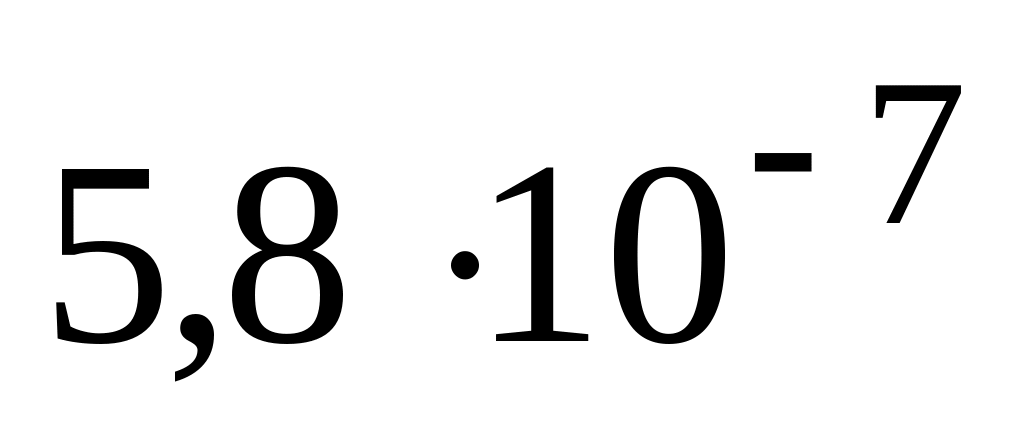 моль/л,
что соответствует его концентрации в
мкмоль/л
моль/л,
что соответствует его концентрации в
мкмоль/л
А. 580
Б.
![]()
* В. 0,58
Г.
![]()
5 мл раствора с концентрацией 100 ммоль/л разбавили водой до 100 мл. Концентрация кальция в полученном растворе составляет
* А. 5 ммоль/л
Б. 2000 ммоль/л
В. 100 ммоль/л
Из 5 мл 1 М раствора децимолярного раствора можно приготовить:
А. 30 мл
Б. 40 мл
* В. 50 мл
Г. 60 мл
Для нейтрализации раствора, содержащего 9,8 г серной кислоты, необходимо взять:
А. 2 г
Б. 4 г
В. 4,9 г
* Г. 8г
Для нейтрализации раствора, содержащего 9,8 г серной кислоты необходимо взять децинормального раствора :
* А. 2 л
Б. 2 мл
В. 1 л
Г. 1 мл
Д. 0,5 л
Если на нейтрализацию 10 мл раствора щелочи израсходовано 5 мл раствора кислоты, то эквивалентная концентрация кислоты
* А. в 2 раза больше, чем щелочи
Б. в 2 раза меньше, чем щелочи
В. равна концентрации щелочи
Г лава 6. Растворы неэлектролитов
Растворы - это системы
* А. гомогенные
Б. гетерогенные
В. обязательно постоянного состава
* Г. переменного состава
Д. обязательно жидкие
В состав раствора входят
А. один компонент
* Б. два или более компонента
В. два или более простых вещества
* Г. продукты взаимодействия компонентов раствора
* Д. не менее двух компонентов
Образование растворов сопровождается
А. только физическими процессами
Б. только химическими процессами
* В. физическими и химическими процессами
В истинных растворах частицы растворенного вещества
А. имеют размеры от 1 до 100 нм
* Б. имеют размеры менее 1нм
* В. представляют собой молекулы или ионы
Г. представляют собой агрегаты из атомов, молекул, ионов
О химическом взаимодействии между растворяемым веществом и растворителем свидетельствует
* А. тепловой эффект растворения
Б. диффузия частиц растворяемого вещества по объему растворителя
* В. уменьшение суммарного объема при взаимном растворении жидкостей
* Г. образование сольватов
В насыщенном растворе при данной температуре:
* А. устанавливается динамическое равновесие между процессами растворения и кристаллизации
* Б. содержится максимальное количество растворенного вещества
В. можно растворить дополнительное количество растворенного вещества
Г. преобладает процесс кристаллизации
Концентрация насыщенного раствора (растворимость) для данного вещества – величина постоянная
А. в данном растворителе при любой температуре
Б. в любом растворителе при любой температуре
В. в любом растворителе при данной температуре
* Г. в данном растворителе при данной температуре
Пересыщенный раствор представляет собой
* А. неустойчивую систему
Б. устойчивую систему
В. равновесную систему
* Г. неравновесную систему
Чтобы приготовить из насыщенного при 10ºС раствора нитрата калия ненасыщенный раствор, необходимо исходный раствор
А. охладить до 0ºС
* Б. нагреть до 20ºС
* В. разбавить в 2раза
Г. упарить в 2раза
При данной температуре пересыщенный раствор в отличие от насыщенного
А. термодинамически устойчив
* Б. термодинамически неустойчив
* В. стремится перейти в равновесное состояние за счет выпадения в осадок избытка растворенного вещества
Г. может растворить дополнительное количество растворяемого вещества
Идеальные растворы - это растворы, образование которых из компонентов
* А. не сопровождается изменением объема системы
Б. сопровождается изменением объема системы
* В. не сопровождается тепловым эффектом
Г. сопровождается тепловым эффектом
Насыщенный раствор может быть разбавленным для
А. легкорастворимого вещества
* Б. труднорастворимого вещества
Ненасыщенный раствор концентрированным
А. никогда не может быть
Б. может быть для труднорастворимого вещества
* В. может быть для легкорастворимого вещества
Растворимость вещества при данных условиях характеризует концентрация
* А. насыщенного раствора
Б. пересыщенного раствора
В. концентрированного раствора
Г. ненасыщенного раствора
Д. “крепкого” раствора
Растворимость зависит от
* А. природы растворителя и растворяемого вещества
Б. концентрации
* В. температуры
* Г. присутствия в растворе других веществ
Д. времени
Раствор, находящийся в равновесии с избытком растворяемого вещества при данных условиях, называется
А. пересыщенным
* Б. насыщенным
В. ненасыщенным
В воде хорошо растворимы
А. жиры
Б. эфиры
В. бензол
* Г. большинство солей
* Д. щелочи
Жиры хорошо растворимы в
А. жидком аммиаке
* Б. бензоле
* В. эфире
Г. воде
* Д. гексане
К гидрофильным группам относятся
* А. гидроксильная
Б. метиленовая
* В. карбоксильная
* Г. тиольная
Вещество, в состав которого одновременно входят и гидрофильные, и гидрофобные группы, называется
А. лиофильным
Б. лиофобным
* В. дифильным
В воде хорошо растворимы вещества
А. с ковалентными неполярными связями
* Б. с ковалентными полярными связями
* В. с ионными связями
В воде лучше растворимы вещества, содержащие
* А. гидрофильные группы
Б. гидрофобные группы
В. неполярные группы
* Г. полярные группы
Типы кристаллических решеток практически нерастворимых в воде веществ
* А. ковалентная (атомная)
Б. ионная
* В. молекулярная
* Г. металлическая
Вода является хорошим растворителем для веществ с ионной и ковалентной полярной связью, так как
* А. ее молекулы полярны
Б. она является слабым электролитом
В. она является сильным электролитом
* Г. ее молекулы обладают значительным дипольным моментом
* Д. растворение в воде сопровождается гидратацией
Практически не растворяются друг в друге
* А.
и
![]()
Б.
и
![]()
В. и
* Г.
и
![]()
В воде хорошо растворимы натриевые соли
А. пальмитиновой кислоты
Б. стеариновой кислоты
В. олеиновой кислоты
* Г. уксусной кислоты
* Д. муравьиной кислоты
В воде практически нерастворимы
А. натрий
* Б. графит
* В. сера
Г. аммиак
* Д. иод
Практически не смешиваются между собой
А. вода и глицерин
* Б. вода и четыреххлористый углерод
* В. вода и бензол
* Г. вода и жир
Д. вода и метанол
Вода и этанол при комнатной температуре и давлении 1атм неограниченно смешиваются друг с другом, так как
А. они находятся в одном агрегатном состоянии
Б. их молекулы имеют одинаковые форму и размеры
* В. их молекулы полярны
* Г. между ними возникают межмолекулярные водородные связи
При растворении глобулярных белков в воде
* А. их молекулы образуют компактные глобулярные структуры
Б. их молекулы образуют поверхностные пленки
* В. гидрофобные группы оказываются внутри глобулы, а гидрофильные - снаружи
Г. гидрофильные группы оказываются внутри глобулы, а гидрофобные - снаружи
Если твердое вещество при растворении в воде не образует с ней прочных соединений, то растворение сопровождается, как правило,
А. выделением теплоты
* Б. поглощением теплоты
Растворение
 в воде является эндотермическим
процессом, поэтому с увеличением
температуры растворимость нитрата
аммония
в воде является эндотермическим
процессом, поэтому с увеличением
температуры растворимость нитрата
аммония
А. уменьшается
* Б. увеличивается
В. практически не изменяется
Растворение в воде является экзотермическим процессом, поэтому с увеличением температуры растворимость гидроксида калия
* А. уменьшается
Б. увеличивается
В. практически не изменяется
Растворение газов в воде - экзотермический процесс, поэтому с увеличением температуры растворимость газов
* А. уменьшается
Б. увеличивается
В. практически не изменяется
При растворении газа в жидкости происходит значительное уменьшение объема системы, поэтому, в соответствии с принципом Ле-Шателье, при повышении давления растворимость газов
А. уменьшается
* Б. увеличивается
В. не изменяется
Закон Генри справедлив
А. для любых газов
* Б. для газов, которые не взаимодействуют с растворителем
В. при высоких давлениях
* Г. при невысоких давлениях
* Д. для малорастворимых газов
Закон Генри неприменим к процессам растворения в воде
А. кислорода
Б. азота
* В. хлороводорода
* Г. аммиака
* Д. углекислого газа
На растворимость углекислого газа в воде не влияет
А. давление
Б. температура
* В. обьем сосуда
Г. химическое взаимодействие с водой
Д. присутствие других веществ
При комнатной температуре и давлении 1атм самую высокую растворимость в воде имеет
А. кислород
Б. азот
В. оксид углерода (IV)
* Г. аммиак
Д. хлороводород
Большая растворимость аммиака в воде связана с
А. диссоциацией его молекул на ионы
* Б. химическим взаимодействием с водой
* В. образованием межмолекулярных водородных связей
* Г. полярностью его молекул
Д. газообразным агрегатным состоянием
Использование в барокамерах кислорода под повышенным давлением позволяет
* А. улучшить кислородное насыщение тканей
* Б. повысить защитные функции организма
* В. защитить головной мозг от гипоксии
Г. уменьшить содержание кислорода в организме
Растворимость газов в водных растворах электролитов по сравнению с их растворимостью в чистой воде
А. больше
* Б. меньше
По сравнению с чистой водой растворимость кислорода и углекислого газа в крови
А. больше
* Б. меньше
В. одинакова
Растворимость
 в крови больше при давлении
в крови больше при давлении
А. 1 атм.
* Б. 10 атм.
При повышении температуры растворимость азота в крови
А. увеличивается
* Б. уменьшается
В. не изменяется
Повышение температуры
* А. как правило, увеличивает растворимость твердых веществ в воде
Б. чаще всего уменьшает растворимость твердых веществ в воде
В. обычно увеличивает растворимость газов в воде
* Г. обычно уменьшает растворимость газов в воде
* Д. обычно увеличивает взаимную растворимость жидкостей
При повышении температуры увеличивается растворимость в воде
А. азота
Б. кислорода
* В. хлорида аммония
* Г. хлорида калия
Растворение кристаллического нитрата аммония в воде сопровождается охлаждением, следовательно,
А. энергия гидратации больше энергии разрушения связей в кристаллической решетке (по абсолютной величине)
* Б. энергия гидратации меньше энергии разрушения связей в кристаллической решетке (по абсолютной величине)
* В. при повышении температуры его растворимость увеличивается
Г. при повышении температуры его растворимость уменьшается
Коллигативные свойства растворов - это свойства, которые зависят от
* А. природы растворителя
Б. природы растворенного вещества
* В. концентрации растворенного вещества
* Г. числа растворенных частиц
Давление насыщенного пара над раствором нелетучего вещества по сравнению с чистым растворителем:
А. больше
* Б. меньше
В. одинаково
Чем больше концентрация раствора, тем давление пара растворителя над раствором
А. выше
* Б. ниже
Относительное понижение давления насыщенного пара растворителя над раствором нелетучего неэлектролита равно
А. молярной концентрации растворенного вещества
Б. моляльной концентрации растворенного вещества
В. массовой доле растворенного вещества
* Г. мольной доле растворенного вещества
Понижение давления насыщенного пара растворителя над раствором больше в
А. 1% водном растворе мочевины
Б. 5% водном растворе мочевины
В. 10% водном растворе мочевины
* Г. 15% водном растворе мочевины
Повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов прямо пропорционально
А. молярной концентрации раствора
* Б. моляльной концентрации раствора
В. титру раствора
Г. эквивалентной концентрации
Значения эбулиоскопической и криоскопической констант
* А. зависят от природы растворителя
Б. не зависят от природы растворителя
В. зависят от природы растворенного вещества
* Г. не зависят от природы растворенного вещества
Моляльная концентрация неэлектролита в водном растворе, который кипит при 373,52 К, составляет (
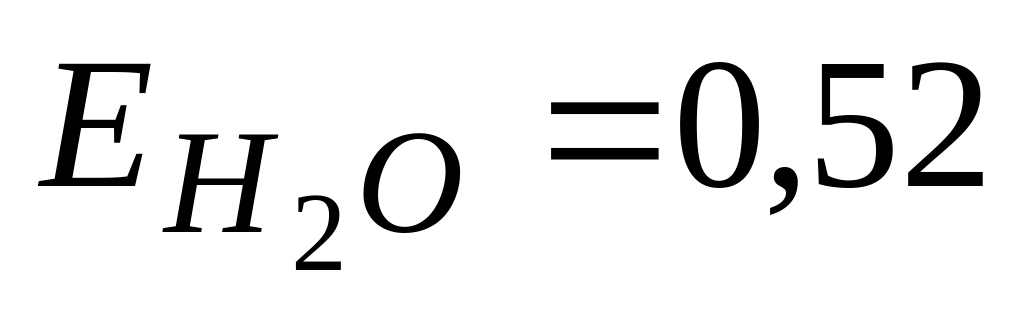 )
)
А. 1 моль/л
* Б. 1 моль/кг
В. 0.1 моль/л
Г. 0.1 моль/кг
При более высокой температуре кипит
* А.
10% водный раствор
![]()
Б.
10% водный раствор
![]()
В.
10% водный раствор
![]()
При более низкой температуре замерзает
* А. 0,1% водный раствор глюкозы (М = 180 г/моль)
Б. 0,1% водный раствор сахарозы (М = 342 г/моль)
В. 0,1% водный раствор альбумина (М = 68000 г/моль)
При одинаковой температуре замерзают два водных раствора, содержащих
* А. по 0,1 моль глюкозы и глицерина в 1000 г
Б. по 1 моль глюкозы и глицерина в 1 л раствора
* В. по 1 моль этанола и глицерина в 1000 г
Если температура кипения водного раствора сахарозы
 равна
равна
 ,
то температура замерзания этого раствора
(
,
то температура замерзания этого раствора
( )
)
А.
![]()
Б.
![]()
* В.
![]()
Г.
![]()
При температуре замерзает раствор, содержащий в 1000г воды
А. 0,1 моль глюкозы
* Б. 1 моль глюкозы
В. 18 г глюкозы
Г. 10 моль глюкозы
* Д. 180 г глюкозы
При осмосе, как правило, происходит перемещение через полупроницаемую мембрану
А. растворенного вещества
* Б. растворителя
Необходимые условия для возникновения осмоса
* А. растворитель и раствор, разделенные полупроницаемой мембраной
* Б. два раствора различной концентрации, разделенные полупроницаемой мембраной
В. смешение растворов различной концентрации
Осмотическое давление прямо пропорционально
* А. молярной концентрации
Б. моляльной концентрации
* В. абсолютной температуре
* Г. числу частиц растворенного вещества
Изотоническими называют растворы
* А. с одинаковым осмотическим давлением
* Б. содержащие одинаковое число осмотически активных частиц
В. электролитов и неэлектролитов одинаковой молярной концентрации
В разбавленных растворах электролитов по сравнению с растворами неэлектролитов с такой же молярной концентрацией число частиц
* А. больше
Б. меньше
В. одинаково
Двудецимолярному раствору глюкозы изотоничен раствор хлорида натрия, имеющего концентрацию
А. 0.2 моль/л
* Б. 0.1 моль/л
В. 0.4 моль/л
Двудецимолярный раствор глюкозы по отношению к двудецимолярному раствору хлорида натрия
А. изотоничен
Б. гипертоничен
* В. гипотоничен
Раствор хлорида натрия, изотоничный крови при
 ,
имеет
,
имеет
* А. осмотическое давление, равное 7,7 атм.
Б. осмотическое давление 1 атм.
* В. концентрацию 0,9%
* Г. осмотическое давление, равное осмотическому давлению 4,5-5мас.% раствора глюкозы
10мас.% водный раствор хлорида натрия является по отношению к плазме крови
А. изотоническим раствором
Б. гипотоническим раствором
* В. гипертоническим раствором
Гемолиз эритроцитов происходит в
А. изотоническом растворе
* Б. гипотоническом растворе
В. гипертоническом растворе
При помещении клеток в гипертонический раствор наблюдается
А. гемолиз
* Б. плазмолиз
* В. сморщивание клеток
* Г. экзоосмос
Д. эндоосмос
Онкотическое давление плазмы крови обусловлено растворенными в ней
А. низкомолекулярными веществами
* Б. белками
В. электролитами
Гипертонические растворы используют в медицине
А. при больших кровопотерях
Б. для внутривенного введения лекарственных препаратов
* В. для очистки гнойных ран
* Г. при глаукоме
Д. при обезвоживании организма
Болевые ощущения в глазах при купании в пресной воде вызваны
* А. осмосом воды внутрь глазного яблока
Б. осмосом воды из глазного яблока
Осмос воды из глазного яблока наблюдается при купании в
* А. соленой воде
Б. пресной воде
Введение в организм больших количеств солей приводит к
* А. повышению осмотического давления в подкожной клетчатке
Б. понижению осмотического давления в подкожной клетчатке
* В. отекам
* Г. обезвоживанию слизистых оболочек
Осмотическое давление в организме может понизиться в результате
А. введения больших количеств солей
* Б. интенсивной потери солей
* В. введения больших количеств воды
В очаге воспаления резко повышается осмотическое давление, так как при этом
* А. белковые молекулы распадаются на более мелкие фрагменты
Б. число осмотически активных частиц уменьшается
* В. число осмотически активных частиц увеличивается
* Г. вода устремляется в очаг воспаления
Консервирующее действие гипертонических растворов (рассолов и сиропов) связано с разрушением микроорганизмов в результате
А. лизиса
* Б. плазмолиза
При осмотическое давление 22,4 атм. имеют:
* А. 1 М раствор глюкозы
Б. 1 М раствор хлорида натрия
* В. 1 М раствор глицерина
Г. 1 М раствор соляной кислоты
Осмотическое давление одномолярного раствора нелетучего неэлектролита равно 22,4 атм. при
А.
![]()
Б.
В.
![]()
* Г.
В сохранении постоянного осмотического давления в организме человека принимают участие
А. сердце
* Б. печень
* В. почки
* Г. подкожная клетчатка
При понижении содержания белка в крови (голодание, заболевание почек) более высокое осмотическое давление (по сравнению с кровью) возникает в тканях, поэтому
* А. вода устремляется в ткани
* Б. возникают отеки
В. вода устремляется из тканей в кровь
Г.
введение больших количеств
![]() приводит к уменьшению отеков
приводит к уменьшению отеков
* Д. введение больших количеств приводит к увеличению отеков
Онкотическое давление плазмы крови
А. больше осмотического
* Б. составляет часть осмотического
* В. равно 0.04 атм.
Г. равно 7.7 атм.
Если растворы глюкозы (М = 180 г/моль) и сахарозы (М = 342 г/моль) при одинаковой температуре имеют одинаковое осмотическое давление и в литре первого раствора содержится 18 г глюкозы, то в 1 литре второго раствора содержится
* А. 34,2 г сахарозы
Б. 10 г сахарозы
* В. 0,1 моль сахарозы
Г. 0,03 моль сахарозы
При растворении в 1000 г воды 18 г глюкозы (М = 180г/моль) при
 =
0.52 и
=
0.52 и
 =
1.86:
=
1.86:
А.
температура кипения понижается на
![]()
* Б. температура кипения повышается на
* В.
температура замерзания понижается на
![]()
Г. температура замерзания повышается на
Экспериментально определенное понижение температуры замерзания плазмы крови составляет
 по сравнению с водой. Это соответствует
моляльности растворенных в ней веществ
по сравнению с водой. Это соответствует
моляльности растворенных в ней веществ
А.
![]() 0.1
моль/кг
0.1
моль/кг
* Б. 0.3 моль/кг
В. 3 моль/кг
Г. 1 моль/кг
В отличии от твердых веществ и жидкостей на растворимость газов сильно влияет
А. природа растворителя
* Б. давления, под которым находится газ
В. присутствие катализатора
Г. температура
Чем больше концентрация нелетучего неэлектролита в растворе, тем
* А. выше его температура кипения
Б. ниже его температура кипения
В. выше его температура замерзания
* Г. ниже его температура замерзания
Раствор, содержащий 0,9г углевода в 50г воды, закипает при температуре 100,052оС. Молярная масса этого углевода
А. 322 г/моль
Б. 100 г/моль
* В. 180 г/моль
Г. 160 г/моль
Для большинства млекопитающих понижение температуры замерзания плазмы крови составляет
 С,
а для человека
С.
Это значит, что осмотическое давление
плазмы крови этих млекопитающих
С,
а для человека
С.
Это значит, что осмотическое давление
плазмы крови этих млекопитающих
А. меньше, чем у человека
Б. такое же, как у человека
* В. больше, чем у человека
Двухпроцентный раствор глюкозы (плотность раствора 1,006г/мл)
А. изотоничен по отношению к плазме крови
* Б. гипотоничен по отношению к плазме крови
В. гипертоничен по отношению к плазме крови
* Г. вызывает гемолиз эритроцитов
Д. вызывает плазмолиз эритроцитов
Для понижения температуры замерзания до
 С
к 100г воды необходимо добавить
С
к 100г воды необходимо добавить
А. 100г глицерина
Б. 82,7г глицерина
В. 50,3г глицерина
Г. 30,5г глицерина
* Д. 24,7г глицерина
Для приготовления 0,5л раствора, изотоничного плазме крови при
 С,
необходимо взять сахарозы
С,
необходимо взять сахарозы
* А. 51,75г
Б. 74,25г
В. 92,15г
* Г. 0,15моль
Д. 0,3моль
Если считать, что одна четверть осмотического давления крови обусловлена присутствием в ней неэлектролитов, а три четверти – солями, полностью распадающимися на два иона, то молярные концентрации неэлектролитов и электролитов в крови составляют соответственно
А. 0,05моль/л и 0,05моль/л
Б. 0,05моль/л и 0,15моль/л
В. 0,076моль/л и 0,222моль/л
* Г. 0,076моль/л и 0,114моль/л
Д. 0,037моль/л и 0,114моль/л
Смесь, содержащая 0,1г ПАСК (противотуберкулезный препарат) и 2г камфоры, плавится при
 С.
Температура плавления камфоры
С.
Температура плавления камфоры
 С,
а ее криоскопическая постоянная равна
40град/моль. Молярная масса ПАСК
С,
а ее криоскопическая постоянная равна
40град/моль. Молярная масса ПАСК
А. 40г/моль
Б. 46г/моль
В. 98г/моль
Г. 124г/моль
* Д. 154г/моль
Водный раствор, содержащий
 молекул неэлектролита в 250г воды,
кристаллизуется при температуре
молекул неэлектролита в 250г воды,
кристаллизуется при температуре
А. 276,28К
Б. 271,14К
В. 273К
Г. 271,96К
* Д. 269,28К
Для получения раствора, кристаллизующегося при
 С,
необходимо смешать воду и этанол в
массовом соотношении
С,
необходимо смешать воду и этанол в
массовом соотношении
* А. 2:1
Б. 1:1
В. 1:2
Г. 1:3
Д. 1:5
В 0,06м растворе хлорида натрия при С
* А. происходит гемолиз эритроцитов
Б. происходит плазмолиз эритроцитов
В. осмотическое давление соответствует осмотическому давлению плазмы крови
* Г. осмотическое давление ниже осмотического давления плазмы крови
Д. осмотическое давление выше осмотического давления плазмы крови
Г лава 7. Растворы электролитов
Растворы электролитов по сравнению с растворами неэлектролитов той же молярной концентрации имеют
А. более низкое осмотическое давление
* Б. более высокое осмотическое давление
* В. более низкую температуру замерзания
Г. более высокую температуру замерзания
Изотонический коэффициент показывает, во сколько раз экспериментальное значение осмотического давления раствора электролита
* А. больше, чем теоретически рассчитанное по уравнению для раствора неэлектролита
Б. меньше, чем теоретически рассчитанное по уравнению для раствора неэлектролита
Значение изотонического коэффициента больше единицы для растворов
А. неэлектролитов
* Б. электролитов
На степень диссоциации слабых электролитов влияют
* А. температура
Б. время
* В. концентрация раствора
* Г. присутствие в растворе одноименных ионов
При разбавлении степень диссоциации слабого электролита
* А. возрастает
Б. уменьшается
В. не изменяется
Константа диссоциации слабого электролита зависит от
* А. природы растворителя
* Б. природы электролита
В. концентрации раствора
* Г. температуры
Концентрация ионов водорода в растворе слабой одноосновной кислоты (С – начальная концентрация кислоты,
 – степень диссоциации)
– степень диссоциации)
А. ![]()
* Б. ![]()
В. ![]()
Степень диссоциации одноосновной кислоты в растворе с концентрацией 0,2моль/л равна 0,15. В растворе этой кислоты обьемом 2л масса ионов водорода равна
А. 0,03г
* Б. 0,06г
В. 0,3г
Г. 0,6г
Д. 3г
В децимолярном растворе уксусной кислоты в равновесии находятся частицы
А. только
![]() и
и
Б. только
* В. , и
Уравнение, отражающее диссоциацию фосфорной кислоты по второй ступени
А. ![]()
* Б. ![]()
В. ![]()
Правильное соотношение между значениями констант ступенчатой диссоциации фосфорной кислоты
* А. ![]()
Б. ![]()
В. ![]()
Константа диссоциации ортофосфорной кислоты по первой ступени больше, чем по второй, поэтому в растворе кислоты концентрация ионов

А. больше,
чем концентрация ионов
![]()
* Б. меньше, чем концентрация ионов
Константа диссоциации электролита по первой ступени больше, чем по второй и третьей ступени, так как энергия ионизации
* А. минимальна при отрыве протона от нейтральной молекулы
* Б. возрастает при возрастании заряда аниона
В. уменьшается при возрастании заряда иона
Кислотами можно считать частицы
* А. ![]()
Б. ![]()
* В.
Г. ![]()
Д. ![]()
Вода является
А. неэлектролитом
Б. сильным электролитом
* В. слабым электролитом
Константа и степень диссоциации воды от температуры
* А. зависят
Б. не зависят
Константа и степень диссоциации воды при повышении температуры
А. не изменяются
Б. уменьшаются
* В. увеличиваются
При температуре 250С ионное произведение воды

А. только для чистой воды
Б. только для водных растворов
* В. как для чистой воды, так и для любых водных растворов
При добавлении к чистой воде кислоты при данной температуре
А. увеличивается
![]()
* Б. увеличивается
![]()
В. увеличивается значение водородного показателя
* Г. уменьшается значение водородного показателя
Д. изменяется ионное произведение воды
При добавлении к чистой воде щелочи при данной температуре
А. увеличивается
* Б. уменьшается
В. изменяется ионное произведение воды
* Г. ионное произведение воды не изменяется
Равновесной концентрации гидроксильных ионов, равной
 моль/л, при 25ºС соответствует
значение водородного показателя
моль/л, при 25ºС соответствует
значение водородного показателя
А. 3
* Б. 11
В. ![]()
Г.
Значению pH = 4 при 25ºС соответствует
* А.
=![]() моль/л
моль/л
Б.
=![]() моль/л
моль/л
В. = моль/л
* Г. = моль/л
В децимолярном растворе соляной кислоты
* А. ![]() = 0.1 моль/л
= 0.1 моль/л
Б. = 0.01 моль/л
* В. pH = 1
Г. pH = 2
В децимолярном растворе NaOH
А. = 0.1 моль/л
* Б.
=
![]() моль/л
моль/л
* В. pH = 13
Г. pH = 1
* Д. pOH = 1
В сантимолярном растворе соляной кислоты значение водородного показателя больше, чем
* А. в одномолярном растворе соляной кислоты
* Б. в децимолярном растворе соляной кислоты
В. в миллимолярном растворе соляной кислоты
Г. в сантимолярном растворе гидроксида натрия
Наименьшее значение рН имеет
* А. 1м раствор НСl
Б. 0.1 м раствор HCl
В. 0.01 м раствор HCl
Г. 0.001 м раствор HCl
Наименьшее значение рН имеет децимолярный раствор
А. гидроксида натрия
Б. гидроксида кальция
В. соляной кислоты
* Г. серной кислоты
В децинормальном растворе соляной кислоты значение pH
А. равно значению pH децинормального раствора NaOH
* Б. меньше значения pH децинормального раствора NaOH
В. больше значения pH децинормального раствора NaOH
В децинормальном растворе соляной кислоты значение pH
А. равно значению pH децинормального раствора уксусной кислоты
Б. больше значения pH децинормального раствора уксусной кислоты
* В. меньше значения pH децинормального раствора уксусной кислоты
В децинормальном растворе соляной кислоты значение pH
* А. равно значению pH децинормального раствора серной кислоты
Б. больше значения pH децинормального раствора серной кислоты
В. меньше значения pH децинормального раствора серной кислоты
Значение pH выше в растворе гидроксида натрия с концентрацией
А. 0.1н
* Б. 0.2н
Значение pH выше в растворе соляной кислоты с концентрацией
* А. 0.1н
Б. 0.2н
Значение pH =14 при 25ºC соответствует
* А.
=
![]() моль/л
моль/л
* Б. = 1 моль/л
В. = 1 моль/л
Г. = моль/л
В децимолярном и децинормальном растворах серной кислоты при 25ºС значения водородного показателя
А. одинаковы и равны 1
Б. одинаковы и равны 0.7
* В. равны 0.7 и 1 соответственно
Г. равны 1 и 0.7 соответственно
При 25ºС значение pH больше в
А. 0.1М растворе соляной кислоты
Б. 0.1М растворе серной кислоты
* В. 0.1М растворе уксусной кислоты
Разбавление раствора кислоты
А. уменьшает значение pH
* Б. увеличивает значение pH
В. не изменяет значение pH
Разбавление раствора щелочи
* А. уменьшает значение pH
Б. увеличивает значение pH
В. не изменяет значение pH
В децимолярном растворе соляной кислоты объемом 200 мл при 25ºС значение водородного показателя равно
* А. 1
Б. 0.2
В. 5
Г. 2
Если водородный показатель при 25ºС в сантимолярном растворе одноосновной кислоты равен 4, то эта кислота
А. сильная
* Б. слабая
Если водородный показатель при 25ºС в децимолярном растворе одноосновной кислоты равен единице, то эта кислота
* А. сильная
Б. слабая
Разбавление водой в 100 раз децимолярного раствора NaOH
А. увеличивает pH раствора в 100 раз
Б. уменьшает pH раствора в 100 раз
В. увеличивает pH раствора на 2 единицы
* Г. уменьшает pH раствора на 2 единицы
Разбавление водой в 100 раз децимолярного раствора HCl
А. увеличивает pH раствора в 100 раз
Б. уменьшает pH раствора в 100 раз
* В. увеличивает pH раствора на 2 единицы
Г. уменьшает pH раствора на 2 единицы
При увеличении pH раствора на единицу равновесная концентрация ионов водорода в нем
А. увеличивается в 10 раз
* Б. уменьшается в 10 раз
В. не изменяется
При 25ºС в 10 мл раствора с pH = 6 ионов водорода содержится
А. ![]() моль
моль
Б. ![]() моль
моль
* В. ![]() моль
моль
Прием углеводной пищи может вызвать уменьшение pH слюны от 7.4 до 6.4. При этом

* А. увеличивается в 10 раз
Б. уменьшается в 10 раз
В. увеличивается на 1 моль/л
Г. уменьшается на 1 моль/л
Сахароза начинает расщепляться под действием ферментов уже в ротовой полости с образованием органических кислот, при этом может увеличиться в 10 раз, следовательно, значение pH
А. увеличивается в 10 раз
Б. уменьшается в 10 раз
В. увеличивается на единицу
* Г. уменьшается на единицу
Значению pH желудочного сока, равному единице, соответствует концентрация соляной кислоты
А. 1 моль/л
* Б. 0.1 моль/л
В. 0.01 моль/л
Значению pH сока поджелудочной железы, равному девяти, эквивалентна концентрация NaOH
А. ![]() моль/л
моль/л
* Б. моль/л
В. 9 моль/л
Чтобы уменьшить равновесную концентрацию ионов водорода в растворе соляной кислоты
* А. раствор нужно разбавить
Б. раствор нужно упарить
* В. в раствор нужно добавить гидроксид натрия
При добавлении небольшого количества кристаллического ацетата натрия к 0.1М раствору уксусной кислоты
* А. pH раствора увеличится
Б. pH раствора уменьшится
В. равновесная концентрация ионов водорода в растворе увеличится
* Г. равновесная концентрация ионов водорода в растворе уменьшится
При добавлении к децимолярному раствору аммиака небольшого количества кристаллического хлорида аммония
А. pH раствора увеличится
* Б. pH раствора уменьшится
* В. равновесная концентрация ионов водорода в растворе увеличится
Г. равновесная концентрация ионов водорода в растворе уменьшится
При 25ºС водородный показатель равен 11 в растворе гидроксида натрия с концентрацией
А. моль/л
Б. 11 моль/л
В. 3 моль/л
* Г. ![]() моль/л
моль/л
При добавлении к 100 мл дистиллированной воды 0.01 моль гидроксида натрия значение pH
А. увеличится на одну единицу
Б. увеличится на две единицы
* В. увеличится на шесть единиц
Г. уменьшится на одну единицу
Д. уменьшится на две единицы
При растворении в 10л дистиллированной воды 1 моль хлороводорода значение pH
А. изменится от 7 до 0
* Б. изменится от 7 до 1
В. увеличится на 6 единиц
* Г. уменьшится на 6 единиц
Д. уменьшится на 7 единиц
Разбавление водой в 100 раз сантинормального раствора соляной кислоты приводит к
* А. увеличению pH раствора на 2 единицы
Б. увеличению pH раствора в 100 раз
В. уменьшению pH раствора на 2 единицы
Г. уменьшению pH раствора в 100 раз
При увеличении pH раствора на 3 единицы равновесная концентрация ионов водорода
А. увеличивается в 3 раза
Б. увеличивается в 1000 раз
В. уменьшается в 3 раза
* Г. уменьшается в 1000 раз
Добавление щелочи к дистиллированной воде изменяет концентрацию ионов водорода в 100 раз. Значение pH полученного раствора
А. 2
Б. 7
* В. 9
Г. 5
Д. 3
pH дистиллированной воды изменился от 7 до 4 при добавлении
А. щелочи
* Б. кислоты
В. поваренной соли
Г. соды
Если С – начальная концентрация, - степень диссоциации, то значение pH в растворе аммиака рассчитывается по формуле
А. pH = – lg(C )
* Б. pH = 14 + lg(C )
В. pH = C
Г. pH = 14 – lg(C )
Если С – начальная концентрация, - степень диссоциации, то в растворе слабой одноосновной кислоты величины и pH рассчитываются по формулам
А. ![]() = C и pH = –
lgC соответственно
= C и pH = –
lgC соответственно
* Б. = C и pH = – lg(C ) соответственно
В.
= C/![]() и pH = – lg(C/
)
соответственно
и pH = – lg(C/
)
соответственно
К 10 мл сантинормального раствора гидроксида натрия добавили 90 мл воды. Значение pH разбавленного раствора
А. 2
Б. 5
* В. 11
Г. 12
Значение pH венозной и артериальной крови 7.33 и 7.36 соответственно, следовательно
А. ![]() =
=
![]()
* Б. >
В. <
Если среднее значение pH крови равно 7,36, а спинно-мозговой жидкости – 7,53, то концентрация ионов водорода
* А. в крови больше, чем в спинно-мозговой жидкости
Б. в крови меньше, чем в спинно-мозговой жидкости
В. в спинно-мозговой жидкости больше, чем в крови
* Г. в спинно-мозговой жидкости меньше, чем в крови
Среднее значение pH внеклеточной среды 7,4, а внутриклеточной – 6,9. Концентрация протонов больше
А. вне клетки в 3,16 раза
* Б. внутри клетки в 3,16 раза
В. вне клетки в 1,07 раза
Г. внутри клетки в 1,07 раза
Значения pH децимолярных растворов кислот уменьшаются в ряду
А.
,
,
![]()
* Б. , ,
В.
,
,
![]()
Г. , ,
Электролиты в организме
* А. играют определенную роль в создании осмотического давления биологических жидкостей
Б. обуславливают онкотическое давление крови
* В. оказывают влияние на растворимость белков
* Г. препятствуют обезвоживанию организма и “сгущению крови”
Д. образуют клеточные мембраны
В плазме крови преобладают катионы
А.
,
,
,
![]()
* Б.
,
,
![]() ,
,
![]()
В.
,
,
![]() ,
,
![]()
Г. , , ,
Основной внеклеточный катион
* А.
Б.
В.
Г.
Основной внутриклеточный катион
А.
* Б.
В.
Г.
Ион , в основном, является
А. внутриклеточным катионом
* Б. внеклеточным катионом
В крови, лимфе, слюне кальций находится
А. только в ионизированном состоянии
Б. только в неионизированном состоянии в соединениях с белками и углеводами
* В. как в ионизированном, так и в неионизированном состоянии в соединениях с белками и углеводами
Основные анионы плазмы крови
* А. хлорид-ионы
Б. сульфат-ионы
В. гидрофосфат- и дигидрофосфат-ионы
* Г. гидрокарбонат-ионы
* Д. макроионы белков
Недостаток ионов и
 в слюне приводит к
в слюне приводит к
А. образованию зубного камня
* Б. растворению зубной эмали
В. укреплению зубной эмали
Сокращения сердечной мышцы совместно регулируют ионы
А. и
Б. и
* В. и
Г. и
Практически полностью утрачивает способность к свертыванию кровь, лишенная ионов
А.
Б.
В.
Г.
* Д.
Гидролизу могут подвергаться
* А. средние соли
* Б. кислые соли
* В. белки
* Г. жиры
Д. простые эфиры
Гидролизу подвергаются соли
* А. ![]()
Б. ![]()
В. ![]()
* Г. ![]()
* Д. ![]()
Гидролизу не подвергаются соли
* А.
* Б.
В. ![]()
Г. ![]()
Д. ![]()
Кислую реакцию среды имеют растворы
* А. соляной кислоты
Б. гидроксида натрия
* В. хлорида алюминия
Г. нитрата калия
Д. карбоната калия
Щелочную реакцию среды имеют растворы
* А. карбоната натрия
Б. сульфата меди
* В. фосфата натрия
Г. хлорида натрия
Д. соляной кислоты
Соли, в растворах которых pH
 7
7
* А. ![]()
Б. ![]()
* В.
Г. ![]()
* Д. ![]()
В растворе хлорида цинка
А. pH = 7
Б. pH > 7
* В. pH < 7
В растворе нитрата алюминия
А. pH = 7
Б. pH > 7
* В. pH < 7
В растворе ацетата калия
А. pH = 7
* Б. pH > 7
В. pH < 7
В растворе карбоната аммония
* А. pH 7
Б. pH > 7
В. pH < 7
В растворе хлорида натрия
* А. pH = 7
Б. pH > 7
В. pH < 7
В растворе
 среда
среда
А. нейтральная
* Б. кислая
В. щелочная
Сильнощелочная среда в растворе
* А. фосфата натрия
Б. гидрофосфата натрия
В. дигидрофосфата натрия
В растворе гидрофосфата натрия среда
А. кислая
* Б. слабощелочная
В. сильнощелочная
В слюне при значениях pH от 6.4 до 7.4 присутствуют ионы
А.
* Б.
* В. ![]()
Г.
* Д. ![]()
В плазме крови при физиологических значениях pH содержатся ионы
А.
* Б.
В.
* Г.
* Д.
При разбавлении раствора соли гидролиз
* А. усиливается
Б. ослабевает
В. не изменяется
При повышении температуры гидролиз соли
* А. усиливается
Б. ослабевает
В. не изменяется
Практически необратим гидролиз, в результате которого образуются
* А. малорастворимые продукты
* Б. газообразные продукты
В. сильные электролиты
При подкислении подавляется гидролиз солей, образованных
А. анионом слабой кислоты и катионом сильного основания
* Б. анионом сильной кислоты и катионом слабого основания
При подкислении гидролиз соли

* А. усиливается
Б. подавляется
В. не изменяется
При добавлении к раствору хлорида железа(III) гидролиз
А. усиливается
* Б. подавляется
В. не изменяется
При добавлении карбоната калия к раствору хлорида железа(III) гидролиз
* А. усиливается
Б. подавляется
В. не изменяется
Гидролиз карбоната калия без нагревания протекает по схеме
А. ![]()
* Б. ![]()
В. ![]()
Гидролиз хлорида аммония при обычных условиях протекает по схеме
* А. ![]()
Б. ![]()
Кислые соли могут образоваться при гидролизе солей
* А. карбонат натрия
Б. нитрит калия
В. нитрат серебра
* Г. фосфат калия
Основные соли могут образоваться при гидролизе солей
А. хлорид аммония
Б. нитрат серебра
* В. хлорид алюминия
* Г. нитрат меди(II)
* Д. хлорид хрома(III)
Для усиления гидролиза нитрата алюминия к его раствору нужно добавить
* А. гидроксид натрия
Б. соляную кислоту
* В. нитрит натрия
Г. сульфат меди
Увеличение pH растворов солей одинаковой концентрации происходит в ряду
А. хлорид бария, нитрат алюминия, сульфид калия
Б. нитрат алюминия, сульфид калия, хлорид бария
* В. нитрат алюминия, хлорид бария, сульфид калия
Не верны утверждения: для растворов с одинаковой молярной концентрацией (0,1м)
А. значение
pH раствора
![]() больше, чем pH раствора
больше, чем pH раствора
![]()
* Б. значение pH раствора больше, чем pH раствора
* В. значение
pH раствора
![]() больше, чем pH раствора
больше, чем pH раствора
![]()
Г. значение
pH раствора
![]() меньше, чем pH раствора
меньше, чем pH раствора
Д. значение
pH раствора
![]() больше, чем pH раствора
больше, чем pH раствора
![]()
Для усиления гидролиза ацетата натрия к его раствору необходимо добавить
А. гидроксид натрия
Б. гидроксид кальция
В. сульфат натрия
* Г. серную кислоту
* Д. хлорид аммония
В растворе хлорида алюминия лакмус становится
* А. красным
Б. синим
В. фиолетовым
Одинаковую реакцию среды имеют водные растворы солей
А. CuSO4 и BaBr2
Б. Zn(NO3)2 и Na2CO3
В. NH4Cl и K3PO4
* Г. NH4NO3 и AlCl3
* Д. Na2CO3 и K2S
При сливании водных растворов, содержащих соответственно 2 моля бромида алюминия и 3 моля карбоната калия при легком нагревании
* А. обрадуется осадок и выделяется газ
Б. образуется осадок, но газ не выделяется
В. выделяется газ, но осадок не образуется
Г. не происходит никаких видимых изменений
В водном растворе индикатора установилось равновесие
 .
При добавлении щелочи раствор приобретает
окраску
.
При добавлении щелочи раствор приобретает
окраску
А. молекул индикатора
* Б. ионов индикатора
В водном растворе индикатора установилось равновесие . При добавлении кислоты раствор приобретает окраску
* А. молекул индикатора
Б. ионов индикатора
Отличить нейтральную среду от щелочной с помощью метилового оранжевого
А. можно
* Б. нельзя
Отличить кислую среду от нейтральной с помощью фенолфталеина
А. можно
* Б. нельзя
Отличить кислую среду от щелочной с помощью лакмуса
* А. можно
Б. нельзя
Если интервал перехода окраски метилового оранжевого 3.1 4.0, то при рН < 3.1 в его присутствии раствор имеет
* А. окраску молекул индикатора
Б. окраску ионов индикатора
* В. красную окраску
Г. желтую окраску
Д. оранжевую окраску
В растворе индикатора метилового оранжевого преобладают ионы индикатора
А. при рН > 3.1
Б. при рН < 3.1
* В. при рН > 4.0
Г. при 3.1 < pH < 4.0
* Д. в щелочной среде
При значениях рН в пределах интервала перехода окраски двухцветного индикатора раствор имеет окраску, обусловленную
А. молекулами индикатора
Б. ионами индикатора
* В. совместным присутствием молекул и ионов индикатора
Раствор будет нейтральным при смешении эквивалентных количеств
А. ![]() и
и
* Б. и
В. и
Практически необратима реакция нейтрализации
* А. сильного основания и сильной кислоты
Б. сильного основания и слабой кислоты
В. слабого основания и сильной кислоты
Реакция нейтрализации слабого основания сильной кислотой
А. практически необратима
* Б. обратима
Реакция нейтрализации аммиака уксусной кислотой
А. практически необратима
* Б. обратима
В растворе соли, образованной катионом слабого основания и анионом слабой кислоты, реакция среды может быть
А. сильнокислой
* Б. слабокислой
* В. практически нейтральной
* Г. слабощелочной
Д. сильнощелочной
Растворы электролитов являются проводниками
А. первого рода
* Б. второго рода
В растворах электролитов переносчиками электричества являются
А. электроны
Б. только катионы
В. только анионы
* Г. катионы и анионы
Электропроводность проводника
А. прямо пропорциональна сопротивлению
* Б. обратно пропорциональна сопротивлению
Подвижность ионов при бесконечном разведении и постоянной температуре зависит от
* А. заряда иона
* Б. размера иона
* В. степени гидратации иона
Г. межионных взаимодействий
Д. температуры
В воде подвижность иона
 меньше, чем подвижность иона
,
так как
меньше, чем подвижность иона
,
так как
А. ион меньше гидратирован
* Б. ион больше гидратирован
* В. ион меньше гидратирован
Г. ион больше гидратирован
При одинаковых зарядах с увеличением размера иона
* А. уменьшается плотность заряда
Б. увеличивается плотность заряда
В. увеличивается степень гидратации
* Г. уменьшается степень гидратации
* Д. увеличивается подвижность ионов
Многозарядные ионы по сравнению с однозарядными с близкими значениями радиусов под действием электрического тока перемещаются
А. быстрее
* Б. медленнее
Аномально высокую подвижность в растворе имеют ионы
А.
Б.
* В.
* Г. ![]()
Д. ![]()
“Эстафетным” механизмом объясняется перемещение в растворах ионов
* А.
Б.
В.
* Г.
Д. ![]()
При повышении температуры подвижность ионов в растворе
А. уменьшается
* Б. увеличивается
В. не изменяется
Удельная электропроводность растворов электролитов увеличивается
* А. при повышении температуры
Б. при понижении температуры
В. при разбавлении прямо пропорционально объему раствора
* Г. при разбавлении до определенной величины, затем уменьшается
Ослабление межионного взаимодействия при разбавлении объясняет увеличение удельной электропроводности для
* А. сильных электролитов
Б. слабых электролитов
Электрофоретический и релаксационный эффекты в растворах сильных электролитов
* А. связаны с наличием ионных атмосфер
Б. увеличивают скорость движения ионов
* В. уменьшают скорость движения ионов
Для растворов слабых электролитов при разбавлении удельная электропроводность сначала увеличивается, затем уменьшается за счет
А. одновременного ослабления межионного взаимодействия и уменьшения концентрации молекул электролита
Б. одновременного увеличения степени диссоциации и ослабления межионного взаимодействия
* В. одновременного увеличения степени диссоциации и уменьшения концентрации молекул электролита
Эквивалентная электропроводность растворов сильных и слабых электролитов при разбавлении
А. линейно возрастает
Б. возрастает до определенной величины, затем падает
* В. возрастает, достигая максимального значения, затем остается постоянной
При бесконечном разбавлении
* А. катионы и анионы проводят электричество независимо друг от друга
Б. катионы и анионы влияют на перемещение друг друга
* В. взаимодействие между ионами практически полностью отсутствует
Математическое выражение закона Кольрауша
А. ![]()
* Б. ![]()
* В.
=
![]()
Г. ![]()
Наиболее высокую электропроводность имеет
А. костная ткань
Б. жировая ткань
В. мышечная ткань
* Г. кровь
Лучше проводит ток
* А. межклеточная жидкость
Б. клеточная мембрана
В. костная ткань
При полном отмирании ткани разрушаются клеточные мембраны, при этом
* А. электропроводность ткани не зависит от частоты тока
* Б. сопротивление тканей не зависит от частоты тока
В. электропроводность тканей уменьшается
Г. сопротивление тканей возрастает
Повышение электропроводности слюны указывает на
А. уменьшение концентрации свободных ионов
* Б. увеличение концентрации свободных ионов
* В. процессы разрушения зубной эмали
Г лава 8. Буферные системы
Буферные системы способны сохранять значение pH на постоянном уровне
А. при добавлении любого количества сильной кислоты или щелочи
* Б. при добавлении небольшого количества сильной кислоты или щелочи
В. при бесконечном разбавлении
* Г. при небольшом разбавлении
Д. при нагревании
Буферное действие могут оказывать
А. разбавленные растворы сильных кислот и щелочей
* Б. растворы амфолитов
* В. растворы слабой кислоты и ее соли
* Г. растворы слабого основания и его соли
* Д. растворы солей многоосновных кислот
Ацетатная буферная система состоит из
* А. уксусной кислоты и ацетата натрия
Б. уксусной кислоты
В. уксусной кислоты и ацетата аммония
Состав фосфатной буферной системы в организме
А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
Д. 
Роль слабой кислоты в фосфатной буферной системе в организме играет
А. ![]()
* Б.
В.
Г.
Состав бикарбонатной буферной системы
* А. ![]()
Б. ![]()
В. ![]()
Г. 
Аммиачная буферная система относится к
А. кислотным
* Б. основным
В. амфолитным
К амфолитным буферным системам относят
А. аммиачную
Б. бикарбонатную
* В. белковую
* Г. аминокислотную
Для создания щелочной среды можно использовать буферную систему
А. ацетатную
Б. бикарбонатную
* В. аммиачную
Для кислотного буфера значение pH определяется по формуле
* А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
Значение pH ацетатной буферной системы практически не изменяется при
* А. добавлении небольшого количества соляной кислоты
* Б. добавлении небольшого количества гидроксида натрия
В. добавлении уксусной кислоты
* Г. разбавлении в 10 раз
Значение pH ацетатной буферной системы может измениться при
* А. изменении соотношения концентраций уксусной кислоты и ацетата натрия
Б. увеличении концентрации и уксусной кислоты, и ацетата натрия в 2 раза
В. разбавлении буферной системы в 5 раз
* Г. добавлении в систему ацетата натрия
Д. добавлении в систему небольшого количества соляной кислоты
При разбавлении в 10 раз сильнее изменится концентрация ионов водорода в растворе, содержащем
А. уксусную кислоту и ацетат натрия
Б. дигидрофосфат натрия и гидрофосфат натрия
* В. соляную кислоту
При значительном разбавлении pH буферной системы может измениться за счет
А. изменения соотношения концентраций компонентов
* Б. изменения степени диссоциации слабого электролита и его соли
В растворе слабой кислоты активная кислотность определяется
* А. концентрацией свободных ионов
Б. количеством ионов , связанных в недиссоциированных молекулах кислоты
В. общей концентрацией кислоты
Потенциальная кислотность в растворе слабой кислоты определяется
А. концентрацией свободных ионов
* Б. количеством ионов , связанных в недиссоциированных молекулах кислоты
В. общей концентрацией кислоты
* Г. разностью между общей и активной кислотностью
Общая кислотность в растворе слабой кислоты
* А. определяется титрованием
* Б. равна сумме активной и потенциальной кислотности
В. представляет собой “запас” недиссоциированных молекул кислоты
* Г. соответствует аналитической концентрации кислоты
В растворе уксусной кислоты
А. общей кислотности соответствует равновесная концентрация
* Б. активной кислотности соответствует равновесная концентрация
* В. потенциальной кислотности соответствует равновесная концентрация молекул кислоты
Г. общей кислотности соответствует равновесная концентрация молекул кислоты
В растворе слабой кислоты увеличение активной кислотности приводит к
А. уменьшению общей кислотности
Б. увеличению общей кислотности
В. увеличению потенциальной кислотности
* Г. уменьшению потенциальной кислотности
При добавлении к ацетатной буферной системе сильной кислоты протекает реакция
А. ![]()
* Б. ![]()
При добавлении к кислотной буферной системе сильной кислоты происходит
* А. связывание введенных ионов анионами соли
* Б. образование эквивалентного количества слабой кислоты
* В. незначительное повышение концентрации ионов водорода
Г. связывание введенных ионов слабой кислотой
Д. резкое изменение pH
При добавлении к ацетатной буферной системе небольшого количества щелочи протекает реакция
А.
Б.
* В. ![]()
При добавлении к кислотной буферной системе щелочи происходит
А. образование эквивалентного количества слабой кислоты
Б. нейтрализация введенных ионов анионами соли
* В. нейтрализация введенных ионов молекулами кислоты
Г. резкое изменение рН
Буферная система с
 более устойчива к добавлению
более устойчива к добавлению
* А. кислоты
Б. щелочи
Буферная система с
 более устойчива к добавлению
более устойчива к добавлению
А. кислоты
* Б. щелочи
Добавление к ацетатной буферной системе уксусной кислоты
А. не изменяет значения pH
Б. увеличивает значение pH
* В. уменьшает значение pH
Добавление к ацетатной буферной системе ацетата натрия
А. не изменяет значения pH
* Б. увеличивает значение pH
В. уменьшает значение pH
При добавлении к фосфатной буферной системе в организме сильной кислоты протекает реакция
* А. ![]()
Б. ![]()
В. ![]()
Г. ![]()
Фосфатная буферная система в организме нейтрализует основные продукты метаболизма по схеме:
А. ![]()
* Б. ![]()
В. ![]()
При добавлении к аммиачной буферной системе сильной кислоты протекает реакция
* А. ![]()
Б. ![]()
В. ![]()
Г. ![]()
При добавлении к аммиачной буферной системе щелочи протекает реакция
А.
* Б.
В.
После добавления к фосфатной буферной системе кислоты, рН можно рассчитать по формуле
* А. ![]()
Б. ![]()
В. ![]()
Г. ![]()
После добавления к ацетатной буферной системе щелочи, рН можно рассчитать по формуле
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
При разбавлении фосфатной буферной системы в два раза
А. pH уменьшится в 2 раза
Б. pH увеличится в 2 раза
* В. pH не изменится
* Г. буферная емкость уменьшится в 2 раза
Д. буферная емкость увеличится в 2 раза
При увеличении концентрации уксусной кислоты и ацетата натрия в два раза в ацетатной буферной системе
А. pH уменьшится в 2 раза
Б. pH увеличится в 2 раза
* В. pH не изменится
Г. буферная емкость уменьшится в 2 раза
* Д. буферная емкость увеличится в 2 раза
Большее количество кислоты может нейтрализовать фосфатная буферная система состава
А. 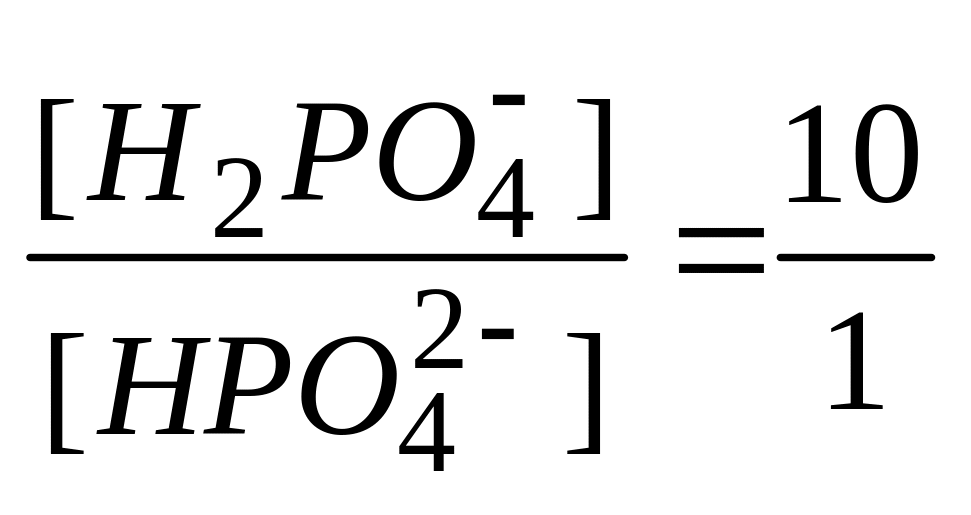
* Б. 
Ацетатная буферная система, содержащая 20 мл 0.1н раствора ацетата натрия и 30 мл 0.1 н раствора уксусной кислоты, имеет бóльшую буферную емкость
А. по кислоте
* Б. по щелочи
Для буферных систем одного и того же химического состава с увеличением концентрации буферная емкость
А. не изменяется
* Б. увеличивается
В. уменьшается
Максимальную буферную емкость имеют кислотные буферные системы, для которых
* А. pH = pK
Б. pH = pK + 1
В. pH = pK – 1
* Г. ![]()
Д. ![]()
В ацетатной буферной системе (
 )
при pH=4.76 соотношение концентраций
компонентов
)
при pH=4.76 соотношение концентраций
компонентов
А. ![]()
Б. ![]()
* В. ![]()
В аммиачной буферной системе (
 )
при pH=10.25 соотношение концентраций
компонентов
)
при pH=10.25 соотношение концентраций
компонентов
* А. ![]()
Б. ![]()
В. ![]()
Ацетатная буферная система ( ) со значением pH=3,76 может нейтрализовать
* А. щелочи больше, чем кислоты
Б. кислоты больше, чем щелочи
В. одинаковое количество кислоты и щелочи
Для приготовления буферной системы с pH=2,76 к 100мл децинормального раствора уксусной кислоты (
 )
необходимо добавить децинормального
раствора ацетата натрия
)
необходимо добавить децинормального
раствора ацетата натрия
А. 100мл
Б. 50мл
В. 10мл
* Г. 1мл
Д. 0,1мл
Кислотно-основное равновесие в крови обеспечивается буферными системами
* А. фосфатной
Б. ацетатной
* В. бикарбонатной
* Г. белковой
Д. аммиачной
Нормальное значение pH плазмы крови составляет
А. 7.70
* Б. 7.36
В. 6.80
Г. 8.00
При физиологическом значении pH 7.4 в плазме крови концентрация бикарбонат-ионов
* А. значительно выше концентрации растворенного в ней углекислого газа
Б. значительно ниже концентрации растворенного в ней углекислого газа
В. равна концентрации растворенного в ней углекислого газа
Буферная емкость бикарбонатной буферной системы в плазме крови
А. выше по щелочи, чем по кислоте
* Б. выше по кислоте, чем по щелочи
В. одинакова по кислоте и щелочи
В плазме крови при физиологическом значении pH
 7.4
соотношение компонентов бикарбонатного
буфера
7.4
соотношение компонентов бикарбонатного
буфера
 ,
следовательно, данный буфер может
нейтрализовать
,
следовательно, данный буфер может
нейтрализовать
* А. продуктов кислого характера в 20 раз больше, чем основного
Б. продуктов основного характера в 20 раз больше, чем кислого
При поступлении в кровь продуктов кислого характера
* А. увеличивается концентрация углекислого газа, растворенного в плазме
Б. уменьшается концентрация углекислого газа, растворенного в плазме
* В. усиливается вентиляция легких
Г. ослабляется вентиляция легких
При поступлении в кровь продуктов основного характера
А. увеличивается концентрация углекислого газа, растворенного в плазме
* Б. уменьшается концентрация углекислого газа, растворенного в плазме
В. усиливается вентиляция легких
* Г. ослабляется вентиляция легких
* Д. почки начинают выделять большие количества основных солей
Бикарбонатная буферная система наиболее эффективно нейтрализует продукты кислого характера в
* А. плазме крови
Б. эритроцитах
* В. слюне
Буферная емкость бикарбонатной буферной системы по кислоте в эритроцитах по сравнению с плазмой крови
А. выше
* Б. ниже
В. одинакова
Содержание неорганических фосфатов, составляющих буферную систему
А. в эритроцитах меньше, чем в плазме крови
* Б. в эритроцитах больше, чем в плазме крови
В. одинаково в эритроцитах и плазме крови
В плазме крови при физиологическом значении pH 7.4 соотношение компонентов фосфатного буфера
 ,
следовательно, данный буфер может
нейтрализовать
,
следовательно, данный буфер может
нейтрализовать
* А. продуктов кислого характера в 4 раза больше, чем основного
Б. продуктов основного характера в 4 раза больше, чем кислого
Фосфатная буферная система в плазме крови может нейтрализовать
А. только продукты кислого характера
Б. только продукты основного характера
* В. продукты и кислого, и основного характера
При нейтрализации фосфатной буферной системой продуктов кислого характера почки выделяют избыток ионов
* А.
Б.
В.
Фосфолипиды клеточных мембран при pH = 7.25 образуют буферную систему
* А. кислотного типа
Б. основного типа
* В. ![]()
Г. ![]()
В физиологических условиях при рН 7.4 белки плазмы крови (альбумины и глобулины) находятся преимущественно в формах
А. белок-кислота
* Б. белок-основание
* В. белок-соль
В физиологических условиях при рН 7.4 свободные аминокислоты плазмы крови
* А. практически не проявляют буферного действия
Б. проявляют буферное действие
* В. имеют
значения
![]() ,
отличные от рН
7.4
,
отличные от рН
7.4
К 100мл крови для изменения pH от 7,36 до 7,00 необходимо добавить 3,6мл 0,1н раствора соляной кислоты. Буферная емкость крови по кислоте (моль/л) составляет
А. ![]()
Б. ![]()
В. ![]()
* Г. ![]()
Д. ![]()
Если в плазме крови соотношение компонентов фосфатного буфера
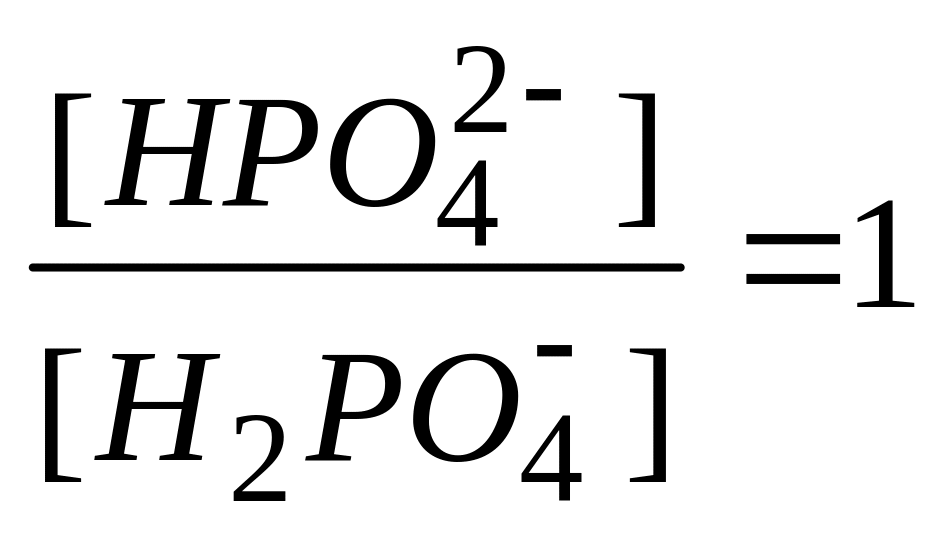 ,то это соответствует
,то это соответствует
* А. ацидозу
Б. алкалозу
В. нормальному значению pH7,4
Г. значению pH больше 7,4
* Д. значению pH меньше 7,4
Из трех буферных систем указанного ниже состава наибольшую буферную емкость по щелочи имеет
-
1.
5мл 0,1н раствора гидрофосфата натрия и 15мл 0,1н раствора дигидрофосфата натрия
2.
10мл 0,1н раствора гидрофосфата натрия и 10мл 0,1н раствора дигидрофосфата натрия
3.
15мл 0,1н раствора гидрофосфата натрия и 5мл 0,1н раствора дигидрофосфата натрия
* А. первая
Б. вторая
В. третья
Г. буферные емкости одинаковы
Буферная система, состоящая из 100 мл 0,1н раствора уксусной кислоты и 100 мл 0,2н раствора ацетата натрия
* А. может нейтрализовать 0,01моль NaOH без изменения РН
Б. может нейтрализовать 0,02моль NaOH без изменения РН
* В. может нейтрализовать 0,02моль HCl без изменения РН
* Г. изменяет pH при добавлении 0,02моль NaOH
Д. имеет одинаковые буферные емкости по кислоте и щелочи
Для увеличения буферной емкости по кислоте в аммиачную буферную систему необходимо добавить
* А. аммиак
Б. хлорид аммония
В. воду
При уменьшении вентиляции легких буферная емкость крови по кислоте
А. увеличивается
* Б. уменьшается
В. не изменяется
К фосфатному буферному раствору, состоящему из 50мл 0,1н монозамещенного фосфата натрия и 100мл 0,05н дизамещенного фосфата натрия, добавлено 25 мл 0,1н раствора гидроксида натрия. Значение pH при этом рассчитывается по уравнению
А. ![]()
Б. ![]()
В. ![]()
* Г. ![]()
Д. ![]()
В буферной системе
 нейтрализация продуктов кислого
характера происходит по схеме
нейтрализация продуктов кислого
характера происходит по схеме
* А. ![]()
Б. ![]()
В. ![]()
В буферной системе нейтрализация продуктов основного характера происходит по схеме
А.
![]()
* Б.
![]()
В.
По относительному вкладу в буферное действие первое место занимает
А. в эритроцитах бикарбонатная буферная система
* Б. в эритроцитах гемоглобиновая буферная система
* В. в плазме крови бикарбонатная буферная система
Г. в плазме крови гемоглобиновая буферная система
В связывании избытка ионов в крови принимают участие ионы
* А.
* Б.
В.
* Г. ![]()
Д.
Поступающий в венозную кровь взаимодействует с
* А.
Б. ![]()
В. ![]()
Г. ![]()
Схема
 описывает
процесс
описывает
процесс
* А. нейтрализации избытка метаболического в венозной крови
Б. легочной вентиляции
* В. буферного действия гемоглобиновой буферной системы
В капиллярах легких протекают реакции
* А. ![]()
Б. ![]()
* В. ![]()
Снижение рН крови может происходить в результате
* А. генерирования в процессе усвоения пищи
* Б. превращения гемоглобина в оксигемоглобин
В. превращения оксигемоглобина в гемоглобин
* Г. накопления молочной кислоты при физических нагрузках
Д. избыточной вентиляции легких
При ацидозе кислотно-щелочное равновесие крови смещается в сторону
* А. повышения равновесной концентрации ионов
Б. понижения равновесной концентрации ионов
В. повышения рН
* Г. понижения рН
При алкалозе кислотно-щелочное равновесие крови смещается в сторону
А. повышения равновесной концентрации ионов
* Б. понижения равновесной концентрации ионов
* В. повышения рН
Г. понижения рН
Избыточное количество нелетучей кислоты может удаляться из организма за счет щелочного резерва крови, который обусловлен присутствием в ней
* А. ионов
Б. ионов
В. карбонат-ионов
* Г. бикарбонат-ионов
Ацидоз может быть вызван
А. вдыханием чистого кислорода
* Б. уменьшением вентиляции легких
В. увеличением вентиляции легких
* Г. накоплением в тканях органических кислот
Алкалоз может быть вызван
* А. вдыханием чистого кислорода
* Б. увеличением вентиляции легких
В. уменьшением вентиляции легких
Г. накоплением в тканях органических кислот
* Д. накоплением в крови избытка бикарбонат-ионов
Значение рН фосфатной буферной системы может увеличиться при добавлении к ней
А. воды
* Б. большого количества гидроксида натрия
В. большого количества соляной кислоты
Г. дигидрофосфата натрия
* Д. гидрофосфата натрия
Значение рН аммиачной буферной системы может понизиться при добавлении к ней
А. воды
* Б. большого количества соляной кислоты
В. большого количества гидроксида натрия
* Г. хлорида аммония
Д. аммиака
Значение рН ацетатной буферной системы, содержащей 10 мл 0.5н раствора уксусной кислоты (
 )
и 20мл 0.25н раствора ацетата натрия
)
и 20мл 0.25н раствора ацетата натрия
* А. 4.76
Б. 5.76
В. 3.76
Г. 1.00
Значение рН аммиачной буферной системы, содержащей 0.2 моль аммиака (
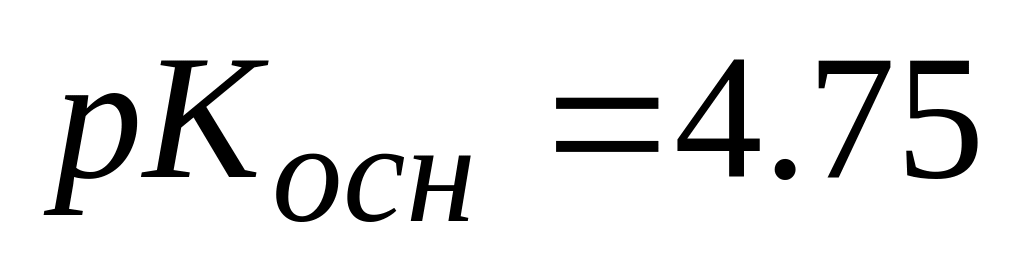 )
и 0.2моль хлорида аммония, составляет
)
и 0.2моль хлорида аммония, составляет
А. 4.75
Б. 5.75
* В. 9.25
Г. 10.25
Донорами ионов в крови являются частицы
А.
Б.
* В.
* Г.
Д.
Акцепторами ионов в крови являются
* А.
Б.
* В. ![]()
* Г.
Д.
Избыток молочной кислоты, образующейся в результате большой физической нагрузки, нейтрализуется при протекании реакций
А. ![]()
* Б. ![]()
* В. ![]()
Г. ![]()
* Д. ![]()
Главные буферные системы слюны
* А. бикарбонатная
* Б. фосфатная
В. гемоглобиновая
* Г. белковая
В слюне наибольшую буферную емкость по кислоте имеет
А. фосфатная буферная система
* Б. бикарбонатная буферная система
В. белковая буферная система
Уменьшение рН слюны может быть вызвано
* А. углеводной пищей
Б. увеличением скорости слюноотделения
* В. уменьшением скорости слюноотделения
Г. тщательным пережевыванием пищи
Д. включением в пищу аммоний-содержащих продуктов (сыра, орехов, ментола)
Небольшое увеличение рН слюны может быть вызвано
А. углеводной пищей
* Б. увеличением скорости слюноотделения
* В. тщательным пережевыванием пищи
* Г. включением в пищу аммоний-содержащих продуктов (сыра, орехов, ментола)
Д. задержкой пищевых сахаров в полости рта
Наиболее ацидогенным компонентом пищи является
А. фруктоза
Б. жир
* В. сахароза
Г. белок
В ротовой полости ферментативному расщеплению подвергаются
А. белки
* Б. углеводы
В. жиры
Микроорганизмы зубного налета
* А. продуцируют кислоты в результате гликолиза углеводов
* Б. утилизируют мочевину
В. полностью нейтрализуют органические кислоты, образовавшиеся после приема углеводной пищи
* Г. продолжают расщепление полисахаридов даже в промежутках между приемами пищи
Д. прекращают расщепление полисахаридов в промежутках между приемами пищи
Наиболее эффективной буферной системой зубного налета является
А. бикарбонатная
* Б. фосфатная
В. белковая
Г. гемоглобиновая
Зубной камень (минерализованный зубной налет) формируется при
* А. увеличении
в ротовой жидкости концентрации ионов
![]()
Б. уменьшении
в ротовой жидкости концентрации ионов
![]()
* В. при нарушении структуры защитных белков
Зубной камень может играть роль буферной системы, нейтрализуя
* А. продукты кислотного характера
Б. продукты основного характера
* В. молочную кислоту
Проявляя буферное действие в соответствии со схемой
 зубная эмаль
зубная эмаль
* А. частично растворяется
Б. минерализуется
* В. деминерализуется
* Г. нейтрализует кислотные продукты метаболизма
Д. нейтрализует основные продукты метаболизма
Буферное действие зубной эмали связано с
* А. ее разрушением
* Б. протеканием кариозных процессов
В. минерализацией
* Г. деминерализацией
Д. образованием гидроксиапатита
В сторону растворения зубной эмали равновесие в реакции
 смещается
смещается
* А. при длительном контакте зубной эмали с кислотными продуктами метаболизма
Б. при избытке ионов кальция в ротовой жидкости
* В. когда буферные системы слюны исчерпали свою буферную емкость по кислоте
Г. когда буферные системы слюны исчерпали свою буферную емкость по щелочи
Кривая Стефана отражает зависимость
А. pH ротовой жидкости от количества углеводной пищи
* Б. pH ротовой жидкости от времени с момента приема углеводной пищи
В. pH крови от количества углеводной пищи
Г. pH крови от времени с момента приема углеводной пищи
В результате приема углеводной пищи значение pH ротовой жидкости изменяется
А. от 7.0 до 1.0
* Б. от 7.0 до 6.2
В. от 14.0 до 0.0
Г. от 7.0 до 10.0
Г лава 9. Гетерогенные равновесия. Произведение растворимости
К обменным реакциям в растворах электролитов относят реакции
* А. нейтрализации
Б. окислительно-восстановительные
* В. осаждения
* Г. ионного обмена
Направление обменных реакций между электролитами определяется способностью их ионов
* А. образовывать малорастворимые соединения, выпадающие в осадок
* Б. образовать малодиссоциированные соединения
* В. образовывать газообразные вещества
Г. образовывать легкорастворимые соединения
В насыщенном растворе
 ,
находящемся в контакте с осадком,
устанавливается равновесие
,
находящемся в контакте с осадком,
устанавливается равновесие
А.
![]()
* Б.
![]()
В.
![]()
Произведение молярных концентраций ионов труднорастворимого электролита – величина постоянная
* А. в насыщенном растворе
* Б. при постоянной температуре
В. но зависящая от изменения концентраций отдельных ионов
* Г. и независимая от изменения концентраций отдельных ионов
Равенство
 означает, что
означает, что
* А.
как бы не изменялись концентрации
![]() и
и
![]() ,
их произведение в насыщенном растворе
при постоянной температуре остается
постоянным
,
их произведение в насыщенном растворе
при постоянной температуре остается
постоянным
Б.
при увеличении
увеличивается и
![]()
* В. при увеличении уменьшается
* Г. при увеличении уменьшается
Д. при увеличении увеличивается и
Значение произведения растворимости ортофосфата кальция рассчитывается по формуле
А.
![]()
Б.
![]()
В.
![]()
* Г.
![]()
Значение произведения растворимости гидроксида железа(III) рассчитывается по формуле
* А.
![]()
Б.
![]()
В.
![]()
Величина ПР постоянна при данной температуре только для:
А. насыщенных растворов хорошо растворимых электролитов
* Б. насыщенных растворов малорастворимых электролитов
В. ненасыщенных растворов хорошо растворимых электролитов
Г. насыщенных растворов неэлектролитов
Величина ПР характеризует растворимость малорастворимого электролита
* А. при постоянной температуре
Б. в любом растворителе
* В. в данном растворителе
Г. в присутствии посторонних веществ
* Д. в отсутствии посторонних веществ
Раствор является насыщенным, если в нем
* А.
![]()
Б.
![]()
В.
![]()
Если в растворе электролита AB произведение концентраций
 ,
то этот раствор
,
то этот раствор
А. ненасыщенный
* Б. пересыщенный
В. насыщенный
В ненасыщенном растворе
 при данной температуре
при данной температуре
А.
![]()
Б.
![]()
* В.
![]()
В насыщенном растворе хлорида серебра при данной температуре
* А.
Б.
![]()
В.
![]()
* Г. установилось динамическое равновесие между процессами растворения и кристаллизации
Д. скорость растворения больше скорости кристаллизации
Если при
 ,
то растворимость хлорида серебра в
воде равна
,
то растворимость хлорида серебра в
воде равна
* А. моль/л
Б.
![]() моль/л
моль/л
В. г/л
Г. г/л
Если при
 ,
то растворимость
,
то растворимость
 в воде равна
в воде равна
А. моль/л
* Б.
![]() моль/л
моль/л
В. г/л
Г. г/л
Если при
 ,
то при смешении 10мл 0,01М раствора
и 10мл 0,05 М раствора
,
то при смешении 10мл 0,01М раствора
и 10мл 0,05 М раствора
 осадок хромата кальция
осадок хромата кальция
* А. не выпадет
Б. выпадет
Растворимость
 в присутствии серной кислоты
в присутствии серной кислоты
* А. уменьшается
Б. увеличивается
В. не изменяется
Если в насыщенном растворе сульфата бария увеличить концентрацию
 ,
то концентрация
,
то концентрация
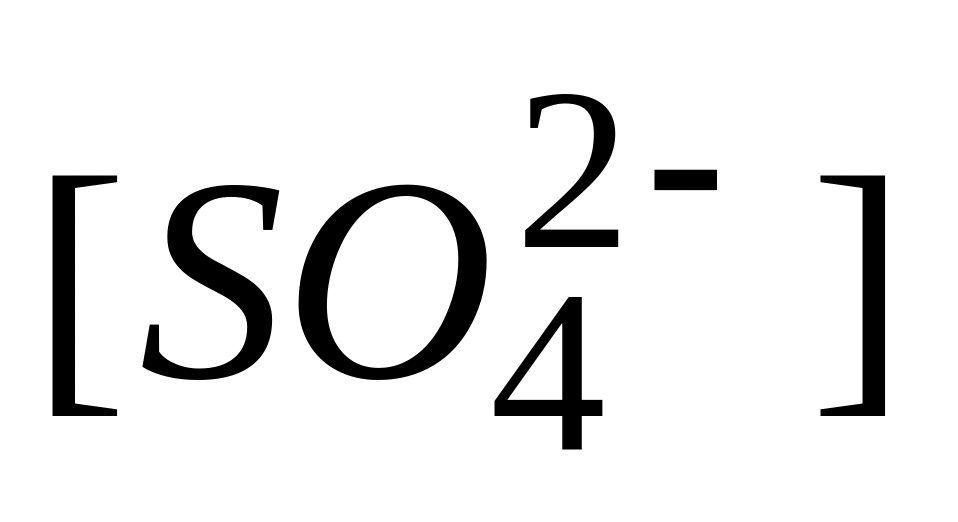
А. увеличится
* Б. уменьшится
В. не изменится
Если в насыщенном растворе гидроксида меди в 10 раз увеличить концентрацию [ ], то концентрация [ ]
А. уменьшится в 10 раз
Б. увеличится в 10 раз
* В. уменьшится в 100 раз
Г. увеличится в 100 раз
Если в насыщенном растворе иодида серебра увеличить концентрацию
 в 5 раз, то концентрация
в 5 раз, то концентрация
А. увеличится в 5 раз
* Б. уменьшится в 5 раз
В. увеличится в 25 раз
Г. уменьшится в 25 раз
Растворимость в аммиачном растворе по сравнению с его растворимостью в воде
* А. больше
Б. меньше
В. одинакова
Если в растворе малорастворимого электролита
 выполняется неравенство
выполняется неравенство
 ,
то
,
то
А. электролит выпадает в осадок
* Б. осадок электролита растворяется
Если при
 ,
,
 ,
,
 ,
то самую низкую растворимость при этой
температуре имеет
,
то самую низкую растворимость при этой
температуре имеет
А.
![]()
Б.
![]()
* В.
Осадок
 можно растворить
можно растворить
* А. в сильной минеральной кислоте
* Б. в щелочи
В. в воде
При концентрация
 в растворе равна
в растворе равна
 моль/л, а
равна
моль/л, а
равна
 моль/л.
Если
моль/л.
Если
 ,
то осадок
,
то осадок

А. образуется
* Б. не образуется
Если к раствору, содержащему по 0,01 моль/л хлорида кальция и хлорида стронция добавить серной кислоты (
 ,
,
 ),
то
),
то
А.
раньше выпадет осадок
![]()
* Б.
раньше выпадет осадок
![]()
В. обе соли одновременно выпадут в осадок
При пропускании сероводорода через раствор, содержащий по 0,1 моль/л
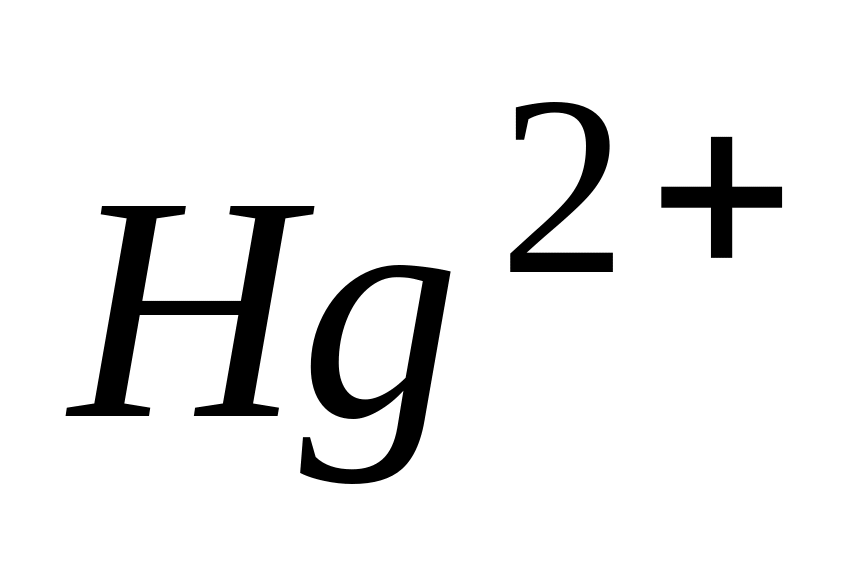 и
и
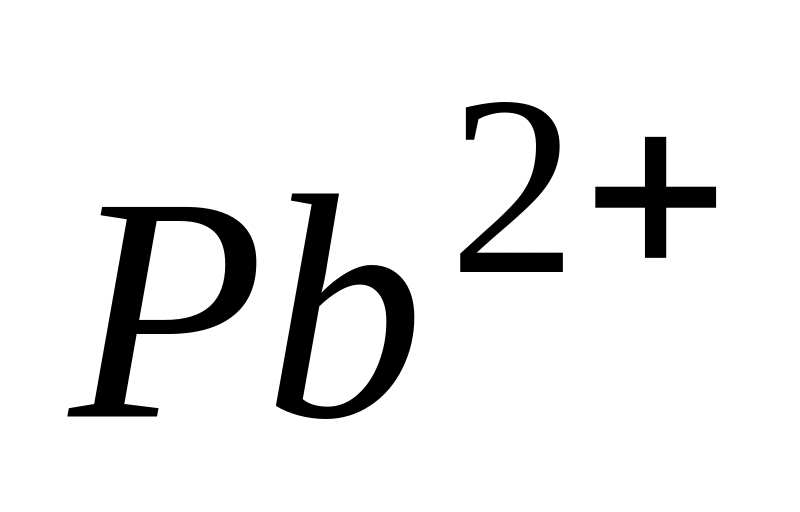 (
( ,
,
 ),
раньше выпадет осадок
),
раньше выпадет осадок
* А. сульфида ртути(II)
Б. сульфида свинца
Если равновесная концентрация ионов в плазме крови составляет
 моль/л, а равновесная концентрация
гидрофосфат-ионов –
моль/л, а равновесная концентрация
гидрофосфат-ионов –
 моль/л, то при
моль/л, то при

А. плазма крови ненасыщена по отношению к гидрофосфату кальция
* Б. плазма крови пересыщена по отношению к гидрофосфату кальция
* В. в плазме крови присутствуют микрокристаллы гидрофосфата кальция
Г. в плазме крови кристаллизация гидрофосфата кальция не происходит
В плазме крови содержится
 моль/л
свободных ионов
и
моль/л
свободных ионов
и
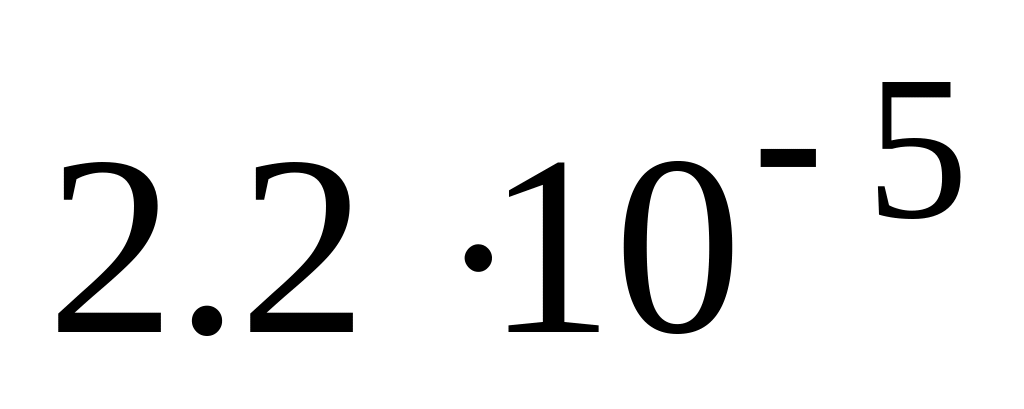 моль/л
оксалат-ионов. Если считать, что
произведение растворимости оксалата
кальция составляет
моль/л
оксалат-ионов. Если считать, что
произведение растворимости оксалата
кальция составляет
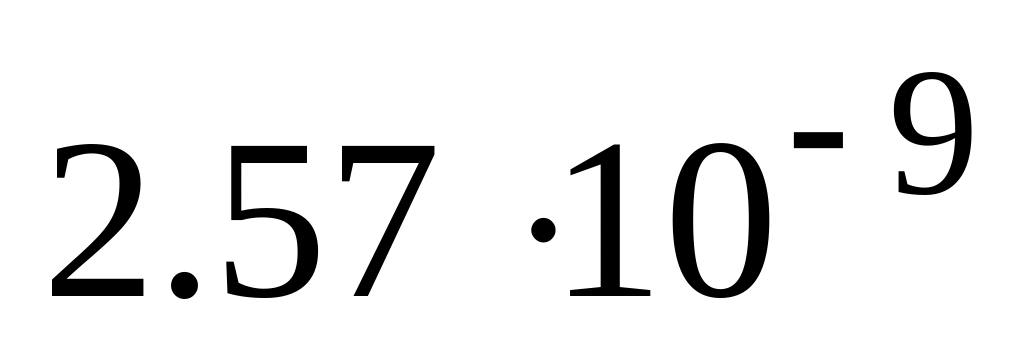 ,
то осадок оксалата кальция в плазме
крови
,
то осадок оксалата кальция в плазме
крови
* А. должен образоваться
Б. не должен образоваться
Превращению гидрофосфата кальция в гидроксиапатит при формировании костной ткани способствует
* А. слабощелочная реакция среды в крови
Б. слабокислая реакция среды в крови
* В. пересыщение крови гидрофосфат-ионами
* Г. увеличение концентрации свободных ионов кальция и гидрофосфат-ионов в плазме крови
Д. уменьшение концентрации свободных ионов кальция и гидрофосфат-ионов в плазме крови
Простейшим противоядием при попадании в организм ионов тяжелых металлов (ртути, кадмия, таллия) являются
А. нерастворимые сульфиды
* Б. растворимые сульфиды
* В. вещества, образующие с этими ионами малорастворимые соединения
Г. вещества, образующие с этими ионами хорошо растворимые соединения
* Д. сульфиды щелочных металлов
Растворимость гидроксиапатита зубной эмали при pH > 6.2 определяется концентрацией в слюне в первую очередь
* А. ионов
Б.
ионов
![]()
* В. ионов
Г.
ионов
![]()
