
- •Тестовые задания
- •Содержание
- •Глава 1. Строение атома
- •Глава 2. Химическая связь
- •Глава 5. Способы выражения концентрации растворов
- •Минерализующая функция слюны связана с ее пересыщенностью по ионам
- •Глава 11. Окислительно-восстановительные реакции
- •Глава 12. Адсорбция. Поверхностные явления
- •Глава 14. Органическая химия.
- •Для получения из бензола м-нитротолуола
- •Литература
- •Учебное издание
- •Тестовые задания
- •Издается в авторской редакции
Глава 2. Химическая связь
Х имическая связь
* А. представляет собой совокупность электростатических взаимодействий атомных ядер и электронов
* Б. отражает характер распределения электронной плотности
В. осуществляется только внутри молекулы
Г. обусловлена гравитационными силами
* Д. может иметь различную длину и энергию
Химическая связь образуется в том случае, когда объединение отдельных атомов
* А. сопровождается выделением энергии
Б. сопровождается поглощением энергии
* В. представляет собой экзотермический процесс
Г. представляет собой эндотермический процесс
* Д. энергетически выгодно
Образование химической связи сопровождается
* А. электростатическим взаимодействием ядер и электронов
* Б. понижением полной энергии системы
В. повышением полной энергии системы
* Г. сближением взаимодействующих атомов
Ковалентная, ионная и металлическая связь различаются
А. природой
* Б. характером взаимодействия общей электронной плотности с ядрами соединяемых атомов
В. наличием или отсутствием электростатического взаимодействия электронов и ядер
Г. наличием или отсутствием перекрывания атомных орбиталей
В образовании химических связей принимают участие
А. все электроны атома
Б. электроны внутренних электронных оболочек
* В. валентные электроны
Внутримолекулярные связи
* А. обьединяют атомы в молекулу
Б. обьединяют молекулы в ассоциаты
В. характеризуются энергией менее 40кДж/моль
* Г. характеризуются энергией 100-1000кДж/моль
Различные типы химической связи характеризуются
* А. единой природой
Б. различной природой
* В. различным характером распределения электронной плотности
Валентность атома в химическом соединении
* А. соответствует числу связей, которые он образует с другими атомами
Б. соответствует заряду атома, рассчитанному исходя из предположения, что все связи в соединении ионные
* В. характеризует способность атома присоединять определенное число других атомов
Степень окисления – это
А. число связей, которые данный атом образует с другими атомами
* Б. формальный заряд атома в молекуле, рассчитанный исходя из предположения, что все связи в соединении ионные
Численные значения валентности и степени окисления
А. всегда совпадают
* Б. могут совпадать или не совпадать
В. никогда не совпадают
* Г. чаще совпадают, чем нет
Численные значения валентности и степени окисления не совпадают для азота в частицах
А. ![]()
* Б. ![]()
* В. ![]()
* Г. ![]()
Формальная степень окисления углерода равна нулю в соединениях
А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
* Д. ![]()
Степень окисления вольфрама в ионе
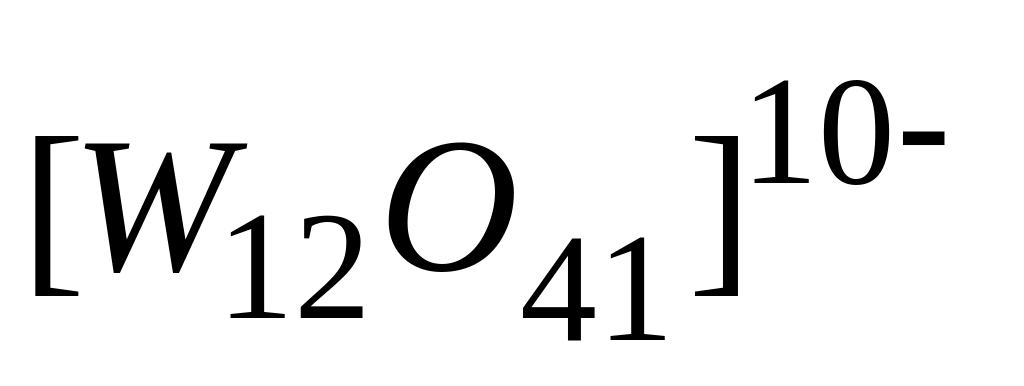 равна
равна
* А. +6
Б. -6
В. 0
Г. +2
Д. +3
В ионах и
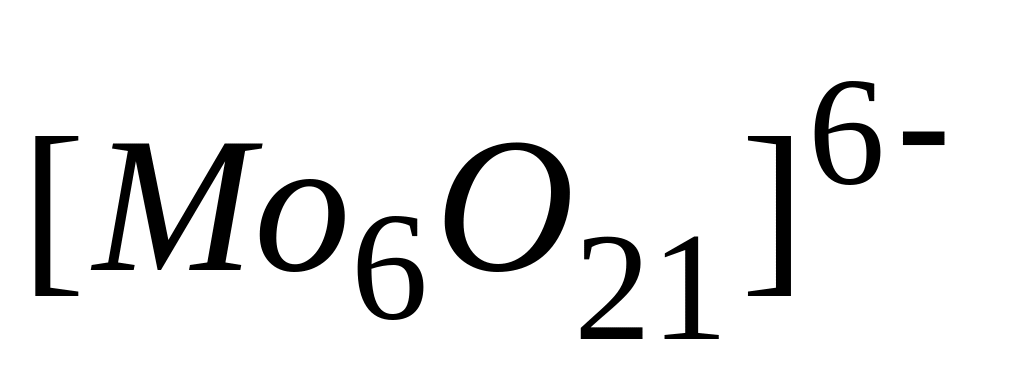 вольфрам и молибден имеют
вольфрам и молибден имеют
* А. одинаковые степени окисления
Б. разные степени окисления
Химическая связь тем прочнее, чем
* А. больше ее энергия
Б. меньше ее энергия
В. больше ее длина
* Г. меньше ее длина
Характеристики, общие для любого типа химической связи
А. кратность
Б. насыщаемость
* В. длина
* Г. энергия
Д направленность
При перекрывании атомных орбиталей и обобществлении электронных пар образуется
А. ионная связь
* Б. ковалентная связь
В. металлическая связь
Ковалентная связь по методу ВС
* А. двухцентровая
Б. трехцентровая
* В. двухэлектронная
Г. одноэлектронная
Механизм образования ковалентной связи за счет перекрывания одноэлектронных атомных орбиталей двух атомов называют
* А. обменным
Б. донорно-акцепторным
При донорно-акцепторном механизме образования ковалентной связи происходит перекрывание
А. одноэлектронных атомных орбиталей двух атомов
* Б. двухэлектронной орбитали одного атома и свободной орбитали другого
В ионе аммония
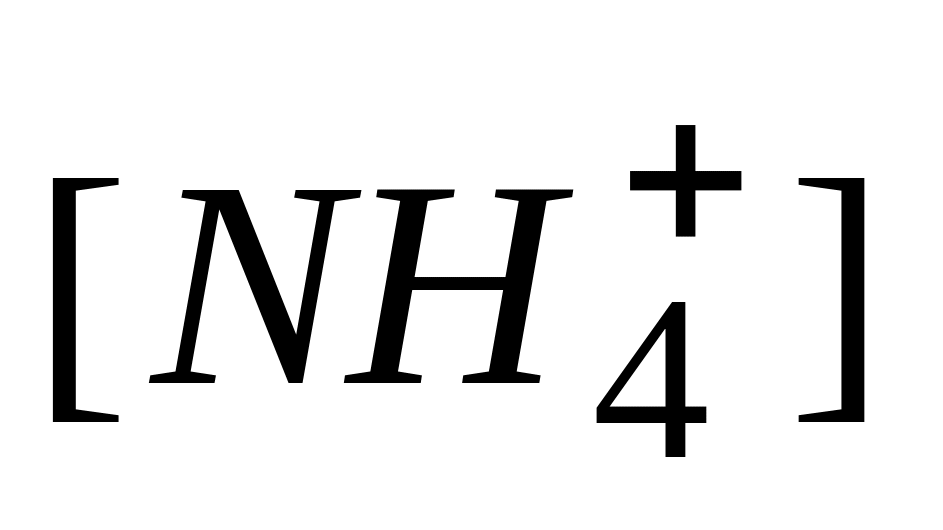 атом азота образует
атом азота образует
А. четыре связи по обменному механизму
Б. четыре связи по донорно-акцепторному механизму
* В. три связи по обменному и одну по донорно-акцепторному механизму
Г. три связи по донорно-акцепторному и одну по обменному механизму
В реакции
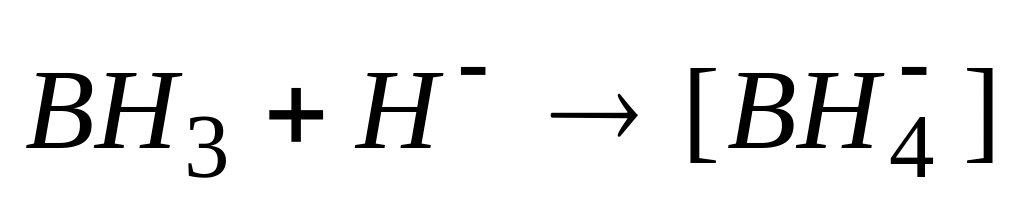 связь между атомом бора и гидрид-ионом
образуется по
связь между атомом бора и гидрид-ионом
образуется по
А. обменному механизму
* Б. донорно-акцепторному механизму
Атом азота в молекуле аммиака может
* А. быть донором электронной пары
Б. быть акцептором электронной пары
В. присоединить гидрид-ион
* Г. присоединить протон
Образование иона
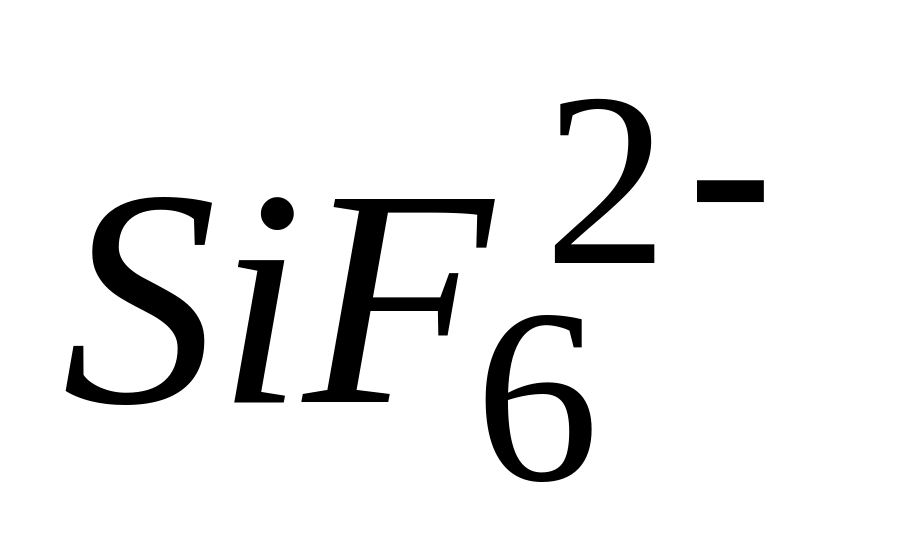
* А. возможно
Б. невозможно
Присоединять HF по донорно-акцепторному механизму могут частицы
А. ![]()
* Б.
![]()
* В. ![]()
Г. ![]()
В реакции
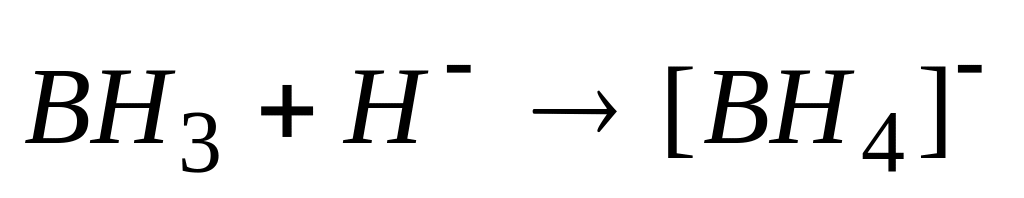 донором электронной пары является
донором электронной пары является
А. атом бора
Б. атом водорода
* В. гидрид-ион
В молекулах
 и
и
 атомы бора и азота могут быть
атомы бора и азота могут быть
А. донорами электронов
Б. акцепторами электронов
В. донором и акцептором электронов соответственно
* Г. акцептором и донором электронов соответственно
В реакции
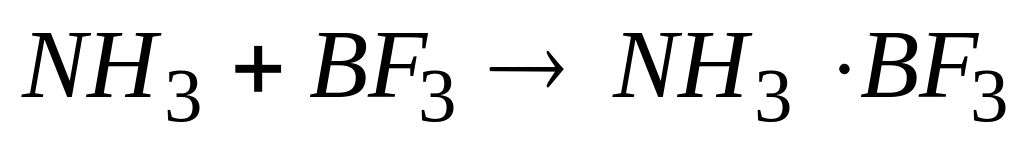
А. изменяется степень окисления атомов азота и бора
* Б. не изменяется степень окисления атомов азота и бора
* В. изменяется валентность атомов азота и бора
Г. не изменяется валентность атомов азота и бора
* Д. атом азота является донором пары электронов
В результате перекрывания атомных орбиталей по линии, соединяющей ядра атомов образуется
* А. ![]() -
связь
-
связь
Б. ![]() -
связь
-
связь
- и - связи
* А. являются разновидностями ковалентной связи
Б. являются разновидностями ионной связи
* В. различаются характером перекрывания атомных орбиталей
Г. не различаются по реакционной способности
* Д. различаются по реакционной способности
Если между двумя атомами осуществляется - и - связь, то
А. кратность связи равна 1,5
* Б. кратность связи равна 2
В. в первую очередь разрывается - связь
* Г. в первую очередь разрывается - связь
Если связь между атомами одинарная, то это
А. - связь
* Б. - связь
В. может быть - или - связь
p-орбитали принимают участие в образовании - связей в молекулах
* А. ![]()
Б.
![]()
В. ![]()
* Г. ![]()
* Д. ![]()
p-орбитали принимают участие в образовании - связей в молекулах
А.
Б.
В. ![]()
* Г. ![]()
* Д. ![]()
- связь может образоваться в результате перекрывания атомных орбиталей
А. s- и s-
Б. s- и p-
* В. p- и p-
Г. s- и d-
* Д. d- и d-
В молекуле
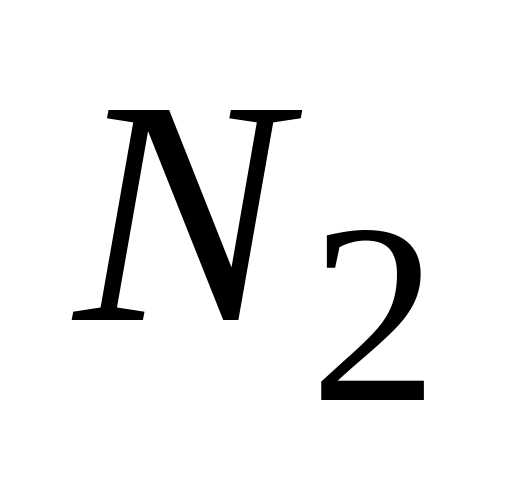 между атомами осуществляется
между атомами осуществляется
А. одинарная связь
Б. двойная связь
* В. тройная связь
С увеличением кратности связи
А. возрастает ее длина
* Б. уменьшается ее длина
* В. возрастает ее суммарная прочность
Г. уменьшается ее суммарная прочность
Наиболее прочной является связь в молекуле
А. ![]()
Б.
![]()
В. ![]()
* Г. ![]()
Наиболее прочной является связь в молекуле
* А. ![]()
Б.
![]()
В.
Максимальная валентность элементов II периода равна
А. двум
Б. трем
* В. четырем
Г. шести
Д. восьми
Максимальная валентность элементов II периода не превышает четырех, что связано с
А. числом электронов на внешнем уровне
Б. числом неспаренных электронов
* В. числом валентных орбиталей
У элементов III периода максимальная валентность
* А. соответствует номеру группы
Б. не может быть больше четырех
* В. может варьировать от одного до восьми
Максимальная валентность не соответствует номеру группы для
А. углерода
Б. серы
В. фосфора
* Г. азота
* Д. фтора
Способность атома образовывать ковалентные связи обусловлена
А. только наличием одноэлектронных облаков
Б. только наличием двухэлектронных облаков
В. только наличием свободных орбиталей
* Г. наличием как одноэлектронных, так и двухэлектронных облаков или свободных орбиталей
Гибридные орбитали
А. имеют такую же форму и энергию как и исходные атомные орбитали
* Б. имеют новую форму и другую энергию по сравнению с исходными атомными орбиталями
* В. для одного и того же типа гибридизации равноценны между собой по форме и энергии
* Г. образуют более прочные связи по сравнению с исходными атомными орбиталями
* Д. полнее перекрываются по сравнению с исходными атомными орбиталями взаимодействующих атомов
При гибридизации атомных орбиталей
* А. первоначальная форма и энергия исходных атомных орбиталей изменяется
Б. первоначальная форма и энергия исходных атомных орбиталей сохраняется
В. образуются орбитали новой разной формы и энергии
* Г. образуются орбитали новой одинаковой формы и энергии
Гибридизация возможна между орбиталями
А. 3s- и 4s-подуровней
* Б. 3s- и 3p-подуровней
* В. 4s-, 4p- и 3d-подуровней
Г. 3s- и 4p-подуровней
Для элементов второго периода возможны типы гибридизации
* А. sp -
* Б. sp2 -
* В. sp3 -
Г. sp3d2 -
Д. sp3d -
Атом бора в молекуле
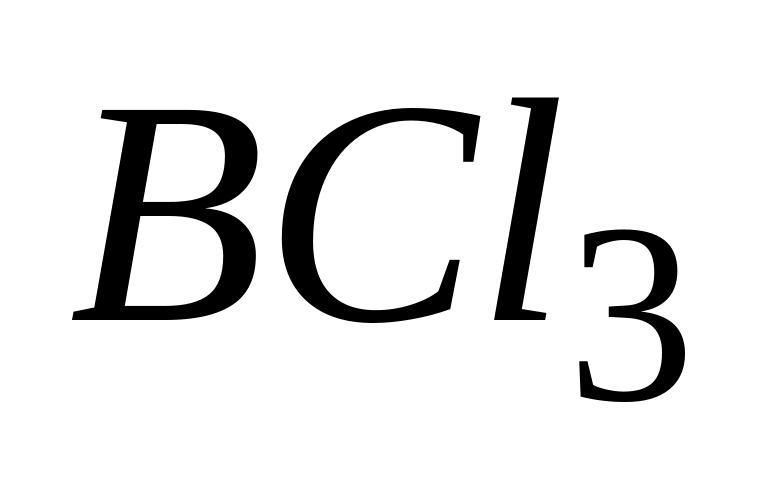 находится в
находится в
А. sp - гибридном состоянии
* Б. sp2 - гибридном состоянии
В. sp3 - гибридном состоянии
Валентный угол в
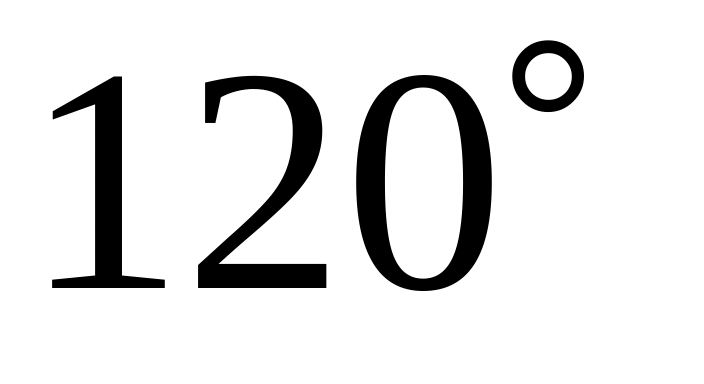 соответствует
соответствует
А. sp - гибридизации
* Б. sp2 - гибридизации
В. sp3 - гибридизации
Атом азота в ионе аммония находится в
А. sp - гибридном состоянии
Б. sp2 - гибридном состоянии
* В. sp3 - гибридном состоянии
Так же, как и в молекуле аммиака, в ионе аммония
* А. атом азота находится в состоянии sp3 - гибридизации
Б. валентные углы между связями 109028
* В. связи между атомами ковалентные полярные
* Г. атом азота имеет степень окисления –3
Молекулы и имеют
А. одинаковую пространственную конфигурацию в форме плоского треугольника
Б. одинаковую пространственную конфигурацию в форме пирамиды
* В. пространственную конфигурацию в форме пирамиды и плоского треугольника соответственно
Г. пространственную конфигурацию в форме плоского треугольника и пирамиды соответственно
Линейное строение имеют молекулы
* А. ![]()
Б. ![]()
* В. ![]()
* Г. ![]()
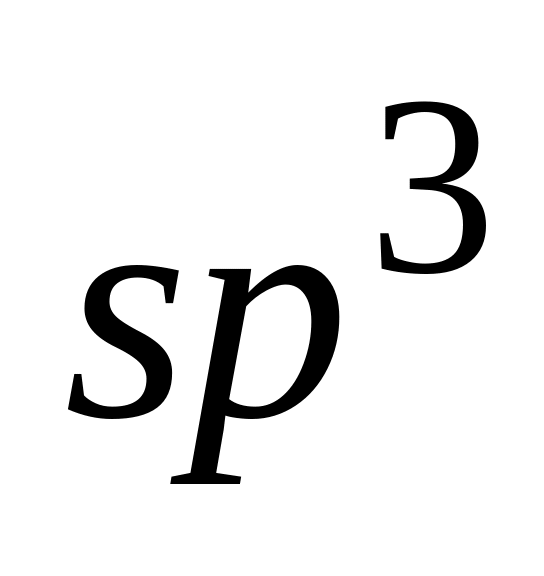 -
гибридизация осуществляется в молекулах
-
гибридизация осуществляется в молекулах
А.
Б. ![]()
* В.
* Г. ![]()
* Д. ![]()
Тетраэдрическую форму имеют частицы
А.
* Б.
В. ![]()
* Г. ![]()
* Д. ![]()
В молекуле серной кислоты атом серы находится в состоянии
А. sp - гибридизации
Б. sp2 - гибридизации
* В. sp3 - гибридизации
В молекулах серной и фосфорной кислоты атомы серы и фосфора находятся в состоянии
* А. sp3 - гибридизации
Б. sp2 - и sp3 - гибридизации соответственно
В. sp3 - и sp2 - гибридизации соответственно
В процессе превращения
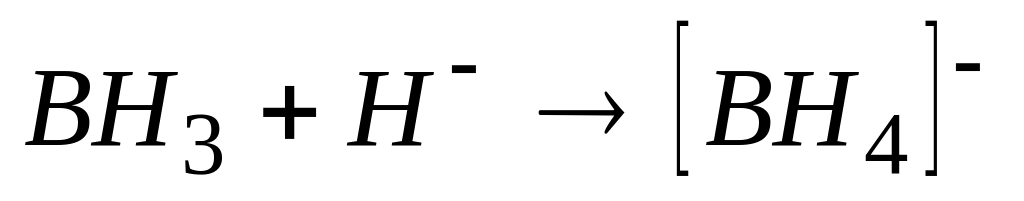
А. сохраняется тип гибридизации атома бора
* Б. изменяется тип гибридизации атома бора
В. пирамидальная частица превращается в тетраэдрическую
* Г. плоский треугольник превращается в тетраэдр
В составе АТФ атом фосфора находится в состоянии
А. ![]() -
гибридизации
-
гибридизации
Б. ![]() -
гибридизации
-
гибридизации
* В. - гибридизации
Валентный угол
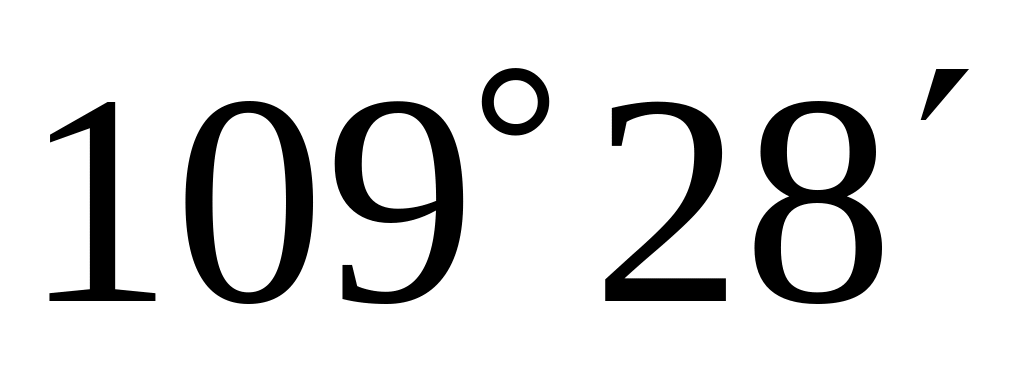 характерен для частиц
характерен для частиц
А.
Б.
![]()
*
В. ![]()
* Г. ![]()
* Д. ![]()
В молекуле воды ковалентные связи образуются при участии
А. всех гибридных орбиталей
* Б. двух гибридных орбиталей
В. трех гибридных орбиталей
Гибридизация атома кремния в структурной единице силикатов и оксида кремния:
* А. sp3 - и тетраэдр соответственно
Б. sp3 - и пирамида соответственно
В. sp2 - и плоский треугольник соответственно
Г. sp - и линейная соответственно
Длина связи в ряду HCl HBr HI
* А. увеличивается
Б. уменьшается
В. не изменяется
Длина связи в ряду HI HBr HCl
А. увеличивается
* Б. уменьшается
В. не изменяется
Водородная связь является
А. двухцентровой
* Б. трехцентровой
В. многоцентровой
При образовании водородной связи осуществляется
А. только электростатическое взаимодействие
Б. только донорно-акцепторное взаимодействие
* В. электростатическое и донорно-акцепторное взаимодействие
Из перечисленных связей самой низкой энергией характеризуется
А. ковалентная
Б. ионная
* В. водородная
В. металлическая
При образовании водородной связи атом водорода
* А. соединен одновременно с двумя другими атомами
Б. образует две ковалентные связи по обменному механизму
В. играет роль отрицательного полюса
* Г. играет роль положительного полюса
* Д. является “мостиком” между двумя атомами элементов с высокой электроотрицательностью
Наиболее прочные водородные связи образуются при участии атомов
А. хлора
* Б. фтора
В. кислорода
Г. азота
Д. серы
Водородная связь возникает между молекулами
* А. фтороводорода
* Б. спиртов
В. водорода
* Г. воды
Д. сероводорода
Внутримолекулярные водородные связи осуществляются в молекулах
А. воды
* Б. белков
* В. нуклеиновых кислот
Г. спиртов
Д. аммиака
Максимально молекула воды может образовывать
А. две водородных связи
Б. три водородных связи
* В. четыре водородные связи
Г. пять водородных связей
Д. шесть водородных связей
Образованием межмолекулярных водородных связей можно объяснить аномально высокую по сравнению с другими температуру кипения галогеноводорода
* А. ![]()
Б.
В. ![]()
Г. ![]()
Существование молекул с чисто ионной связью
А. возможно
* Б. не возможно
Формула
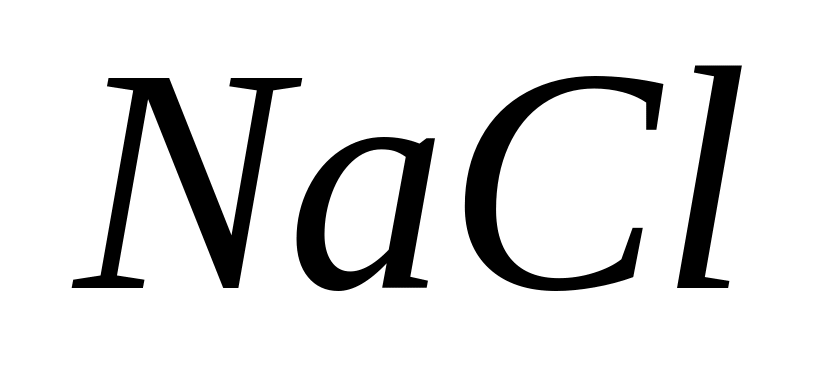 отражает
отражает
А. реальное строение молекулы хлорида натрия
* Б. соотношение катионов и анионов в кристаллической решетке
В ионной кристаллической решетке
А. каждый катион связан с определенным анионом
* Б. каждый катион взаимодейтвует со всеми анионами, находящимися поблизости
* В. каждый катион имеет электрическое поле со сферической симметрией
Г. можно выделить отдельные молекулы
* Д. нельзя выделить отдельные молекулы
Наибольшую долю ионности имеет связь в соединении
А. ![]()
Б.
![]()
В. ![]()
* Г. ![]()
Ионная связь характеризуется
А. направленностью
* Б. ненаправленностью
В. насыщаемостью
* Г. ненасыщаемостью
Неполярные молекулы с ковалентными полярными связями
![]() А.
А. ![]()
Б.
*
В. ![]()
* Г.
* Д. ![]()
Металлическая связь как и ковалентная
А. делокализована
Б. локализована
* В. имеет электростатическую природу
* Г. осуществляется за счет перекрывания атомных орбиталей
Металлическая связь в отличие от ковалентной
* А. ненаправлена
Б. направлена
* В. делокализована
Г. локализована
* Д. ненасыщаема
Металлическая связь является
А. двухцентровой
Б. трехцентровой
* В. многоцентровой
Металлическая связь характерна для
* А. металлов в твердом состоянии
* Б. металлов в расплаве
В. металлов в газообразном состоянии
Г. соединений с ионной кристаллической решеткой
* Д. сплавов
Металлическая связь осуществляется в
А. кристаллах хлорида натрия
* Б. металлическом хроме
* В. сплаве золота с серебром
* Г. интерметаллических соединениях
Наиболее прочной связью характеризуются следующие металлы
А. щелочные
Б. щелочноземельные
* В. переходные
Образование сплава может сопровождаться
* А. растворением металлов друг в друге
* Б. растворением неметалла в металле
В. растворением металла в неметалле
* Г. образованием интерметаллических соединений
В серебре неограниченно растворим металл
А. олово
Б. кадмий
В. железо
* Г. золото
Твердые растворы замещения друг с другом могут образовать
* А. ![]() и
и
![]()
Б.
и
![]()
*
В. ![]() и
и
![]()
Г.
и
![]()
Твердые растворы внедрения друг с другом могут образовать
А. и
* Б.
![]() и
и
![]()
*
В.
и
![]()
Г. и
Металлы одной подгруппы при сплавлении образуют
* А. твердые растворы замещения
Б. твердые растворы внедрения
К сплавам относятся
* А. бронза
* Б. сталь
В. расплав хлорида натрия
* Г. амальгама
Атомы металлов могут принимать участие в образовании
* А. ионных связей
Б. водородных связей
* В. металлических связей
Атомы азота могут принимать участие в образовании
* А. ковалентных неполярных связей
* Б. ковалентных полярных связей
* В. ионных связей
Г. металлических связей
* Д. водородных связей
Г лава 3. Биогенные элементы
В результате естественного отбора для построения живых организмов используются химические элементы, которые
* А. широко распространены в окружающей среде
Б. имеют небольшую распространенность в окружающей среде
В. способны образовывать прочные, стабильные связи
* Г. способны образовывать прочные, но в то же время лабильные связи
Д. имеют большой размер атома
Около 75% массы земной коры приходится на элементы
* А. O, Si
Б. O, H, C, N, S, P
В. O, H, Na, Cl
Г. O, H, Fe, S
Элементы, имеющие высокую распространенность в земной коре, но незначительное содержание в живых организмах
* А. Si
Б. O
* В. Al
Г. Ca
В составе морской воды преобладают химические элементы
А. O, H, Fe, Al, N, P
* Б. O, H, Na, Cl, Mg, S
В. O, H, Si, C, N, Fe
Г. O, H, F, Ca, P, C
И в составе человеческой крови, и в составе морской воды преобладают химические элементы
* А. натрий
* Б. кальций
В. фосфор
* Г. хлор
* Д. магний
К органогенам относятся
А. O, H, Si, P, Na, Cl
Б. O, C, Si, Al, Mg, S
* В. O, H, C, N, S, P
Г. O, N, P, S, Fe, Na
В составе живых организмов преобладают по массе химические элементы
А. которые в условиях биосферы не образуют легко растворимых соединений
* Б. которые легко образуют газы и водорастворимые соединения
* В. которые образуют подвижные в условиях биосферы соединения
Г. алюминий, кремний, титан – наиболее распространенные в земной коре
* Д. водород, углерод, азот, фосфор, находящиеся в земной коре в незначительных количествах
Элементы – органогены имеют
* А. небольшие атомные и ионные радиусы
Б. большие атомные и ионные радиусы
В. высокие значения электроотрицательности
Г. низкие значения электроотрицательности
* Д. промежуточные значения электроотрицательности
Жизненно необходимыми являются
* А. водород
Б. s-элементы второго периода
* В. s-элементы третьего периода
* Г. s-элементы четвертого периода
Д. s-элементы пятого периода
Жизненно необходимыми являются
* А. p-элементы второго периода
* Б. p-элементы третьего периода
В. p-элементы четвертого периода
Г. p-элементы пятого периода
Среди d-элементов жизненно необходимы
* А. элементы четвертого периода
Б. элементы пятого периода
В. элементы шестого периода
Биогенными являются, как правило, элементы
* А. 1-3 периода периодической системы элементов
Б. 4-6 периода периодической системы элементов
* В. с относительно легкими атомами
* Г. с небольшими порядковыми номерами
Д. с большими порядковыми номерами
Макроэлементы – это элементы, содержание которых в организме составляет
* А. более 0.01%
Б. около 0.01%
В. 0.001 – 0.01%
К макроэлементам относятся
А. O, C, H, N, P, S, Al, Fe, Ca, I
Б. O, C, H, S, P, Cl, Na, Co, Mn, F
* В. органогены и Ca, Mg, Na, Cl
* Г. O, C, H, N, P, S, Ca, Mg, Na, Cl
Некоторые микроэлементы концентрируются в определенных тканях, так
* А. иод – в щитовидной железе
* Б. фтор – в зубной эмали
В. иод – в сетчатке глаза
Г. фтор – в щитовидной железе
* Д. стронций – в костях
К жизненно необходимым (незаменимым) элементам относятся
* А. Ca
* Б. Mg
В. Sb
Г. Si
* Д. Fe
Постоянно содержатся в организме человека, входят в состав ферментов, гормонов, витаминов элементы
* А. O, H, C, N, S, P
Б. Al, Ba, Cd, Hg, Th
* В. Mn, Cu, Co, Fe, Zn, Mo
Г. Sc, Tl, In, W, Re
К “металлам жизни” относят
* А. железо
* Б. молибден
В. алюминий
Г. серебро
* Д. кальций
“Металлы жизни” по среднему содержанию в живых организмах могут являться
А. только макроэлементами
Б. только микроэлементами
В. макро-, микро-, ультрамикроэлементами
* Г. макро- и микроэлементами
Д. органогенами
Из десяти “металлов жизни”
А. все десять относятся к s-семейству
Б. все десять относятся к d-семейству
В. четыре относятся к d-семейству, шесть к s-семейству
* Г. четыре относятся к s-семейству, шесть к d-семейству
Д. все десять – элементы четвертого периода
Минеральную основу зубной ткани составляют
* А. гидроксиапатит
![]()
* Б. фторгидроксиапатит
![]()
В. сульфат
кальция
![]()
Г. фосфат
натрия
![]()
* Д. карбонатапатит
![]()
Основными минеральными компонентами зубной эмали являются
А. фторапатиты
Б. карбонатапатиты
* В. гидроксиапатиты
Г. хлорапатиты
Д. неапатиные неорганические соединения
Содержание кальция, как правило, больше
* А. в зубной эмали
Б. в дентине
В норме соотношение Ca/P составляет
* А. в эмали ~1,67
Б. в эмали ~0,26
В. в слюне ~1,67
* Г. в слюне ~0,26
Зубная ткань содержит преимущественно элементы
А. Fe
Б. Sr
* В. Ca
* Г. P
* Д. O
В состав слюны входят элементы, необходимые для формирования зубной эмали
* А. Ca
Б. Cl
В. Fe
* Г. P
Д. Pb
Использование фторсодержащих зубных паст укрепляет зубную эмаль вследствие протекания реакции
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Фторид натрия, фторид олова, монофторфосфат натрия в составе зубных паст
* А. укрепляют зубную эмаль
Б. оказывают очищающее действие
В. уменьшают pH в ротовой полости
* Г. увеличивают pH в ротовой полости
Кариес может быть вызван присутствием в ротовой полости ионов
* А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
Для зубной эмали вреден
А. только недостаток фторид-ионов в питьевой воде
Б. только избыток фторид-ионов в питьевой воде
* В. как избыток, так и недостаток фторид-ионов в питьевой воде
Оптимальное содержание фторид-ионов в питьевой воде составляет
А. 1.2 мг/л
Б. больше 1.2 мг/л
* В. 1 мг/л
Г. меньше 1 мг/л
В состав зубоврачебных цементов входят
* А. ![]()
Б. ![]()
* В. ![]()
* Г. ![]()
Д. ![]()
В состав цемент-фосфатов входят оксиды
* А.
Б. ![]()
В. ![]()
* Г. ![]()
* Д.
Гидратированная окись кремния
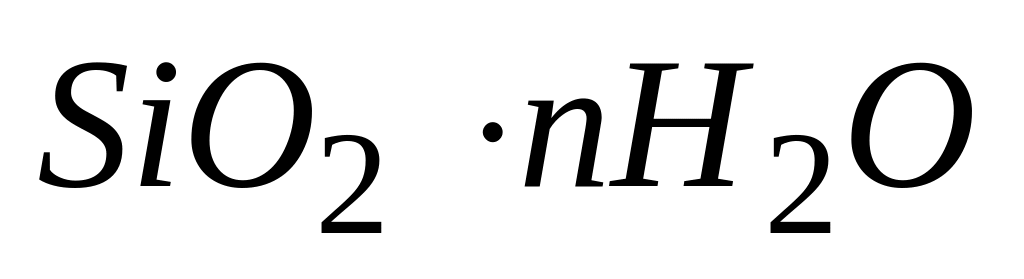 в составе зубных паст
в составе зубных паст
А. нейтрализует кислотные продукты метаболизма
Б. обладает абразивным действием
* В. гелеобразующий компонент
Реакция
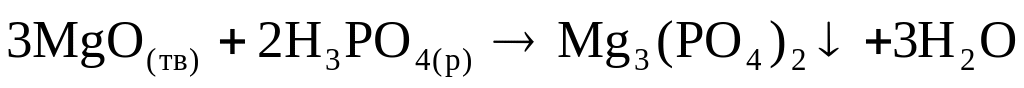 отражает механизм
отражает механизм
А. уменьшения кислотности желудочного сока
* Б. получения материала "цемент- фосфат для фиксации несъемных протезов" в стоматологии
В. образования гидроксиапатита зубной эмали
Оксид магния используется в медицине
* А. для уменьшения кислотности желудочного сока
* Б. в составе стоматологических цементов
В. для укрепления зубной эмали
Г. для укрепления скелета
В костной и зубной ткани концентрируются элементы
* А. P
* Б. Ca
В. Fe
Г. Cu
* Д. Mg
Натрий и хлор содержатся, в основном,
* А. во внеклеточных жидкостях
Б. во внутриклеточных жидкостях
Калий и магний содержатся, в основном,
А. во внеклеточных жидкостях
* Б. во внутриклеточных жидкостях
Для поглощения углекислого газа и регенерации кислорода на подводных лодках и космических кораблях используют
А. гидроксиды натрия или калия
Б. карбонаты натрия или калия
В. карбонат кальция
* Г. пероксиды натрия или калия
Д. хлориды натрия или калия
В качестве антацидных средств для уменьшения кислотности желудочного сока используют
* А. оксид магния
Б. оксид натрия
* В. карбонат кальция
* Г. гидрокарбонат натрия
Д. гипс
С увеличением заряда ядра атома в данной подгруппе периодической системы, как правило,
А. увеличивается содержание элементов в организме
Б. уменьшается токсичность элементов
* В. уменьшается содержание элементов в организме
* Г. увеличивается токсичность элементов
Замещение одних элементов другими в биологических системах
А. всегда приводит к ослаблению физиологической активности (антагонизму)
Б. всегда приводит к усилению физиологической активности (синергизму)
* В. может привести к синергизму или к антагонизму
В виде гидратированных ионов
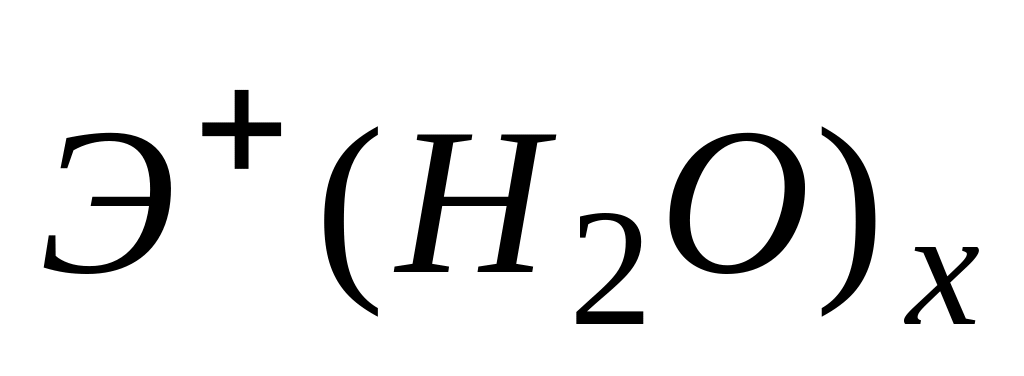 в организме находятся
в организме находятся
* А. s-элементы I группы периодической системы
Б. s-элементы II группы периодической системы
В. p-элементы VII группы периодической системы
Г. p-элементы VI группы периодической системы
Координация с анионами через атом кислорода характерна
А. для всех s-элементов II группы периодической системы
* Б. для всех s-элементов I группы периодической системы
В. из s-элементов II группы периодической системы только для Mg
* Г. для всех s-элементов II группы периодической системы кроме Mg
В процессе кроветворения 3d-элементы проявляют
* А. синергизм
Б. антагонизм
В. синергизм и антагонизм
В виде гидратированных ионов
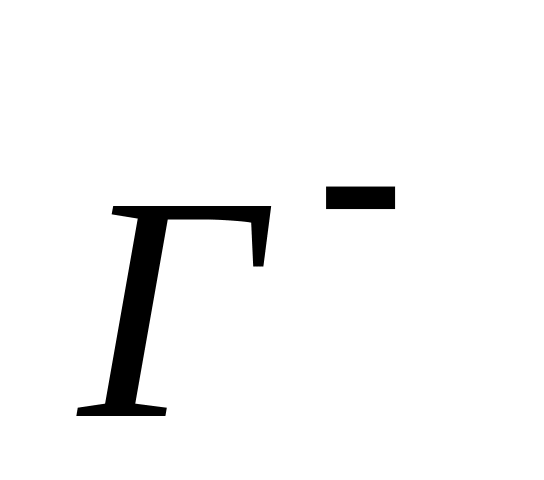 в организме обычно находятся
в организме обычно находятся
А. фтор
* Б. хлор
* В. бром
Г. йод
Взаимозамещаемы в организме
А. фтор, хлор, бром, йод
Б. фтор, хлор, бром
В. фтор, бром, йод
* Г. хлор, бром, йод
Сходство водорода со щелочными металлами выражается
* А. в
образовании иона
![]()
Б. в
образовании иона
![]()
* В. в проявлении восстановительных свойств
* Г. во взаимодействии с неметаллами
Д. во взаимодействии с металлами
Так же как и некоторые галогены, водород
* А. при обычных условиях находится в газообразном состоянии
* Б. образует двухатомную молекулу
* В. образует анион в соединениях с металлами
Г. при обычных условиях может находится в жидком состоянии
Д. обладает восстановительной способностью
По числу атомов в организме человека первое место занимает
А. кислород
* Б. водород
В. азот
Г. сера
Д. фосфор
В организме водород находится
* А. в соединениях с углеродом, азотом, серой
* Б. в
виде гидратированных ионов
![]()
В. в соединениях с металлами
Г. в виде простого вещества
Во всех соединениях, содержащихся в живых организмах, водород имеет степень окисления, равную
А. 0
Б. –1
* В. +1
В живых организмах водород
А. проявляет степень окисления 0
* Б. проявляет степень окисления +1
В. проявляет окислительные свойства
Г. проявляет восстановительные свойства
* Д. не проявляет ни окислительных, ни восстановительных свойств
Катион водорода активно участвует в окислительно-восстановительных реакциях в организме, при этом он
А. восстанавливается
* Б. не изменяет степени окисления
* В. способствует превращению биосубстратов в продукты реакции
Г. взаимодействует с сильными восстановителями
Д. проявляет окислительные свойства
Из щелочных металлов по содержанию в организме к макроэлементам относятся
А. Li
* Б. Na
* В. K
Г. Rb
Д. Cs
Натрий в организме находится преимущественно
А. во внутриклеточной жидкости
* Б. во внеклеточной жидкости
* В. в костной ткани
Основным внутриклеточным катионом является
А. натрий
* Б. калий
В. кальций
Г. магний
Использование гидрокарбоната натрия в медицине основано на его способности
* А. нейтрализовать продукты кислого характера
* Б. к гидролизу
В. медленно всасываться в кишечнике
В передаче нервных импульсов через мембраны нервных клеток принимают участие ионы
* А. натрия
* Б. хлора
* В. калия
Г. железа
Д. меди
Натрий и калий, как правило, являются
А. синергистами
* Б. антагонистами
Из s-элементов II группы макроэлементами по содержанию в организме являются
А. Be
* Б. Mg
* В. Ca
Г. Sr
Д. Ba
Основные функции ионов
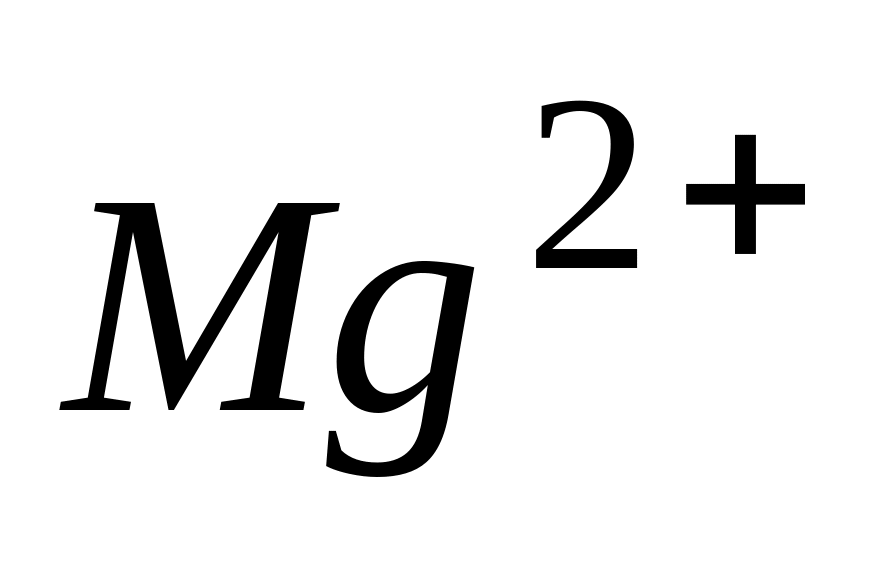 в организме
в организме
* А. участие в образовании активной формы АТФ
Б. регулирование водно-солевого обмена
* В. поддержание устойчивости рибосом
* Г. активирование ферментов фосфатазы
С биолигандами, содержащими фосфатные группы, ионы и
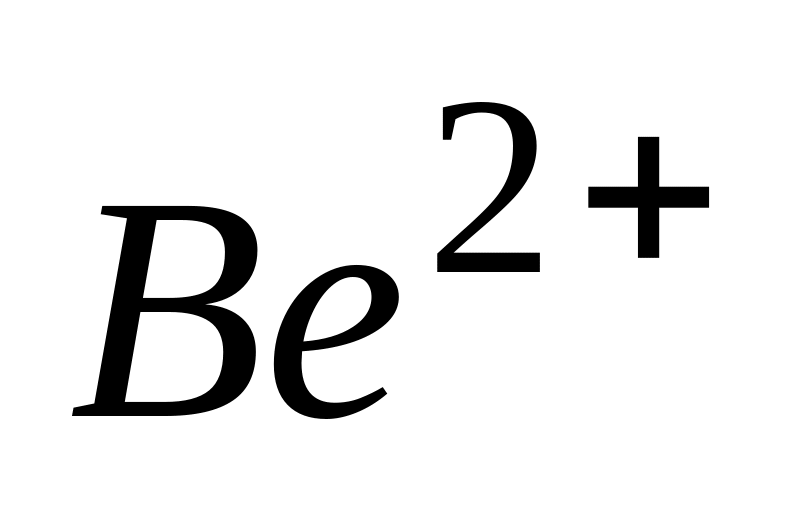 образуют
образуют
А. тетраэдрические
комплексы (![]() -гибридизация)
-гибридизация)
Б. октаэдрические
комплексы (![]() -гибридизация)
-гибридизация)
В. тетраэдрические комплексы ( -гибридизация) и октаэдрические комплексы ( -гибридизация) соответственно
* Г. октаэдрические
комплексы (![]() -гибридизация)
и тетраэдрические комплексы (
-гибридизация)
соответственно
-гибридизация)
и тетраэдрические комплексы (
-гибридизация)
соответственно
Ионы
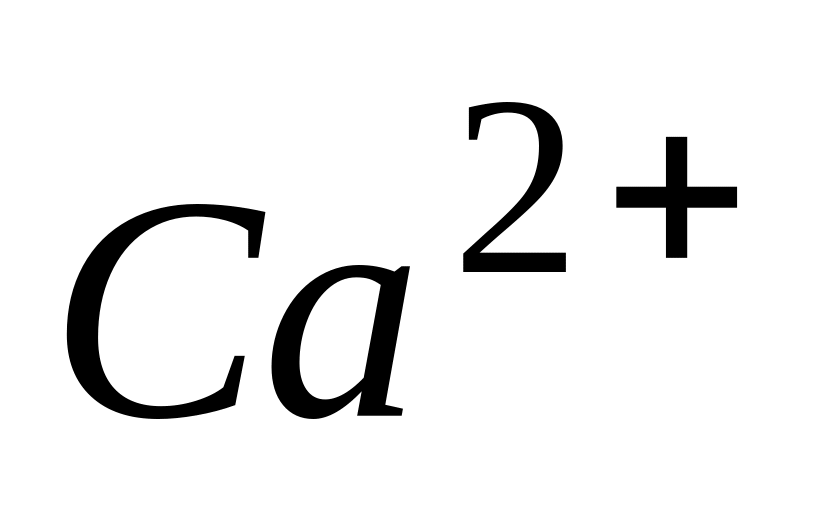 и
в биохимических процессах обычно
и
в биохимических процессах обычно
* А. антагонисты
Б. синергисты
Причина антагонизма ионов и в биохимических процессах
* А. различные размеры
* Б. различные координационные числа
* В. различные энергии ионизации
Г. различное строение валентных электронных оболочек
По своим физико-химическим свойствам и физиологическому действию иону ближе всего ион
А.
Б.
* В. ![]()
Г. ![]()
Разрушение зубной эмали, содержащей в своем составе
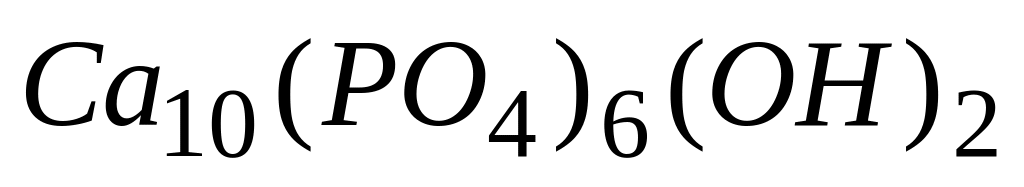 ,
может быть вызвано
,
может быть вызвано
А. увеличением pH слюны
* Б. уменьшением pH слюны
В. увеличением
![]() в слюне
в слюне
* Г. уменьшением в слюне
В организме d-элементы находятся в такой степени окисления, в которой они
А. являются сильными окислителями
Б. являются сильными восстановителями
* В. не являются ни сильными окислителями, ни сильными восстановителями
d – элементы, кроме молибдена, в состав соединений в организме входят:
* А. в низшей степени окисления
Б. в высшей степени окисления
В. в промежуточной степени окисления
Катионы ,
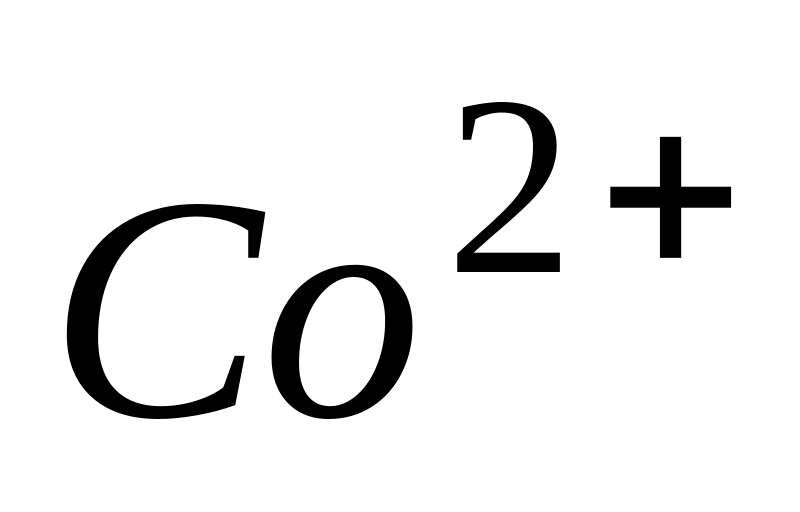 ,
,
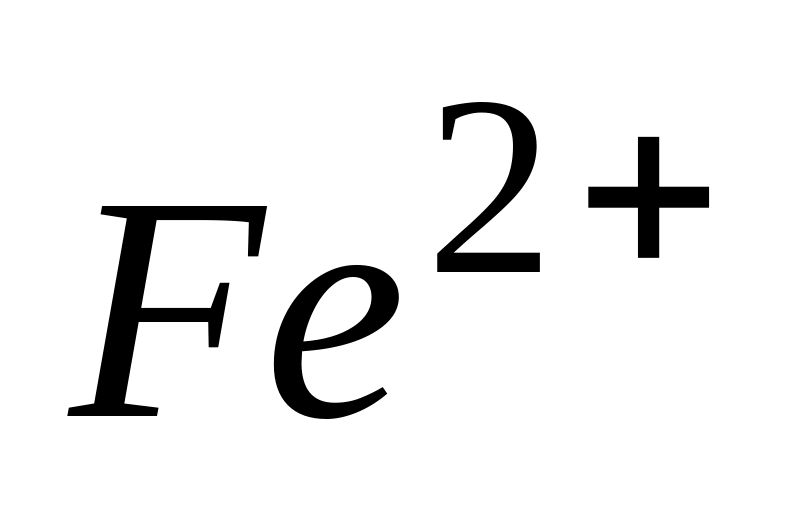 в биологических средах при физиологических
значениях pH
в биологических средах при физиологических
значениях pH
* А. не являются сильными восстановителями
Б. являются сильными восстановителями
* В. стабилизируются окружающими лигандами
Биологическая роль d-элементов обусловлена, в основном,
А. их склонностью к образованию кратных связей
* Б. их склонностью к комплексообразованию с использованием d-подуровня
* В. их каталитическим действием
В организме d-элементы существуют в виде
А. свободных (не гидратированных) катионов
* Б. гидратированных катионов
* В. комплексных соединений
Г. анионов
При образовании комплексных соединений d-элементы используют
А. только незаполненные d-орбитали
Б. только электроны d-подуровня
* В. незаполненные d-орбитали и электроны d-подуровня
Из соединений хрома наибольшим токсическим действием обладают
А. соединения Cr(II)
Б. соединения Cr(III)
* В. соединения Cr(VI)
Марганец концентрируется главным образом
* А. в костной ткани
Б. в крови
В. в слюне
* Г. в печени
* Д. в почках
В составе ферментов марганец принимает участие
* А. в углеводном обмене
* Б. в процессе свертывания крови
* В. в процессе аккумуляции и переноса энергии
* Г. в минерализации зубной эмали
Д. в передаче нервных импульсов
Использование раствора перманганата калия в медицинской практике связано с его
* А. сильными окислительными свойствами
* Б. кровоостанавливающими свойствами
В. сильными восстановительными свойствами
* Г. антисептическими свойствами
Д. обезболивающими свойствами
В организме большая часть железа сосредоточена
А. в костной ткани
Б. в слюне
В. в спинно-мозговой жидкости
* Г. в крови
В состав гемоглобина железо входит в степени окисления
А. 0
* Б. +2
В. +3
Г. +6
В молекуле гемоглобина степень окисления +2 железа стабилизирована
А. порфирином
* Б. глобином
* В. белковым лигандом
При вдыхании угарного газа гемоглобин
* А. теряет способность переносить кислород
* Б. превращается в карбонилгемоглобин
В. превращается в оксигемоглобин
Г. превращается в миоглобин
В составе цитохромов
А. присутствует только
Б. присутствует
только
![]()
* В. происходит взаимопревращение и
В организме медь концентрируется, в основном,
* А. в крови
Б. в костной ткани
* В. в печени
* Г. в головном мозге
Д. в слюне
Как правило, все используемые в медицине соединения серебра являются препаратами
* А. наружного действия
Б. внутреннего действия
Бактерицидные свойства соединений серебра связаны с его способностью
* А. свертывать белки
* Б. образовывать нерастворимые альбуминаты
В. проявлять восстановительные свойства
С участием цинка катализируются реакции
* А. без переноса электронов
Б. с переносом электронов
Среди перечисленных переходных металлов переменную степень окисления не проявляет
А. медь
Б. железо
В. молибден
* Г. цинк
Растворение металлов в ртути
А. всегда сопровождается образованием химических соединений
Б. никогда не сопровождается образованием химических соединений
* В. иногда сопровождается образованием химических соединений
Практически нерастворимы в ртути
А. кадмий
Б. медь
* В. титан
* Г. молибден
Д. калий
Химические соединения с ртутью могут образовывать
* А. натрий
* Б. калий
* В. медь
Г. вольфрам
Д. тантал
В стоматологии используют амальгамы, содержащие
А. натрий
* Б. серебро
* В. олово
Г. свинец
* Д. кадмий
Амальгамы, используемые в стоматологии, должны
* А. быть химически инертными
Б. быть жидкими при комнатной температуре
* В. затвердевать при температуре человеческого тела
* Г. легко размягчаться при нагревании
* Д. быть достаточно стойкими к действию кислот
В состав стоматологических сплавов могут входить
* А. медь
* Б. золото
* В. серебро
Г. натрий
* Д. олово
В стоматологии используют сплавы
* А. золото-серебро-медь
Б. железо-никель
* В. золото-серебро-олово
Г. бронза
* Д. висмут-олово-галлий
В состав сплавов, используемых для металлокерамики, входят железо, хром, никель, титан, марганец, кремний, молибден, цинк, серебро, золото. Перечисленные элементы
А. относятся к s- и d-семействам
Б. относятся к d-семейству за исключением цинка
* В. относятся к d-семейству за исключением кремния
Г. активные металлы
Д. образуют легкоплавкие сплавы
В состав легкоплавких сплавов, используемых для штампов, могут входить
* А. свинец
Б. вольфрам
В. титан
* Г. олово
* Д. висмут
Алюминий влияет на
* А. развитие эпителиальной и соединительной ткани
* Б. регенерацию костных тканей
В. водно-солевой обмен
* Г. обмен фосфора
В состав многих пломбировочных материалов входит . Пища с повышенной кислотностью:
А. укрепляет такие пломбы
* Б. разрушает такие пломбы
В. не влияет на такие пломбы
В состав стоматологических цементов алюминий входит в виде
* А. каолина
* Б. ![]()
В. квасцов
Г. ![]()
Фарфоровые массы, применяемые в стоматологии, содержат
* А. кварц
![]()
Б. гашеную
известь
![]()
* В. полевой
шпат
![]()
* Г. каолин
Биологическая роль углерода обусловлена
* А. малыми размерами его атома
* Б. промежуточным значением электроотрицательности
В. его способностью образовывать ионные связи
* Г. его способностью образовывать малополярные ковалентные связи с жизненно важными элементами
Атомы углерода в организме
* А. формируют скелет молекул органических соединений
* Б. играют ключевую роль в окислительно-восстановительны процессах
* В. проявляют окислительно-восстановительную двойственность
Г. всегда восстановители
Д. образуют только связи C-C
Применение фторида олова
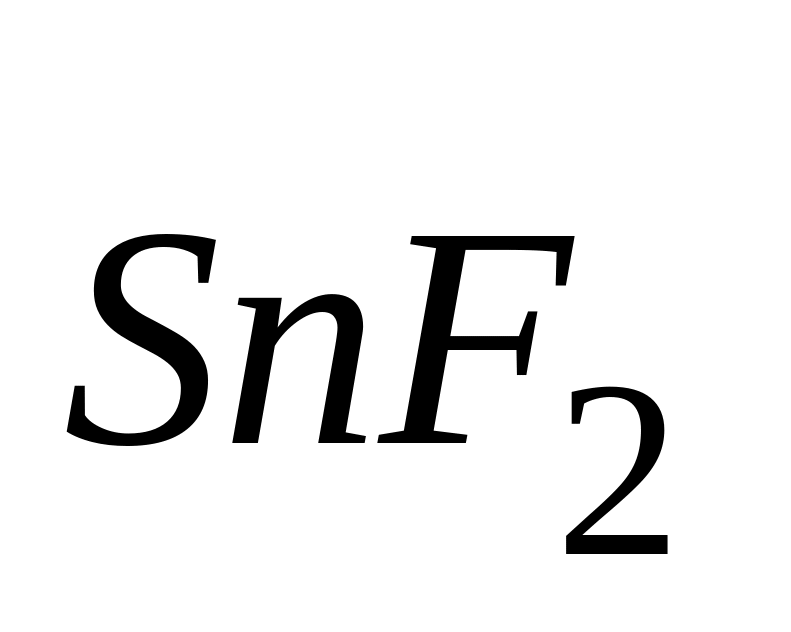 как средства против кариеса связано
как средства против кариеса связано
* А. с укреплением гидроксиапатита зубной эмали включением в него ионов
* Б. с
укреплением гидроксиапатита зубной
эмали включением в него ионов
![]()
* В. с нейтрализацией кислых продуктов в ротовой полости
Г. с образованием кислых продуктов в ротовой полости
Наиболее токсичным элементом IVA-подгруппы является
А. кремний
Б. олово
* В. свинец
Аммиак в организме образуется в результате распада
* А. аминокислот
* Б. нуклеиновых кислот
В. углеводов
Г. жиров
Нейтральные молекулы аммиака в отличие от ионов аммония
* А. могут проникать через клеточные мембраны
Б. не могут проникать через клеточные мембраны
Токсическое воздействие на мозг оказывают
А. ионы аммония
* Б. молекулы аммиака
Токсичность нитритов связана
* А. с их дезаминирующим воздействием на ДНК
* Б. с их окислительным воздействием на в гемоглобине
В. с их окислительно-восстановительной двойственностью
Для азота в биомолекулах характерны связи с
* А. углеродом
Б. кислородом
* В. водородом
Г. серой
Фосфор в биомолекулах образует связи с
* А. кислородом
Б. серой
В. углеродом
Г. водородом
Фосфаты в живых организмах
А. только органические
Б. только неорганические
* В. органические и неорганические
* Г. служат структурными компонентами скелета, клеточных мембран, нуклеиновых кислот
* Д. аккумулируют и переносят энергию
Органические фосфаты в организме образуют основу
А. костной ткани
* Б. клеточных мембран
* В. нуклеиновых кислот
Г. буферной системы плазмы крови
* Д. веществ-аккумуляторов энергии
Мышьяк концентрируется в
* А. костях
* Б. волосах
В. крови
* Г. легких
* Д. мозговой ткани
В биомолекулах для кислорода характерны связи
* А. O – H
* Б. O – C
* В. O – P
Г. O – Si
* Д. O – O
И кислород, и азот в организме
А. могут быть простыми ионами
* Б. не могут быть простыми ионами
* В. образуют ковалентные полярные связи
* Г. образуют связи, которые легко разрываются при биохимических превращениях
В организме все галогены находятся в степени окисления
А. 0
* Б. –1
В. +1
Г. +5
Д. +7
В организме
* А. хлор и йод – незаменимые элементы
* Б. хлор - макроэлемент
В. бром - макроэлемент
Г. йод - макроэлемент
Д. фтор - макроэлемент
Фтор концентрируется в
* А. костной и зубной ткани
* Б. ногтях
В. щитовидной железе
Г. крови
Хлорид-ион участвует в
* А. регуляции водно-солевого обмена
* Б. создании осмотического давления
* В. активации ферментов
Г. регуляции работы щитовидной железы
Йод в организме концентрируется в основном в
* А. щитовидной железе
Б. желудочном соке
В. костной ткани
Г. мышечной ткани
В отличие от хлора йод
* А. мягкий окислитель
Б. более сильный окислитель
* В. оказывает антисептическое действие
* Г. образует
растворимый в воде комплекс
![]()
* Д. хуже растворяется в воде, чем в органических растворителях
Соль, раствор которой образует осадки как при обработке раствором щелочи, так и при обработке раствором хлорида бария
* А. CuSO4
Б. AlCl3
В. Na2SO4
Б. AlCl3
Г. (NH4)2SO4
Массовая доля водорода в организме человека составляет 10%, а кислорода 62%. Соотношение между числом атомов водорода и кислорода
А. ![]()
Б. ![]()
В. ![]()
* Г. ![]()
Д. ![]()
В человеческом организме содержится примерно 25мг иода, причем половина всей массы – в щитовидной железе. Число атомов иода в щитовидной железе
А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
Д. ![]()
Массовая доля цинка в яде кобры составляет 0,5%. В одной капле (30мг) яда содержится
* А. ![]() атомов цинка
атомов цинка
Б. ![]() атомов цинка
атомов цинка
В. ![]() атомов цинка
атомов цинка
* Г. 0,15мг цинка
Д. 0,5мг цинка
Г лава 4. Химическая кинетика и химическое равновесие
Большинство химических реакций является
А. простыми
Б. одностадийными
* В. сложными
* Г. многостадийными
Д. цепными
Гетерогенными являются реакции:
А. H2
(г) + I2 (г)
![]()
2HI(г)
2HI(г)
* Б. 4Al(тв) + 3O2 (г) 2Al2O3 (тв)
В. Hb(р-ор) + O2 (р-ор) HbO2 (р-ор)
* Г. Zn(тв) + 2HCl(р-ор) H2 (г) + ZnCl2 (р-ор)
Биохимические реакции в организме
А. всегда гомогенны
Б. всегда гетерогенны
* В. могут быть и гомогенными, и гетерогенными
Реакция гашения извести
А. является гомогенной
* Б. является гетерогенной
* В. протекает на границе раздела фаз твердое тело – жидкость
Разрушение гидроксиапатита зубной эмали под действием кислот
 является
является
А. гомогенной реакцией
* Б. гетерогенной реакцией
В равновесной системе
 гомогенной является
гомогенной является
* А. прямая реакция
Б. обратная реакция
Биохимические реакции являются
А. простыми
* Б. сложными
В. одностадийными
* Г. многостадийными
Скорость химической реакции может быть выражена через изменение концентраций
А. только исходных веществ
Б. только продуктов реакции
* В. исходных веществ или продуктов реакции
Скорость химической реакции
А. может быть отрицательной
* Б. не может быть отрицательной
* В. может быть равной нулю
* Г. в ходе реакции изменяется
Д. в ходе реакции не изменяется
Наличие в уравнении химической реакции больших стехиометрических коэффициентов указывает на
* А. сложный механизм реакции
Б. простой механизм реакции
В. невозможность протекания реакции
Две различные гомогенные реакции протекают с выделением
 .
За одну минуту в первой реакции
образовалось 2,24л
(н.у.), а в другой – 44г
.
Если обьемы реакционных сосудов
одинаковы, то
.
За одну минуту в первой реакции
образовалось 2,24л
(н.у.), а в другой – 44г
.
Если обьемы реакционных сосудов
одинаковы, то
А. скорость первой реакции больше скорости второй реакции
* Б. скорость первой реакции меньше скорости второй реакции
В. скорости первой и второй реакции одинаковы
Для реакции
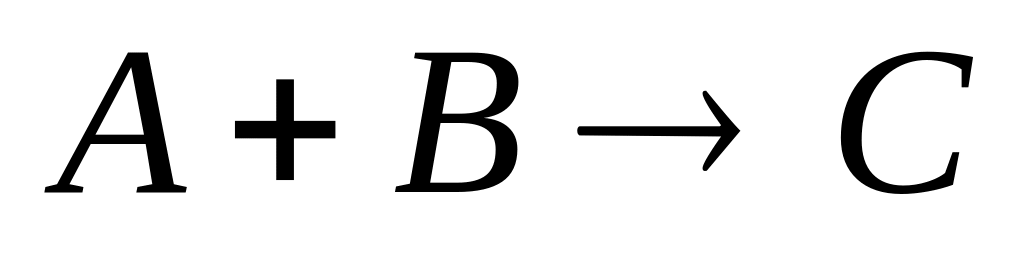 средняя скорость может быть определена
средняя скорость может быть определена
* А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Размерность скорости гомогенной химической реакции
* А. моль/л·с
Б. моль/м2·с
В. моль/кг·с
Размерность скорости гетерогенной химической реакции
А. моль/л·с
* Б. моль/м2·с
В. моль/кг·с
Кинетическое уравнение химической реакции
* А. является математическим выражением закона действующих масс
Б. является математическим выражением принципа Ле-Шателье.
* В. содержит молярные концентрации реагирующих веществ
Г. содержит массовые доли реагирующих веществ
* Д. справедливо при постоянной температуре
Кинетическое уравнение прямой реакции
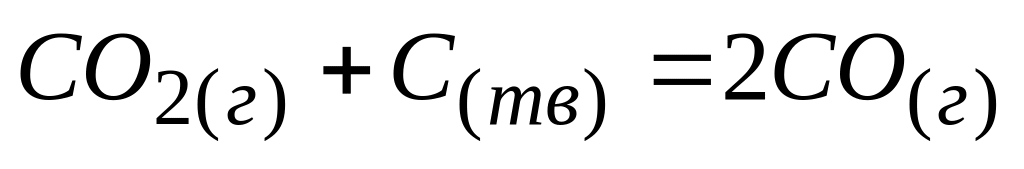 включает концентрации
включает концентрации
А. всех участников реакции
Б. всех исходных веществ
* В. только диоксида углерода
Г. только углерода
Д. только монооксида углерода
Если начальные концентрации веществ А и В составляли 0.5 и 0.4 моль/л соответственно и через 20 секунд после начала реакции концентрация вещества С равна 0.2моль/л, то средняя скорость реакции равна
А. 0.025 моль/л·с
Б. 0.02 моль/л·с
* В. 0.01 моль/л·с
Г. 0.015 моль/л·с
Математическая запись закона действующих масс для реакции, протекающей по уравнению
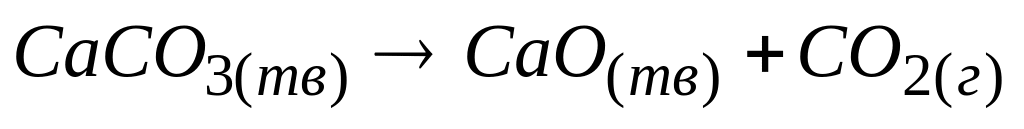
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Для прямой реакции
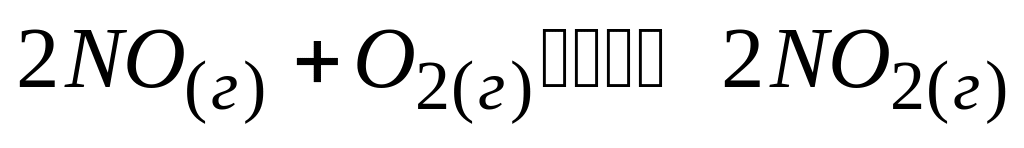 кинетическое уравнение имеет вид
кинетическое уравнение имеет вид
* А. ![]()
Б. ![]()
В. ![]()
Г. ![]()
При уменьшении обьема системы в 3 раза скорость прямой реакции
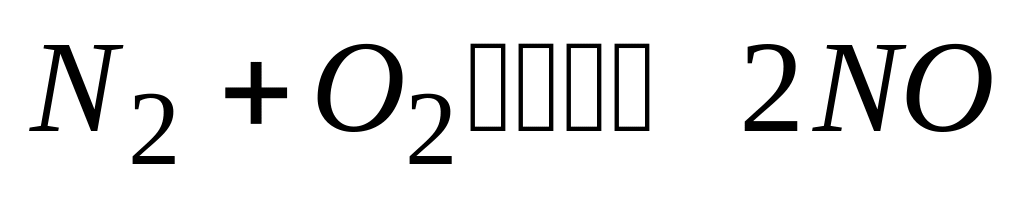
А. возрастает в 3 раза
* Б. возрастает в 9 раз
В. уменьшается в 3 раза
Г. уменьшается в 9 раз
При увеличении давления в системе в 2 раза скорость химической реакции
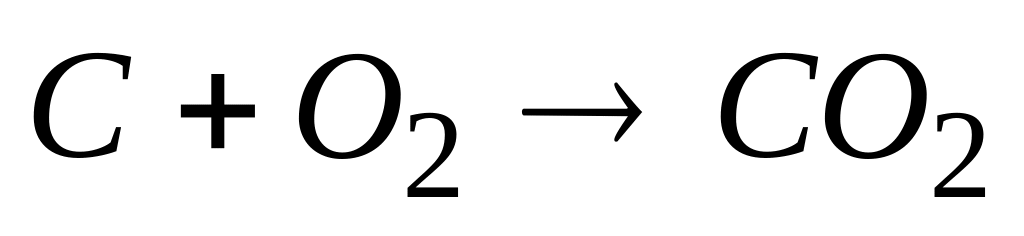
* А. возрастает в 2 раза
Б. возрастает в 4 раза
В. уменьшается в 2 раза
Г. уменьшается в 4 раза
Для увеличения скорости прямой реакции
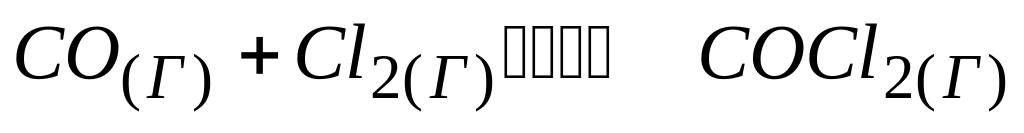 в 9 раз необходимо
в 9 раз необходимо
А. увеличить давление в 9 раз
* Б. увеличить давление в 3 раза
В. увеличить обьем реакционной смеси в 3 раза
* Г. уменьшить обьем реакционной смеси в 3 раза
Д. уменьшить обьем реакционной смеси в 9 раз
Для увеличения в 8 раз скорости синтеза аммиака по реакции
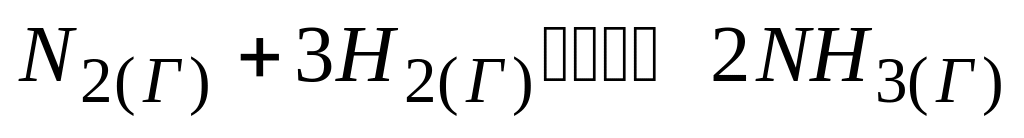 концентрацию водорода нужно увеличить
концентрацию водорода нужно увеличить
А. в 8 раз
Б. в 2.5 раза
* В. в 2 раза
Г. в 64 раза
Д. в 512 раз
Чтобы при уменьшении концентрации вещества A в 2 раза скорость химической реакции
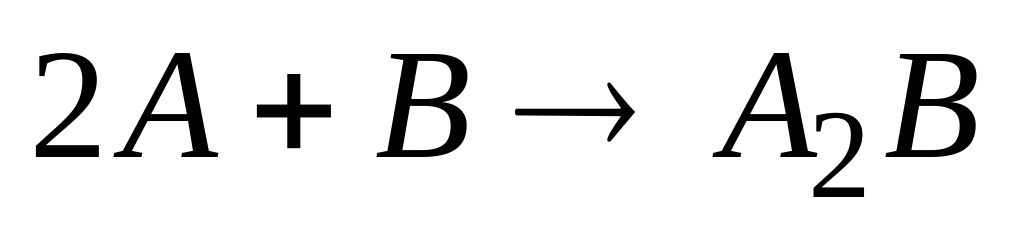 не изменилась, концентрацию вещества
B нужно
не изменилась, концентрацию вещества
B нужно
А. увеличить в 2 раза
* Б. увеличить в 4 раза
В. увеличить в 8 раз
Г. уменьшить в 2 раза
Д. уменьшить в 4 раза
Если скорость реакции
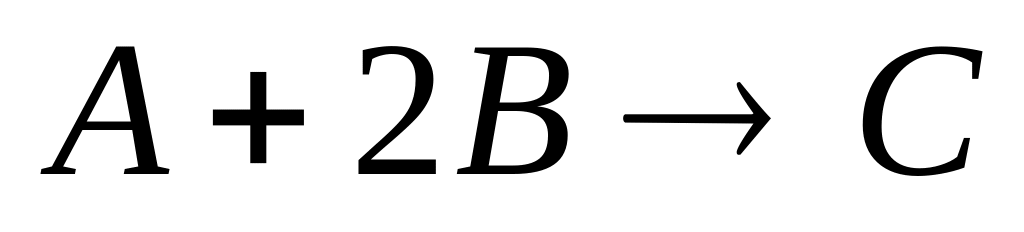 равна
равна
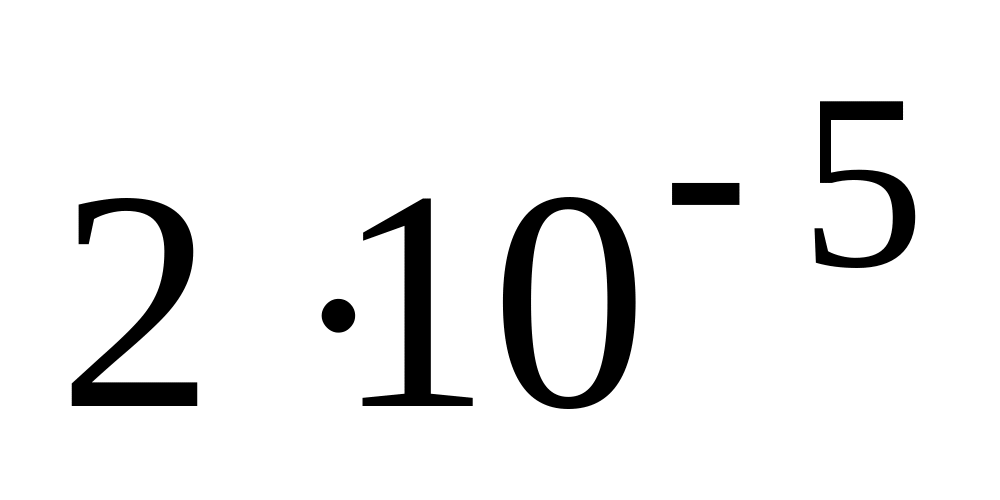 моль/л·с при концентрациях А и В 0.2 и
0.1 моль/л соответственно, то константа
скорости этой реакции равна
моль/л·с при концентрациях А и В 0.2 и
0.1 моль/л соответственно, то константа
скорости этой реакции равна
* А. ![]()
![]()
Б. ![]()
![]()
В. ![]()
Если константа скорости реакции равна
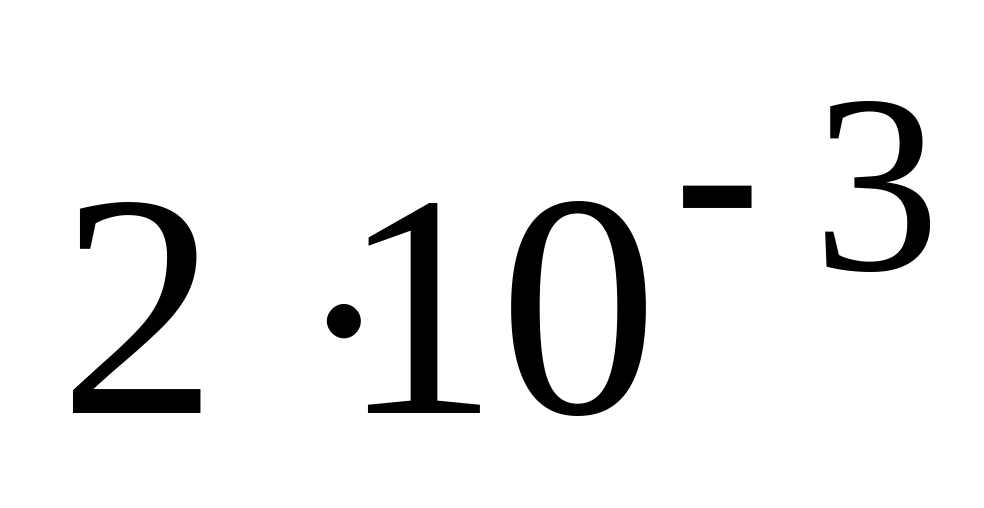
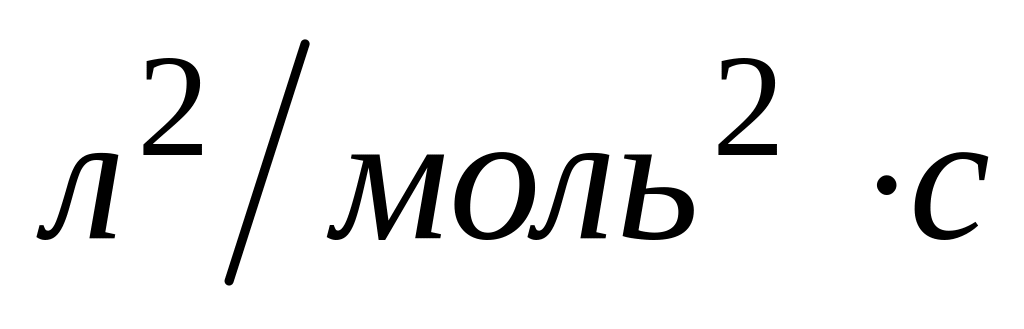 при концентрациях A и B по 0.2 моль/л, то
начальная скорость этой реакции равна
при концентрациях A и B по 0.2 моль/л, то
начальная скорость этой реакции равна
* А. ![]() моль/л·с
моль/л·с
Б. ![]() моль/л·с
моль/л·с
В. ![]() моль/л·с
моль/л·с
Г. ![]() моль/л·с
моль/л·с
Скорость реакции
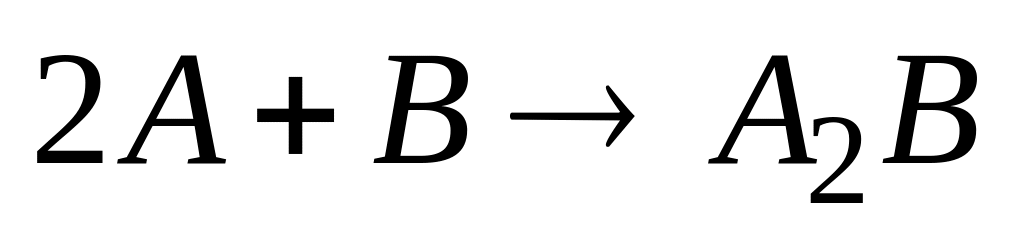 при увеличении концентрации вещества
A в 2 раза и одновременном уменьшении
концентрации вещества B в 2 раза
при увеличении концентрации вещества
A в 2 раза и одновременном уменьшении
концентрации вещества B в 2 раза
А. возрастает в 4 раза
* Б. возрастает в 2 раза
В. не изменяется
Г. уменьшается в 2 раза
Д. уменьшается в 4 раза
При повышении общего давления газовой смеси вдвое скорости прямой и обратной реакции
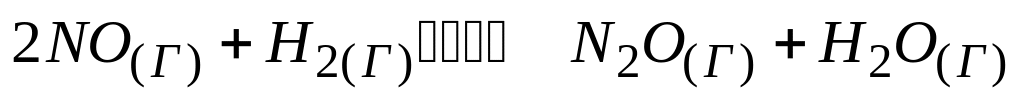 увеличатся:
увеличатся:
* А. в 8 и 4 раза соответственно
Б. в 2 раза
В. в 6 и 4 раза соответственно
Г. в 4 раза
Давление практически не влияет на скорость реакций
* А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Скорость гомогенной химической реакции в растворе зависит от
* А. концентрации реагирующих веществ
* Б. температуры
* В. катализатора
Г. давления
* Д. природы реагирующих веществ
Константа скорости химической реакции от концентрации реагирующих веществ
А. зависит
* Б. не зависит
И скорость, и константа скорости химической реакции зависят от
* А. природы реагирующих веществ
Б. концентрации реагирующих веществ
* В. температуры
* Г. катализатора
Численное значение константы скорости химической реакции в газовой фазе изменится
* А. при замене одного катализатора другим
Б. при изменении концентрации реагирующих веществ
* В. при повышении температуры
* Г. при понижении температуры
Д. при изменении обьема реакционной системы
Дробное значение не может принимать
А. константа скорости реакции
Б. константа равновесия
В. порядок реакции
Г. скорость реакции
* Д. молекулярность реакции
Мономолекулярными являются реакции
* А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
Бимолекулярными являются реакции
А. ![]()
* Б. ![]()
* В. ![]()
Г.
Реакция имеет порядок
А. первый
Б. второй
* В. нулевой
Реакция имеет
А. первый порядок по углероду и первый порядок по кислороду
Б. нулевой порядок по углероду и нулевой порядок по кислороду
* В. нулевой порядок по углероду и первый порядок по кислороду
Г. суммарный нулевой порядок
* Д. суммарный первый порядок
Молекулярность и общий порядок совпадают для реакций
* А.
Б.
В. сахароза
+
![]() глюкоза + фруктоза
глюкоза + фруктоза
* Г. ![]()
Мономолекулярными, как правило, являются реакции
* А. разложения (термического распада)
Б. обмена
В. замещения
* Г. изомеризации
Реакция
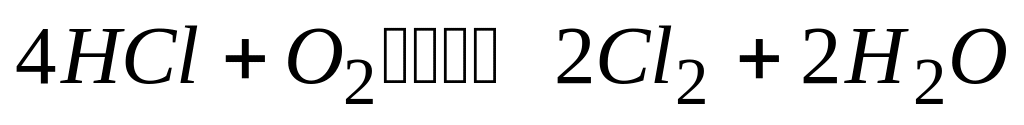
А. пятимолекулярная
Б. пятого порядка
* В. отражает лишь суммарный процесс
* Г. сложная
Д. простая
Порядок реакции гидролиза сахароза + глюкоза + фруктоза
А. соответствует кажущейся молекулярности
* Б. ниже кажущейся молекулярности
* В. равен единице
Г. равен двум
Экспериментально установлено, что реакция
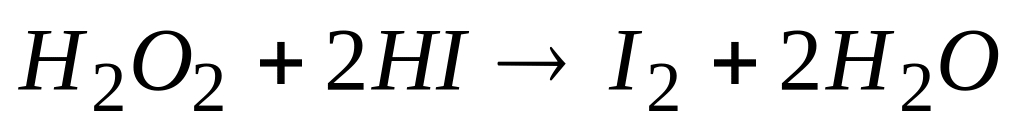 характеризуется первым порядком по
концентрации каждого из исходных
веществ, следовательно, кинетическое
уравнение реакции
характеризуется первым порядком по
концентрации каждого из исходных
веществ, следовательно, кинетическое
уравнение реакции
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Температура влияет на скорость химической реакции, изменяя
А. концентрацию реагирующих веществ
Б. энергию активации
В. энергетический барьер
* Г. константу скорости
Наиболее точно зависимость скорости реакции от температуры отражает уравнение
А. Вант-Гоффа
* Б. Аррениуса
Размерность предэкспоненциального множителя в уравнении Аррениуса совпадает
А. с размерностью температуры
Б. с размерностью энергии активации
В. с размерностью универсальной газовой постоянной
* Г. с размерностью константы скорости
Д. множитель не имеет размерности
Энергии активации прямых реакций и
 равны соответственно 167 кДж/моль и
138 кДж/моль. При одинаковой
температуре
равны соответственно 167 кДж/моль и
138 кДж/моль. При одинаковой
температуре
А. скорость первой реакции больше
* Б. скорость второй реакции больше
В. скорости первой и второй реакций одинаковы
Уменьшение энергии активации
А. уменьшает скорость реакции
* Б. увеличивает скорость реакции
В. не изменяет скорость реакции
Энергия активации простых реакций зависит от
А. концентрации реагирующих веществ
Б. температуры
* В. природы реагирующих веществ
* Г. катализатора
Энергия активации простых реакций
А. зависит от температуры
* Б. не зависит от температуры
В. зависит от концентрации реагирующих веществ
* Г. не зависит от концентрации реагирующих веществ
* Д. зависит от природы реагирующих веществ
Для реакции
 энергия активации практически равна
нулю, следовательно, эта реакция
энергия активации практически равна
нулю, следовательно, эта реакция
* А. протекает практически мгновенно
Б. не протекает вообще
В. протекает очень медленно
Если прямая реакция протекает с выделением теплоты, то
А. энергия активации прямой реакции больше, чем энергия активации обратной реакции
* Б. энергия активации прямой реакции меньше, чем энергия активации обратной реакции
В. энергии активации прямой и обратной реакции одинаковы
Химическая реакция считается практически необратимой, если
А. продукты реакции взаимодейтсвуют друг с другом с образованием исходных веществ
* Б. продукты реакции не взаимодейтсвуют друг с другом с образованием исходных веществ
* В. один из продуктов покидает сферу реакции
* Г. реакция сопровождается выделением большого количества энергии
Д. все участники реакции - газы
Для увеличения скорости химической реакции в 8 раз при
 =2
температуру реакционной смеси нужно
увеличить
=2
температуру реакционной смеси нужно
увеличить
А. в 2 раза
Б. в 3 раза
В. в 4 раза
* Г. на 30 градусов
Д. на 20 градусов
Если для химической реакции
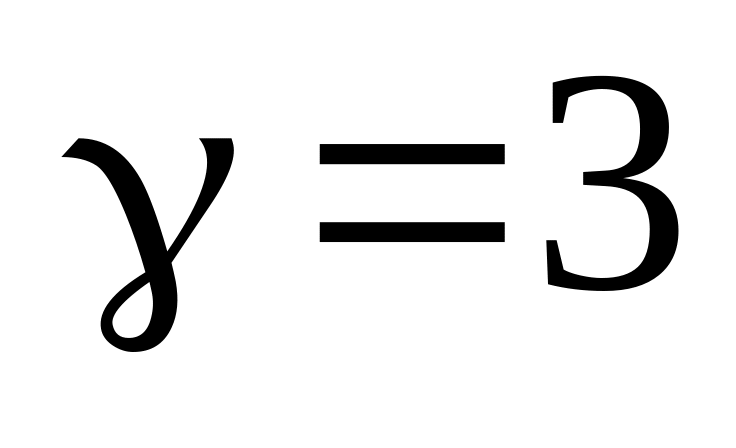 ,
то при понижении температуры с
,
то при понижении температуры с
 С
до
С
до
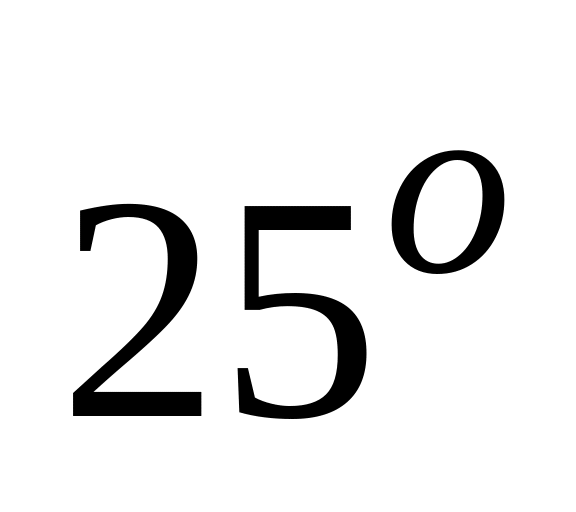 С
скорость этой реакции
С
скорость этой реакции
А. увеличится в 6 раз
Б. увеличится в 9 раз
В. уменьшится в 6 раз
* Г. уменьшится в 9 раз
Если скорость некоторой реакции увеличивается в 2.5 раза при повышении температуры с 20 до 30 градусов, то при повышении температуры на 20 градусов скорость реакции возрастет
А. в 5 раз
* Б. в 6.25 раз
В. в 2.5 раза
Если для химической реакции температурный коэффициент Вант-Гоффа равен трем и при
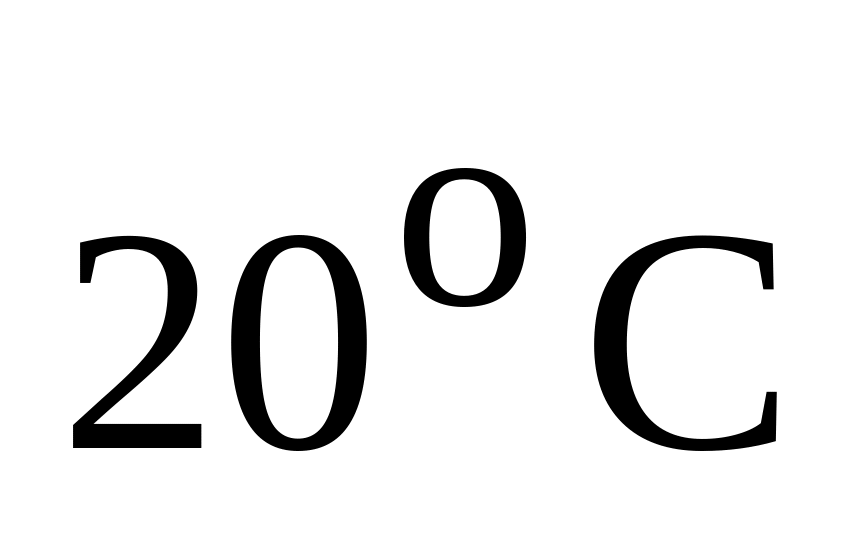 она протекает за 27 минут, то при
она протекает за 27 минут, то при
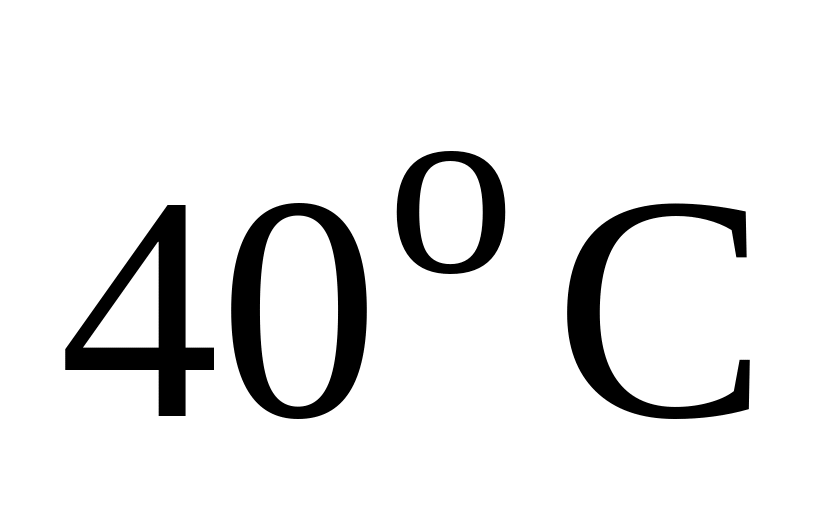 эта реакция будет протекать за
эта реакция будет протекать за
А. 3,5 мин
* Б. 3 мин
В. 210 мин
Г. 246 мин
Растворение образца алюминия в растворе гидроксида калия при
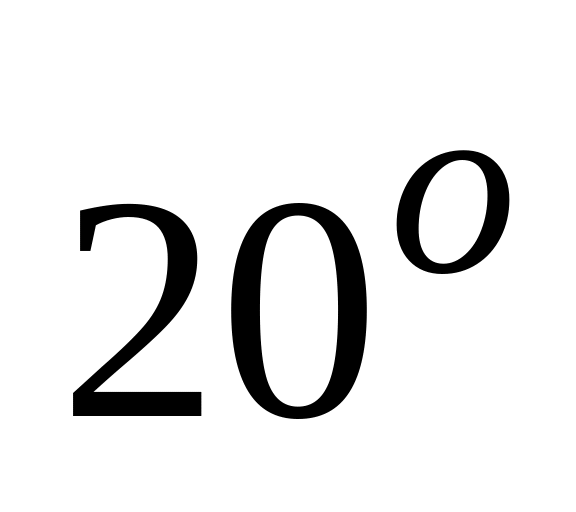 С
заканчивается за 27минут, а при
С
заканчивается за 27минут, а при
 С
такой же образец металла растворяется
за 3минуты. При
С
такой же образец металла растворяется
за 3минуты. При
 С
данный образец растворится за
С
данный образец растворится за
А. 9минут
Б. 1минуту
* В. 20секунд
Г. 15секунд
Д. мгновенно
Катализатор в химической реакции
А. не участвует
* Б. не расходуется
* В. не входит в состав продуктов
* Г. остается после реакции в неизменном виде
При гомогенном катализе
* А. катализатор и реагирующие вещества находятся в одной фазе
Б. катализатор и продукты реакции находятся в одной фазе
В. реагирующие вещества и продукты находятся в одной фазе
Одна из главных причин повышения скорости реакции в присутствии катализатора
* А. уменьшение энергии активации
Б. увеличение энергии активации
* В. направление реакции по более энергетически выгодному пути
Г. направление реакции по менее энергетически выгодному пути
Д. увеличение числа активных частиц
Ингибиторы
А. ускоряют реакцию
* Б. замедляют реакцию
В. не влияют на скорость реакции
* Г. препятствуют протеканию реакции по более энергетически выгодному пути
Промоторы
А. обладают каталитической активностью
* Б. повышают активность катализатора
В. понижают активность катализатора
Каталитические яды
А. повышают активность катализатора
* Б. понижают активность катализатора
* В. обычно разрушают активированные комплексы
* Г. блокируют поверхность активных центров
В гетерогенном катализе участвует
А. вся поверхность твердого катализатора
* Б. отдельные участки поверхности твердого катализатора
* В. активные центры на поверхности твердого катализатора
Скорость ферментативной реакции возрастает прямо пропорционально увеличению концентрации
* А. фермента
Б. субстрата
Скорость ферментативной реакции прямо пропорциональна концентрации субстрата
А. при любых концентрациях субстрата
* Б. при небольших концентрациях субстрата
В. при высоких концентрациях субстрата
Гидролиз сахарозы
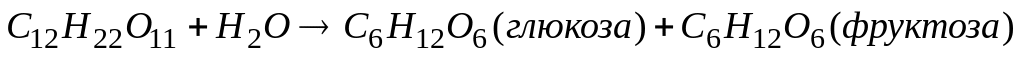 легче всего протекает
легче всего протекает
А. без
катализатора (![]() =
134 кДж/моль)
=
134 кДж/моль)
Б. в присутствии ионов ( = 107 кДж/моль)
* В. в присутствии фермента сахаразы ( = 36 кДж/моль)
Математическое выражение константы равновесия химической реакции включает
А. исходные концентрации реагирующих веществ
* Б. равновесные концентрации реагирующих веществ
* В. показатели степеней у концентраций веществ, соответствующие стехиометрическим коэффициентам в уравнении реакции
Г. показатели степеней у концентраций, не соответствующие стехиометрическим коэффициентам в уравнении реакции
Константа химического равновесия
* А. представляет собой отношение констант скоростей прямой и обратной реакции
Б. всегда больше единицы
* В. включает равновесные концентрации реагирующих веществ
Г. включает начальные концентрации исходных веществ и конечные концентрации продуктов
В состоянии химического равновесия
* А. скорость прямой реакции равна скорости обратной
Б. константа скорости прямой реакции равна константе скорости обратной
* В. устанавливаются равновестные концентрации исходных веществ и продуктов
Г. всегда преобладают продукты реакции
Д. всегда преобладают исходные вещества
В состоянии равновесия для процесса
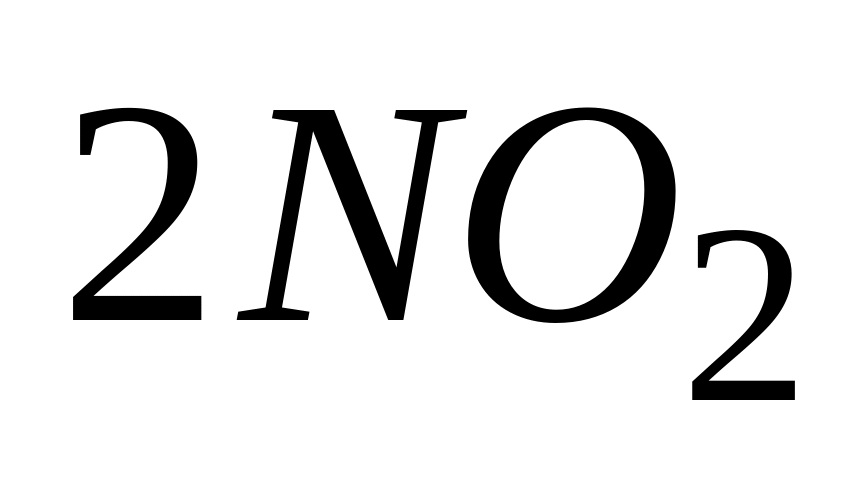
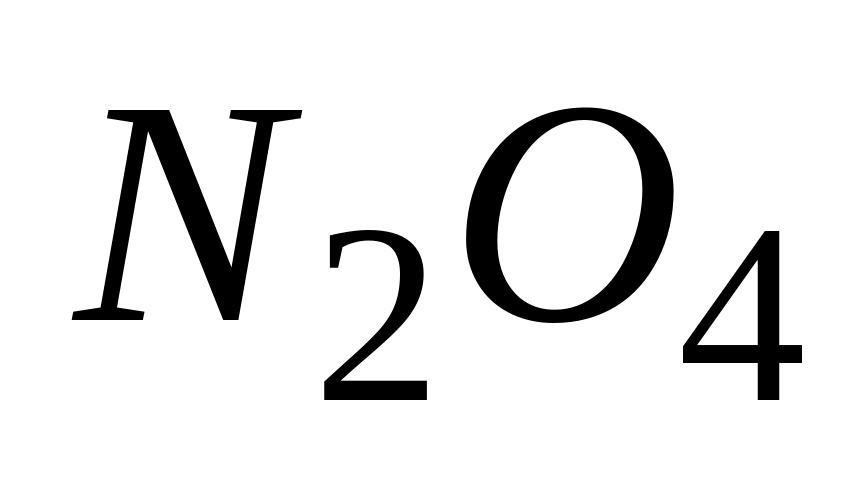
А. скорость прямой реакции вдвое больше скорости обратной
Б. скорость обратной реакции вдвое меньше скорости прямой
* В. скорости прямой и обратной реаций одинаковы
Если в закрытой системе при нормальных условиях смешать равные обьемы хлора и водорода и облучить ультрафиолетом, то давление в этой системе после завершения реакции и приведения к нормальным условиям
* А. не изменится
Б. увеличится
В. уменьшится
Для реакции
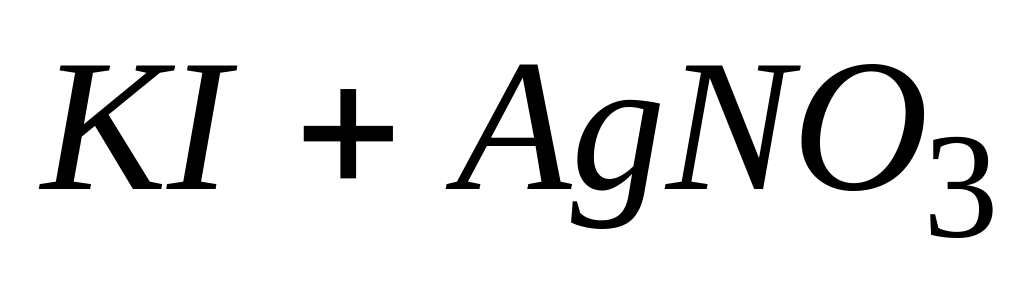
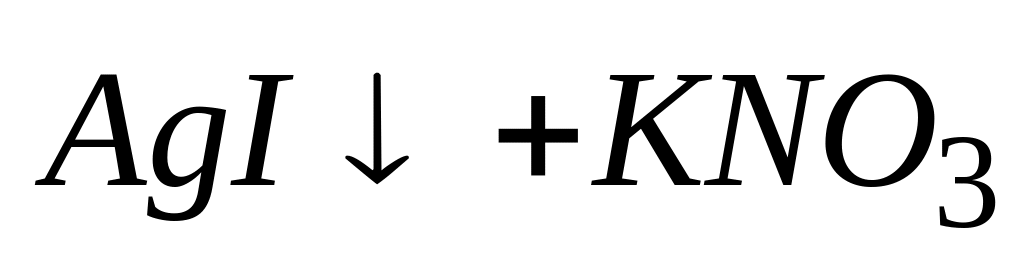
* А. численное значение константы равновесия очень велико
Б. численное значение константы равновесия очень мало
* В. константа скорости прямой реакции больше, чем обратной
Г. константа скорости прямой реакции меньше, чем обратной
Высокое значение константы равновесия для реакции
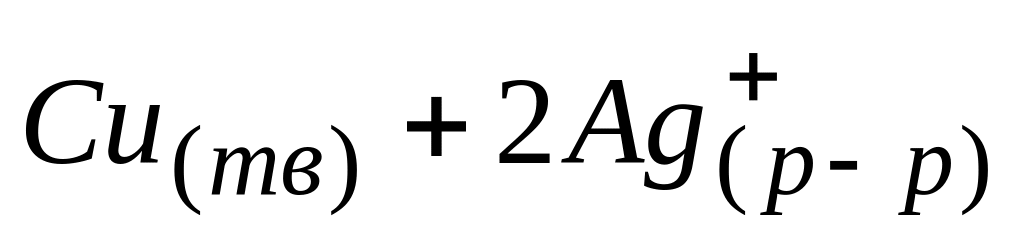
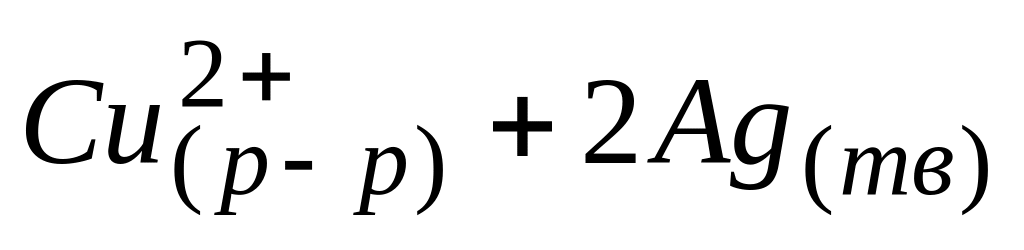 означает, что в момент достижения
равновесия
означает, что в момент достижения
равновесия
* А. концентрация
ионов
![]() больше, чем концентрация ионов
больше, чем концентрация ионов
![]()
Б. концентрация ионов больше, чем концентрация ионов
В. в системе преобладают исходные вещества
* Г. в системе преобладают продукты реакции
В состоянии химического равновесия
А. равны концентрации исходных веществ и продуктов реакции
* Б. равны скорости прямой и обратной реакции
В. равны константы скорости прямой и обратной реакции
Г. прямая и обратная реакции не идут
В обратимой реакции
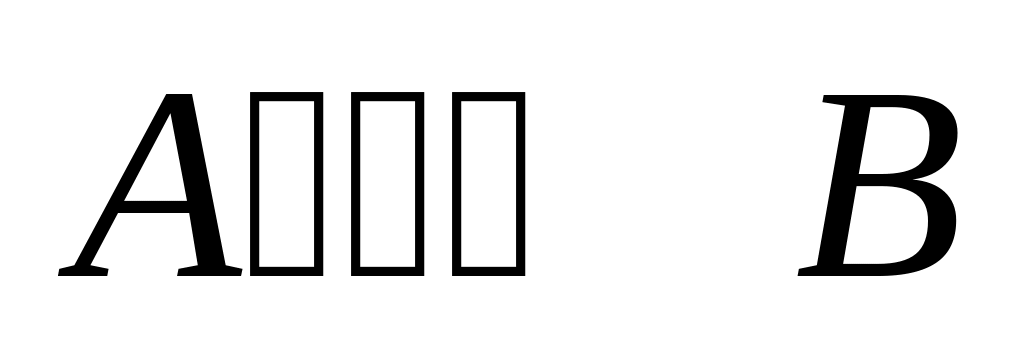 в начальный момент времени
в начальный момент времени
* А. концентрация вещества A максимальна
Б. концентрация вещества B максимальна
В. скорость прямой реакции равна нулю
* Г. скорость прямой реакции максимальна
* Д. скорость обратной реакции равна нулю
Для реакции
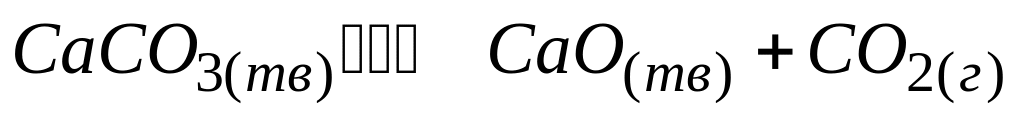 константа равновесия рассчитывается
по уравнению
константа равновесия рассчитывается
по уравнению
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Для реакции
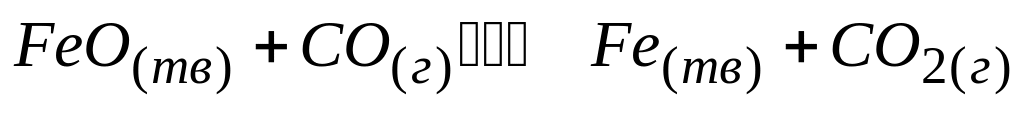 константа равновесия рассчитывается
по уравнению
константа равновесия рассчитывается
по уравнению
А. ![]()
Б. ![]()
В. ![]()
* Г. ![]()
Константа равновесия реакции
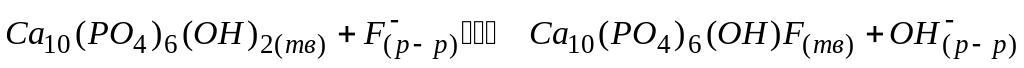 рассчитывается по уравнению
рассчитывается по уравнению
* А. ![]()
Б. ![]()
В. 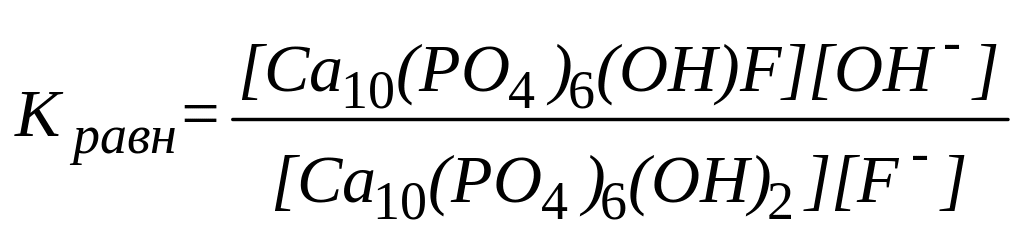
Г. 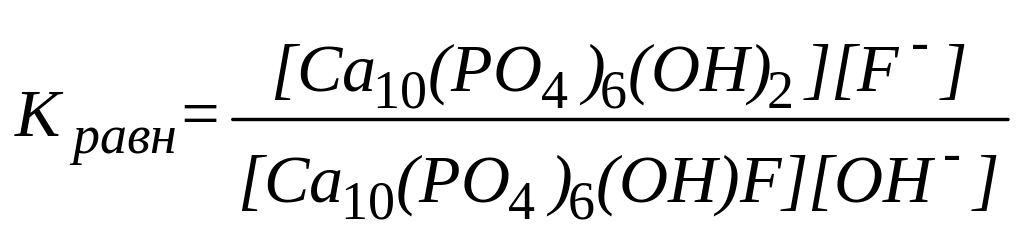
Если объем закрытого сосуда, в котором установилось равновесие
 уменьшить в 2 раза, то
уменьшить в 2 раза, то
А. скорости прямой и обратной реакции останутся одинаковыми
* Б. скорость прямой реакции станет вдвое больше скорости обратной реакции
В. скорость прямой реакции станет вдвое меньше скорости обратной реакции
Г. равновесие не сместится
* Д. равновесие сместится вправо
Если в системе
 равновесные концентрации
равновесные концентрации
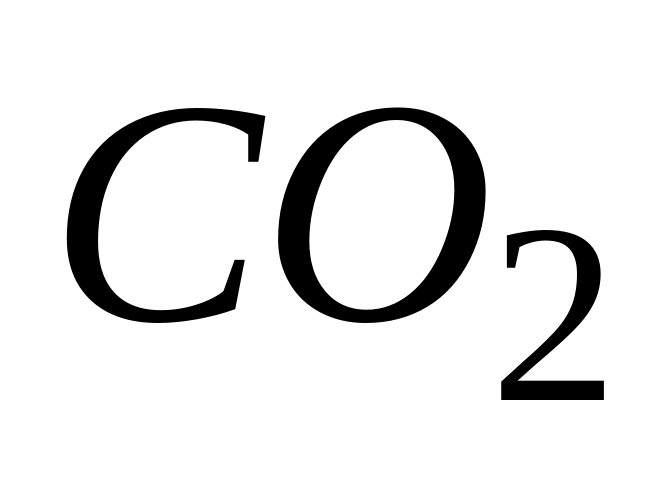 и
равны 0.03 и 0.04 моль/л соответственно, то
начальная концентрация
составляла
и
равны 0.03 и 0.04 моль/л соответственно, то
начальная концентрация
составляла
А. 0.03 моль/л
Б. 0.07 моль/л
* В. 0.05 моль/л
Г. 0.12 моль/л
Для равновесной системы
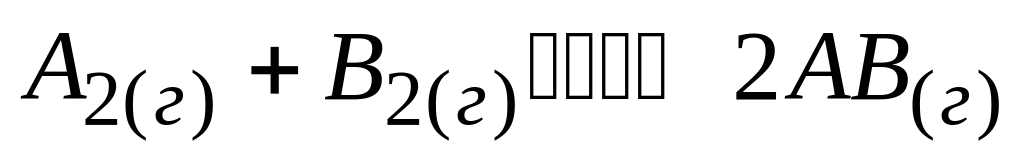 температурные коэффициенты скорости
прямой и обратной реакции равны
соответственно 2 и 3. При повышении
температуры на 20 градусов
температурные коэффициенты скорости
прямой и обратной реакции равны
соответственно 2 и 3. При повышении
температуры на 20 градусов
А. скорость прямой реакции возрастет больше, чем скорость обратной
* Б. скорость обратной реакции возрастет больше, чем скорость прямой
* В. скорость прямой реакции возрастет в 4 раза, а обратной в 9 раз
Г. равновесие в системе сместится в сторону прямой реакции
* Д. равновесие в системе сместится в сторону обратной реакции
Катализатор в обратимой реакции
А. влияет на величину константы равновесия
* Б. не влияет на величину константы равновесия
* В. в равной мере ускоряет прямую и обратную реакции
* Г. ускоряет достижение равновесия
Константа химического равновесия зависит от
* А. природы реагентов
* Б. температуры
В. катализатора
Г. времени
Растворимость галогенов в воде описывается равновесной реакцией
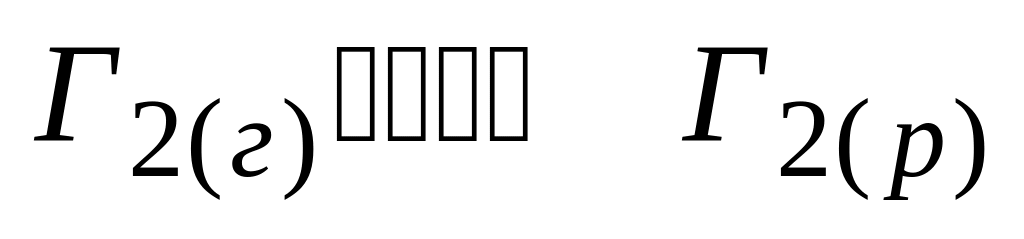 .
Справедливо утверждение
.
Справедливо утверждение
* А. растворимость повышается, если галоген взаимодействует с водой
* Б. растворимость повышается при повышении давления
В. растворимость повышается при понижении давления
Г. растворимость хлора меньше растворимости иода
* Д. растворимость хлора больше растворимости иода
Изменение давления не влияет на константу равновесия реакции
А.
Б. ![]()
* В. ![]()
Г.
При повышении температуры константа равновесия
А. всегда увеличивается
Б. всегда уменьшается
В. сначала увеличивается, затем уменьшается
* Г. увеличивается для эндотермических реакций и уменьшается для экзотермических
При изменении концентрации одного из компонентов при постоянных температуре и давлении в равновесной системе
* А. изменяются концентрации всех других компонентов
Б. не изменяются концентрации всех других компонентов
* В. константа равновесия сохраняет прежнее значение
Г. константа равновесия изменяет свое значение
При
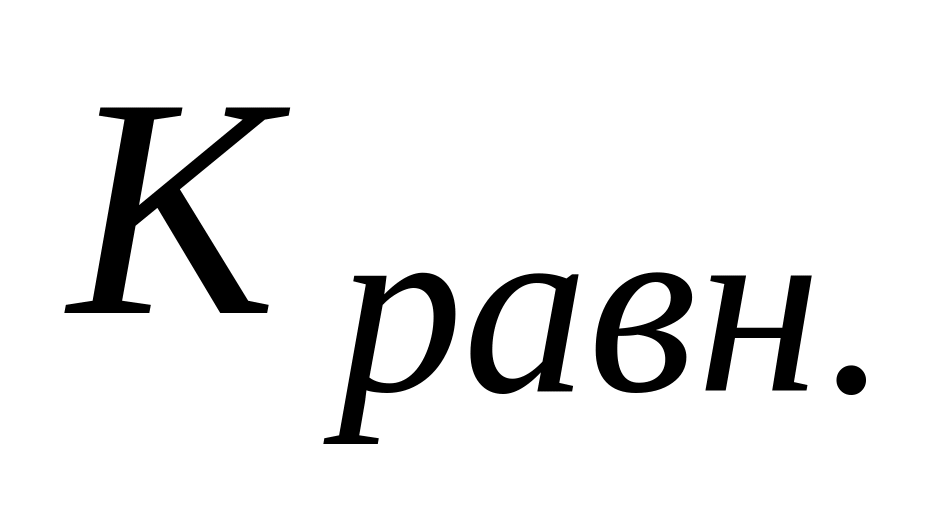 >
1 в системе преобладает
>
1 в системе преобладает
А. обратная реакция
* Б. прямая реакция
Если в системе преобладает обратная реакция, то
А. = 0
Б. > 1
* В. < 1
Г. = 1
Равновесие в реакции
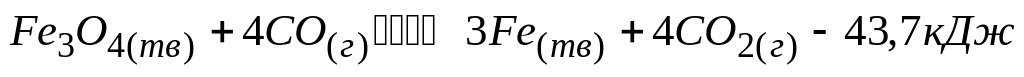 смещается влево при
смещается влево при
* А. понижении температуры
Б. повышении температуры
В. уменьшении давления
Г. увеличении давления
При повышении давления равновесие в реакции
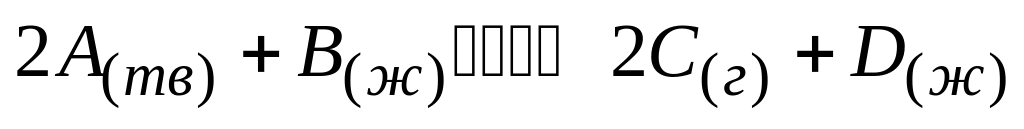
А. сместится вправо
* Б. сместится влево
В. не сместится
Смещения равновесия в реакции
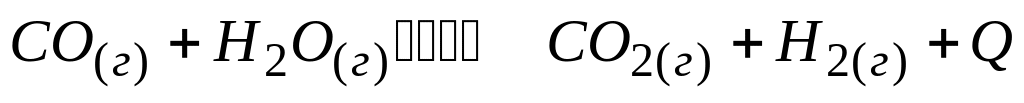 не произойдет при
не произойдет при
* А. повышении давления
Б. повышении температуры
В. добавлении углекислого газа
* Г. использовании катализатора
* Д. уменьшении обьема
В реакции
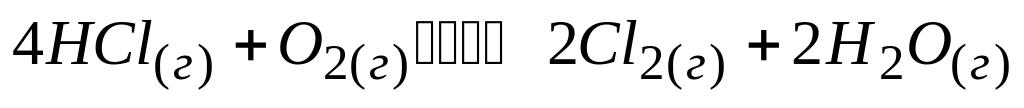 сместить равновесие влево можно
сместить равновесие влево можно
А. увеличением концентрации кислорода
* Б. увеличением концентрации хлора
В. повышением давления
* Г. увеличением обьема реакционного сосуда
В сторону окисления глюкозы равновесие в реакции
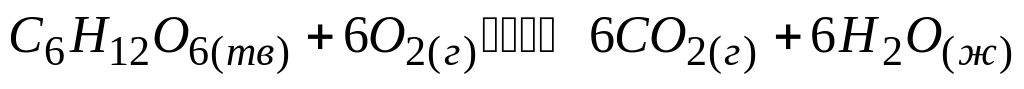 можно сместить
можно сместить
* А. увеличением концентрации кислорода
Б. увеличением концентрации углекислого газа
* В. удалением выделяющегося углекислого газа
* Г. связыванием углекислого газа
Охлаждение реакционной смеси, в которой протекает реакция
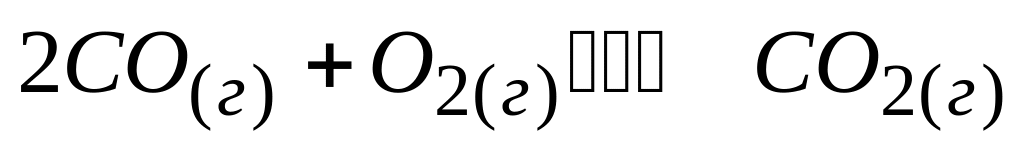 ,
,
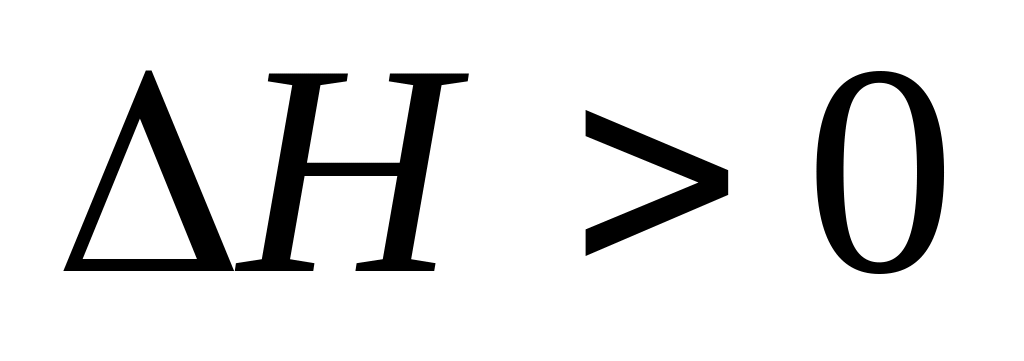
А. приводит к смещению равновесия в сторону продуктов реакции
* Б. приводит к смещению равновесия в сторону исходных веществ
В. не приводит к смещению равновесия
Повышение давления приводит к повышению выхода продуктов в реакции
А. ![]()
* Б. ![]()
В.
Г. ![]()
Если в равновесную смесь азота, водорода и аммиака добавить азот, то равновесие сместится в сторону
А. разложения аммиака
* Б. синтеза аммиака
* В. расходования азота
Если в равновесной системе
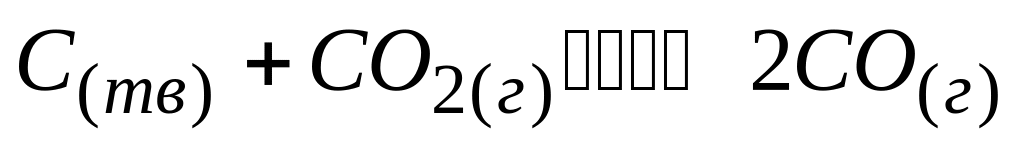 увеличить общее давление, то равновесие
сместится
увеличить общее давление, то равновесие
сместится
* А. влево
Б. вправо
В. в сторону образования монооксида углерода
* Г. в сторону разложения монооксида углерода
Венозная кровь в легких находится при повышенном парциальном давлении кислорода, поэтому в реакции
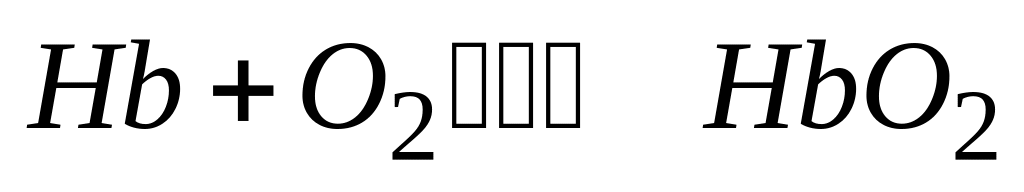 равновесие смещается в сторону:
равновесие смещается в сторону:
А. обратной реакции
* Б. прямой реакции
* В. образования оксигемоглобина
Г. образования гемоглобина
Насыщение венозной крови кислородом в соответствии с прямой реакцией происходит:
* А. в легких при повышенном парциальном давлении кислорода
Б. в тканях при пониженном парциальном давлении кислорода
В. в легких при пониженном парциальном давлении кислорода
Г. в тканях при повышенном парциальном давлении кислорода
Артериальная кровь отдает кислород тканям в соответствии с обратной реакцией . Этому способствует
А. высокое парциальное давление кислорода в тканях
* Б. низкое парциальное давление кислорода в тканях
Возникновению “стронциевого рахита” способствует смещение равновесия в реакции
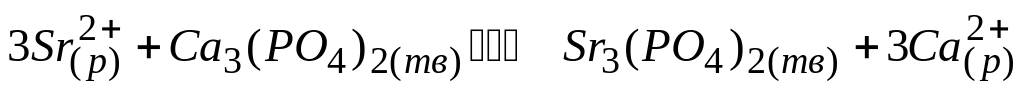 вправо в результате
вправо в результате
* А. связывания
ионов
![]() в более малорастворимый фосфат, чем
фосфат кальция
в более малорастворимый фосфат, чем
фосфат кальция
* Б. недостатка ионов в окружающей биологической жидкости
* В. поступления ионов в организм
Г. избытка ионов в окружающей биологической жидкости
Для смещения равновесия термической диссоциации воды ,
 > 0 вправо, необходимо
> 0 вправо, необходимо
А. понизить температуру
* Б. повысить температуру
В. повысить давление
* Г. понизить давление
Равновесие в обратимой реакции
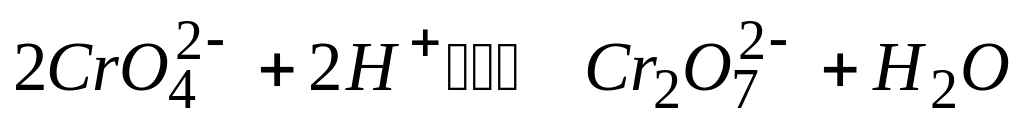 описывается константой
описывается константой
А. ![]()
Б. ![]()
В. 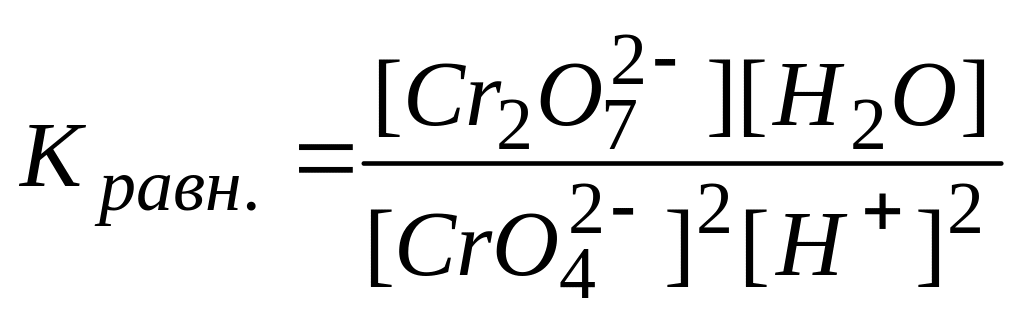
* Г. 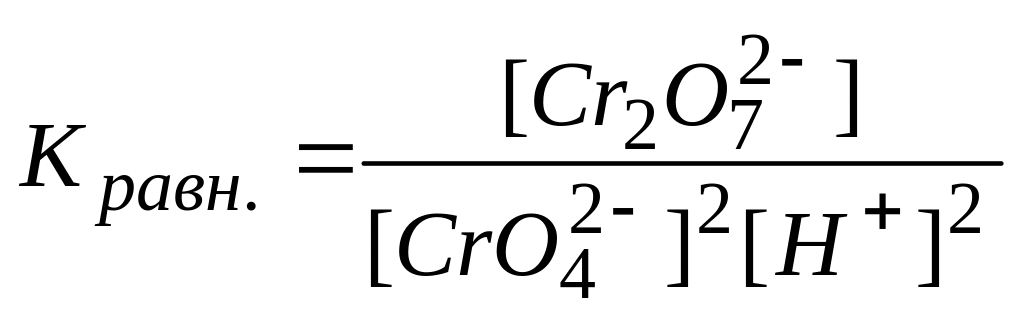
В равновесной реакции равновесие смещается в сторону образования хромат-ионов
* А. при разбавлении
Б. при упаривании
В. при подкислении
* Г. при подщелачивании
В равновесной системе дихромат-ионы преобладают
А. в разбавленных растворах
* Б. в концентрированных растворах
* В. при подкислении
Г. при подщелачивании
Действие антидотов при отравлении угарным газом основано на смещении равновесия в реакции
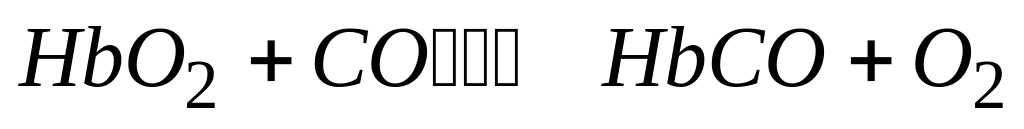
А. вправо
* Б. влево
В. в сторону прямой реакции
* Г. в сторону обратной реакции
Для превращения карбонилгемоглобина в оксигемоглобин, по реакции , необходимо
* А. повышение в дыхательной среде парциального давления кислорода
Б. понижение в дыхательной среде парциального давления кислорода
* В. выведение CO из организма в виде карбонила железа
Г. вдыхание CO
Превращение гидроксиапатита зубной эмали
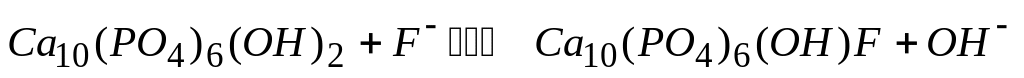 приводит к ее укреплению. Для смещения
равновесия в реакции вправо в состав
зубных паст вводят
приводит к ее укреплению. Для смещения
равновесия в реакции вправо в состав
зубных паст вводят
* А. фторид олова (II)
Б. фторид кальция
* В. фторид натрия
* Г. монофторфосфат натрия
Д. гидратированную окись кремния
Кариес, сопровождающийся растворением зубной эмали по реакции
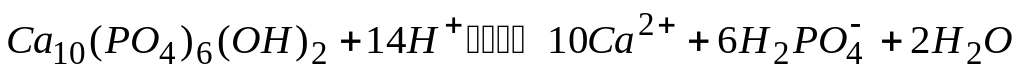 ,
может быть вызван
,
может быть вызван
* А. действием кислот, вырабатываемых бактериями
* Б. действием углеводных компонентов пищи
В. избытком в слюне ионов кальция
Г. избытком в слюне дигидрофосфат-ионов
* Д. недостатком в слюне ионов кальция
Фторид-ионы ускоряют процесс реминерализации (образования кристаллов) в соответствии с реакцией
А. ![]()
Б.![]()
* В. ![]()
Для реакции
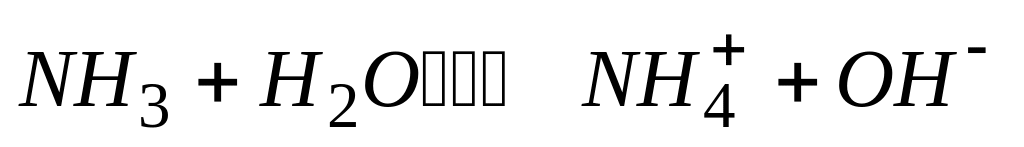 при
298 К значение константы равновесия
составляет
при
298 К значение константы равновесия
составляет
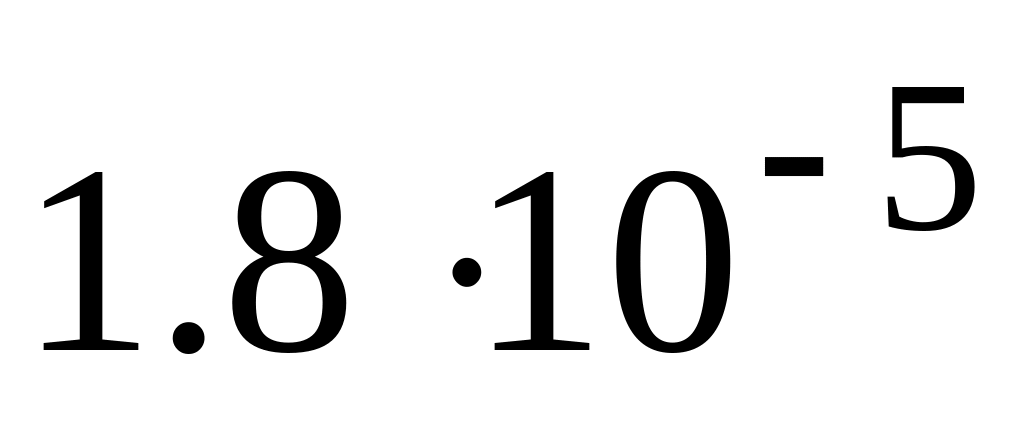 ,
следовательно
,
следовательно
А. в водных растворах аммиак – сильное основание
* Б. в водных растворах аммиака концентрация гидроксид-ионов незначительна
* В. в водных растворах аммиак находится в виде гидратированных молекул
Реакция сопровождается экзоэффектом, следовательно
* А. при охлаждении равновесие смещается вправо
Б. при охлаждении равновесие смещается влево
В. при нагревании равновесие смещается вправо
* Г. при нагревании равновесие смещается влево
При лечении гастрита необходимо сместить равновесие в реакции
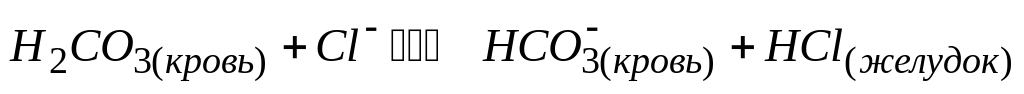 в сторону уменьшения кислотности
желудочного сока. Для этого нужно
в сторону уменьшения кислотности
желудочного сока. Для этого нужно
А. увеличить секрецию желудочного сока
* Б. уменьшить секрецию желудочного сока
* В. уменьшить количество поваренной соли в пище
Г. увеличить количество поваренной соли в пище
Смешали по четыре моль веществ A, B, C и D. После установления равновесия
 в смеси обнаружили 2 моль
вещества A. Константа
равновесия этой реакции
в смеси обнаружили 2 моль
вещества A. Константа
равновесия этой реакции
* А. 9
Б. 25 моль
В. 4
Г. 1 моль-1
Д. 1
Если в равновесной системе
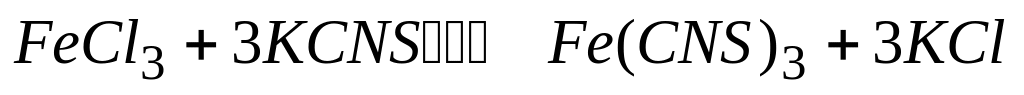 концентрацию хлорида железа (III)
уменьшить с 0,3 до 0,1 моль/л, а хлорида
калия с 0,4 до 0,2 моль/л, то равновесие
концентрацию хлорида железа (III)
уменьшить с 0,3 до 0,1 моль/л, а хлорида
калия с 0,4 до 0,2 моль/л, то равновесие
А. не сместится
* Б. сместится влево
В. сместится вправо
Г. сместится в сторону прямой реакции
* Д. сместится в сторону обратной реакции
Уменьшение объема сосуда и понижение температуры приводит к смещению равновесия в одном направлении для реакций
А.
![]()
* Б. ![]()
В. ![]()
Г. ![]()
* Д. ![]()
Смещением химического равновесия называют переход реакционной системы
А. в неравновесное состояние
* Б. в новое равновесное состояние
В. обязательно в сторону продуктов реакции
Г. обязательно в сторону исходных веществ
Если при повышении температуры равновесие в реакции
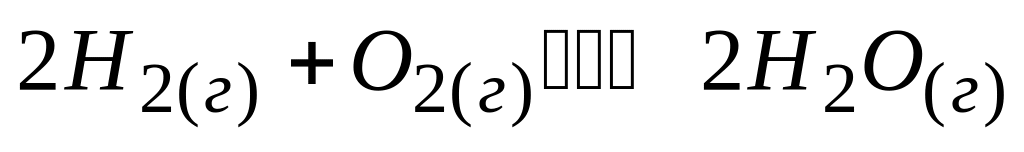 смещается влево, то прямая реакция
смещается влево, то прямая реакция
* А. экзотермическая
Б. эндотермическая
* В. сопровождается выделением тепла
Г. сопровождается поглощением тепла
Если при понижении температуры равновесие в реакции
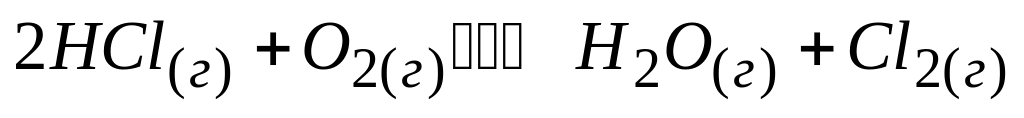 смещается вправо, то прямая реакция
смещается вправо, то прямая реакция
А. эндотермическая
* Б. экзотермическая
* В. сопровождается выделением тепла
Г. сопровождается поглощением тепла
Для смещения равновесия в реакции
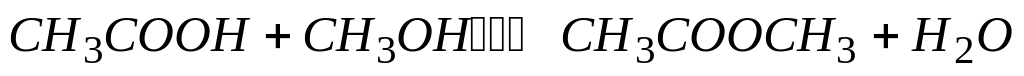 в сторону образования метилацетата
необходимо
в сторону образования метилацетата
необходимо
* А. добавить уксусную кислоту
Б. добавить воду
* В. добавить серную кислоту для связывания воды
Г. увеличить обьем реакционного сосуда
Скорость реакции образования фосгена
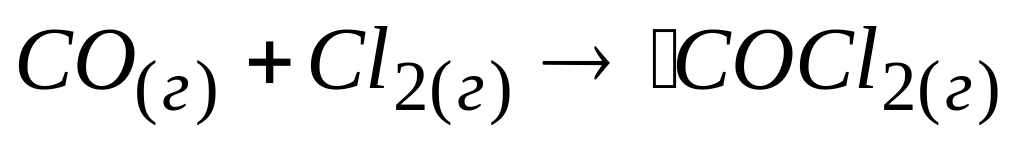 при одновременном понижении давления
в 4 раза и повышении температуры от
С
до
при одновременном понижении давления
в 4 раза и повышении температуры от
С
до
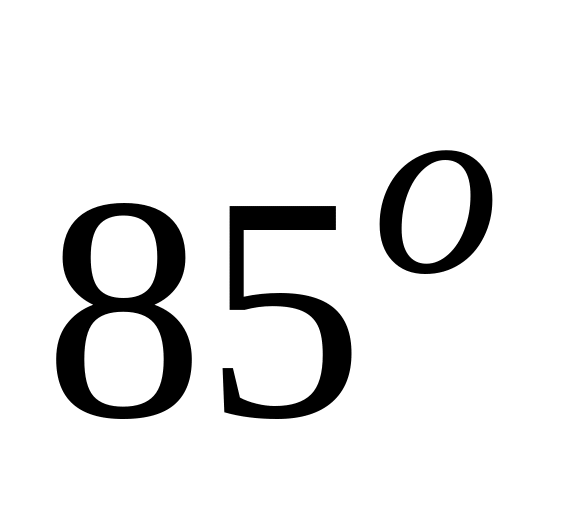 С
(=2)
С
(=2)
А. не изменится
* Б. увеличится в 4 раза
В. уменьшится в 2 раза
Г. увеличится в 2 раза
Д. уменьшится в 4 раза
Фотохимические реакции
* А. протекают под воздействием света
Б. являются простыми
* В. являются сложными
* Г. являются многостадийными процессами
* Д. сопровождаются превращением энергии квантов видимого или ультрафиолетового света в химическую энергию
К фотохимическим реакциям относятся
* А. фотосинтез
Б. радиолиз
* В. зрительный процесс
* Г. образование загара
* Д. образование полимеров под воздействием света
Первичные процессы в фотохимических реакциях
* А. всегда инициируются действием света
Б. не обязательно инициируются действием света
* В. подчиняются закону фотохимической эквивалентности Эйнштейна
* Г. имеют квантовый выход, равный единице
В результате протекания первичных процессов в фотохимической реакции могут получаться
* А. возбужденные молекулы или атомы
* Б. свободные радикалы
* В. катионы и электроны
Г. продукты фотохимической реакции
Д. фотоны
Квантовый выход фотохимической реакции
А. всегда равен единице
Б. может быть только больше единицы
В. может быть только меньше единицы
* Г. может быть равен, больше или меньше единицы
* Д. равен единице для первичных реакций
Вторичные процессы в фотохимических реакциях
* А. не требуют освещения
Б. требуют освещения
Квантовый выход в фотохимической реакции может быть больше единицы, если
* А. под действием 1 кванта света в реакцию вступают 2 или 3 молекулы
Б. под действием 1 кванта света в реакцию вступает 1 молекула
* В. реакция протекает по цепному механизму
Квантовый выход в фотохимической реакции меньше единицы, если
А. один квант света вызывает превращение одной молекулы
* Б. часть активных частиц дезактивируется, отдавая избыточную энергию в виде излучения или тепла
* В. часть фотонов поглощается посторонними веществами
Скорость фотохимических реакций в отличие от скорости обычных реакций
* А. слабо зависит от температуры
Б. сильнее зависит от температуры
В. резко возрастает с повышением температуры
Г. резко уменьшается с повышением температуры
В процессе фотосинтеза роль переносчика световой энергии играет
А. глюкоза
Б. кислород
В. углекислый газ
* Г. хлорофилл
Константа скорости распада пенициллина при
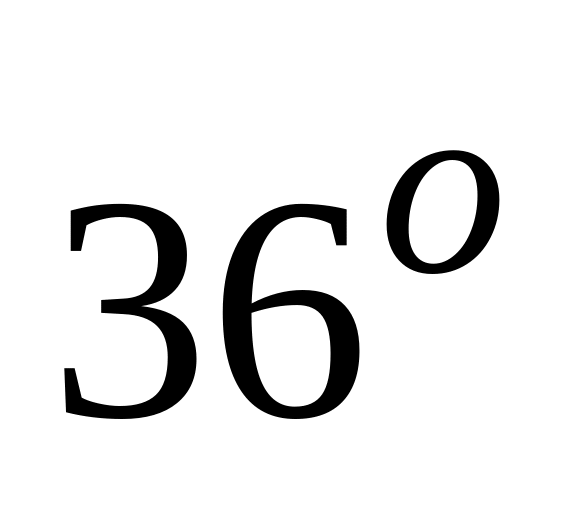 С
равна
С
равна
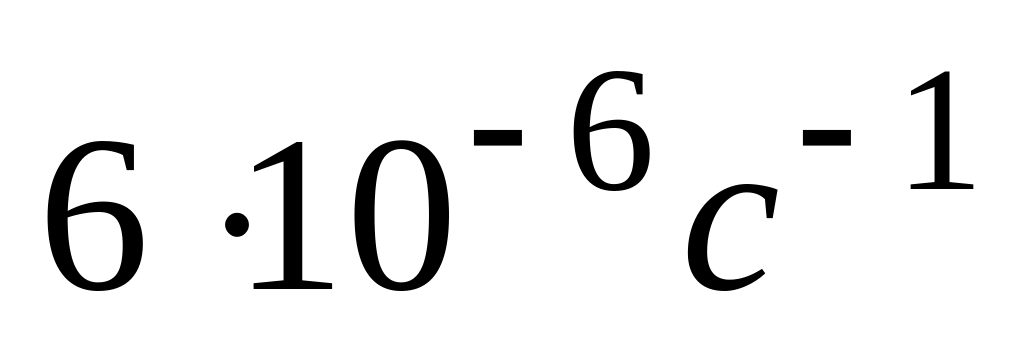 ,
а при
,
а при
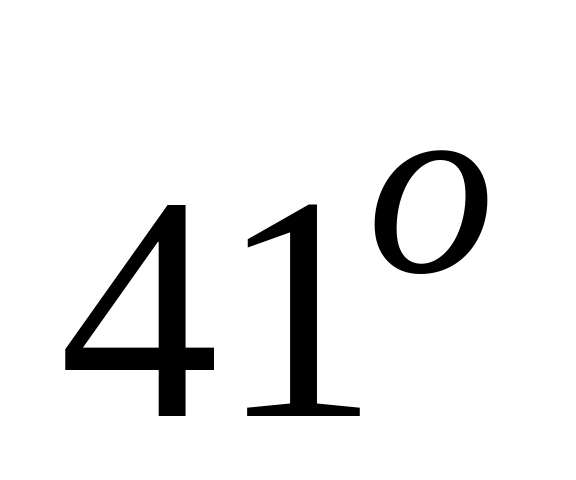 С
-
С
-
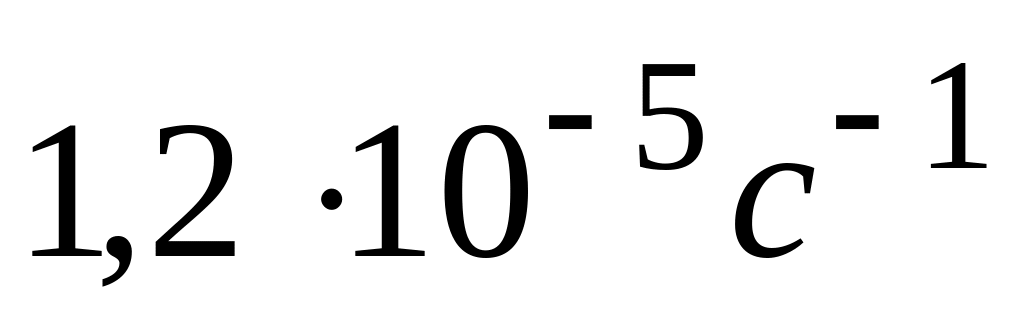 .
Температурный коэффициент реакции
.
Температурный коэффициент реакции
* А. 4
Б. 3
В. 2,5
Г. 2
Д. 1,5
В системе
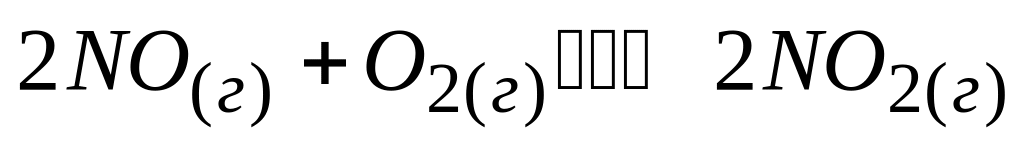 равновесные концентрации веществ
составляют: оксида азота (II)
– 0,2 моль/л, кислорода – 0,3 моль/л,
оксида азота (IV) – 0,4
моль/л.
равновесные концентрации веществ
составляют: оксида азота (II)
– 0,2 моль/л, кислорода – 0,3 моль/л,
оксида азота (IV) – 0,4
моль/л.
* А. равновесие смещено вправо
Б. равновесие смещено влево
* В. в системе преобладает прямая реакция
Г. в системе преобладает обратная реакция
Константа равновесия реакции
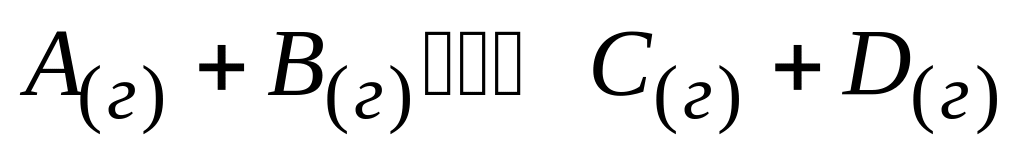 равна единице. Если смешать 3 моль
вещества A и 5 моль вещества
B, то к моменту установления
равновесия в системе подвергнется
превращению
равна единице. Если смешать 3 моль
вещества A и 5 моль вещества
B, то к моменту установления
равновесия в системе подвергнется
превращению
А. 100% вещества А
Б. 85% вещества А
В. 70,5% вещества А
* Г. 62,5% вещества А
Д. 50% вещества А
