
- •Тестовые задания
- •Содержание
- •Глава 1. Строение атома
- •Глава 2. Химическая связь
- •Глава 5. Способы выражения концентрации растворов
- •Минерализующая функция слюны связана с ее пересыщенностью по ионам
- •Глава 11. Окислительно-восстановительные реакции
- •Глава 12. Адсорбция. Поверхностные явления
- •Глава 14. Органическая химия.
- •Для получения из бензола м-нитротолуола
- •Литература
- •Учебное издание
- •Тестовые задания
- •Издается в авторской редакции
Государственное образовательное учреждение
высшего профессионального образования
«Алтайский государственный медицинский университет»
Министерства здравоохранения и социального развития РФ
ХИМИЯ
Тестовые задания
для студентов I курса
стоматологического факультета

Барнаул – 2008
УДК – 54(075.8)
ББК – 24
Х – 46
Печатается по решению Центрального
координационно-методического совета Алтайского
государственного медицинского университета
Составители:
Самохвалова Е.П., Куперман Е.П.
Химия : тестовые задания для студентов I курса стоматологического факультета / Самохвалова Е.П., Куперман Е.П. – Барнаул : Издательство Алтайский государственный медицинский университет, 2008. – 268 с.
Данное пособие содержит набор тестовых заданий, которые охватывают основные разделы курсов общей и биоорганической химии на стоматологическом факультете (I и II семестр). Пособие призвано помочь студентам сформировать естественно-научное мышление, научиться работать с учебной и справочной литературой.
© ГОУ ВПО «Алтайский государственный
медицинский университет», 2008 © Самохвалова Е.П., Куперман Е.П., 2008
Содержание

Глава 1. |
Строение атома |
4 |
Глава 2. |
Химическая связь |
21 |
Глава 3. |
Биогенные элементы |
36 |
Глава 4. |
Химическая кинетика и химическое равновесие |
56 |
Глава 5. |
Способы выражения концентрации растворов |
82 |
Глава 6. |
Растворы неэлектролитов |
94 |
Глава 7. |
Растворы электролитов |
117 |
Глава 8. |
Буферные системы |
134 |
Глава 9. |
Гетерогенные равновесия |
154 |
Глава 10. |
Комплексные соединения |
165 |
Глава 11. |
Окислительно-восстановительные реакции |
181 |
Глава 12. |
Адсорбция. Поверхностные явления |
202 |
Глава 13. |
Коллоидные системы |
221 |
Глава 14. |
Органическая химия |
238 |
|
|
|
Литература |
266 |
|
Глава 1. Строение атома
С возрастанием порядкового номера химического элемента в периодической системе периодически изменяются
А. заряд ядра атома
* Б. строение внешних электронных оболочек
В. общее число электронов в электронной оболочке
Г. атомная масса
* Д. свойства химических элементов и их однотипных соединений
При увеличении заряда ядра атома в периодической системе
* А. периодически повторяется строение внешних электронных оболочек
* Б. периодически изменяются свойства химических элементов и их соединений
В. периодически изменяется общее число электронов в электронной оболочке
* Г. возрастает общее число электронов в электронной оболочке
Д. периодически изменяется число протонов в ядре
Свойства химических элементов
* А. находятся в периодической зависимости от зарядов атомных ядер
Б. зависят только от числа валентных электронов, но не зависят от общего числа электронов в атоме
* В. зависят от общего числа электронов в атоме
* Г. с однотипными электронными конфигурациями близки
Д. с однотипными электронными конфигурациями одинаковы
Порядковый номер элемента в периодической системе соответствует
* А. заряду ядра атома
* Б. числу протонов в ядре
В. сумме числа протонов и нейтронов в ядре
* Г. числу электронов в электронной оболочке атома
Д. числу валентных электронов
При возрастании заряда ядра атома в периодической системе периодически изменяются
* А. свойства химических элементов
Б. относительные атомные массы
* В. число электронов на внешнем энергетическом уровне
Г. число энергетических уровней
Д. число протонов в ядре
Период – это последовательный ряд элементов, атомы которых имеют
А. одинаковое число электронов на внешнем энергетическом уровне
* Б. одинаковое число энергетических уровней, заполняемых электронами
* В. число энергетических уровней, заполняемых электронами, соответствующее номеру периода
Г. одинаковое число протонов в ядре
Д. одинаковые электронные конфигурации внешнего энергетического уровня
Номер периода, в котором находится химический элемент в периодической системе, указывает
А. общее число электронов в атоме
Б. число валентных электронов в атоме
* В. число энергетических уровней, заполняемых электронами
Г. число энергетических подуровней, заполняемых электронами
* Д. номер внешнего энергетического уровня в атоме
Частица, содержащая 20 протонов и 18 электронов, имеет заряд
А. +16
Б. –18
В. 0
* Г. +2
Д. –2
В результате удаления из атома магния всех валентных электронов образуется частица, изоэлектронная
А. ![]()
* Б. ![]()
* В. ![]()
* Г. ![]()
Д. ![]()
Изоэлектронными являются частицы
* А. ![]() и
и
![]()
Б. ![]() и
и
![]()
* В. ![]() и
и
Г. ![]() и
и
![]()
* Д. ![]() и
и
![]()
17 протонов и 18 нейтронов содержит ядро изотопа
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Число электронов в атоме
А. больше, чем число протонов в его ядре
Б. меньше, чем число протонов в его ядре
* В. равно числу протонов в его ядре
Г. равно сумме числа протонов и нейтронов в его ядре
Изотопы химического элемента отличаются друг от друга
А. числом протонов
Б. числом электронов
* В. числом нейтронов
Г. положением в периодической системе
Изотопы одного элемента имеют
* А. одинаковый положительный заряд ядра
Б. одинаковые массовые числа
* В. одинаковое число протонов в ядре
Г. одинаковое число нейтронов в ядре
* Д. одинаковое число электронов в электронной оболочке
Изотопами являются
* А. ![]() и
и
![]()
Б. ![]() и
и
![]()
В. ![]() и
и
![]()
* Г. ![]() и
и
![]()
Д. алмаз и графит
Изотопы хлора содержат
* А. одинаковое число электронов
Б. разное число электронов
* В. одинаковое число протонов в ядре
Г. разное число протонов в ядре
* Д. разное число нейтронов в ядре
В атоме серы
* А. ядро всегда содержит 16 протонов
Б. ядро всегда содержит 16 нейтронов
В. суммарное число протонов и нейтронов всегда равно 32
* Г. всегда 16 электронов
В основе квантово-механической теории строения атома лежат
* А. представления о корпускулярно-волновом дуализме микрочастиц
* Б. принцип неопределенности Гейзенберга
* В. положение об атомной орбитали как области наиболее вероятного нахождения электрона в атоме
Г. положение о стационарной орбите
* Д. уравнение Шредингера
В ходе химических реакций изменениям подвергаются
А. ядра атомов
* Б. электронные оболочки атомов
В. как ядра, так и электронные оболочки атомов
Состояние электрона в поле ядра атома полностью характеризуется
* А. его энергией
* Б. квантовыми числами: n, l, ml, ms
В. квантовыми числами: n, l, ml
Волновые свойства электрона характеризуются квантовыми числами
* А. n
* Б. l
* В. ml
Г. ms
Корпускулярные свойства электрона характеризует
А. главное квантовое число
Б. орбитальное квантовое число
В. магнитное квантовое число
* Г. спиновое квантовое число
Главное квантовое число n характеризует
* А. энергию электрона на энергетическом уровне
Б. энергию электрона на энергетическом подуровне
* В. размер электронного облака
Г. форму электронной орбитали
Главное квантовое число n характеризует
* А. энергетический уровень
Б. энергетический подуровень
* В. число энергетических подуровней на данном уровне
Г. форму атомной орбитали
Д. ориентацию атомной орбитали в пространстве
Если электрон находится на энергетическом уровне с n = 1, то
А. запас его энергии максимален
* Б. запас его энергии минимален
При n
* А. энергия притяжения электрона к ядру равна нулю
Б. энергия притяжения электрона к ядру максимальна
* В. электрон отрывается от ядра
* Г. происходит ионизация атома
Номер периода, в котором находится элемент, указывает
А. число протонов в ядре атома
Б. общее число электронов в атоме
* В. число энергетических уровней в атоме,заполняемых электронами
Г. семейство, к которому он относится
* Д. номер внешнего энергетического уровня в атоме
Орбитальное (побочное) квантовое число l характеризует
А. энергию электрона на энергетическом уровне
* Б. энергию электрона на энергетическом подуровне
В. размер электронного облака
* Г. форму электронной орбитали
Если n = 3, то энергетический уровень содержит
* А. три подуровня s-, p-, d-
Б. три подуровня s-, p-, f-
В. девять подуровней
Г. пять подуровней
Число подуровней на четвертом энергетическом уровне
А. 1
Б. 2
В. 3
* Г. 4
Д. 5
Значение орбитального квантового числа l для электрона на
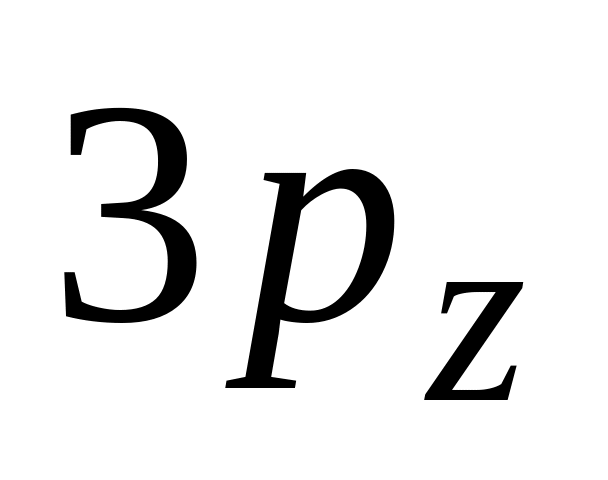 -орбитали
-орбитали
А. 0
* Б. 1
В. 2
Г. 3
Д. 4
Значениям квантовых чисел n = 4 и l = 2 соответствует подуровень
А. 4s-
Б. 4p-
* В. 4d-
Г. 4f-
Магнитное квантовое число характеризует
А. энергию электрона на энергетическом уровне
Б. энергию электрона на энергетическом подуровне
В. размер электронного облака
Г. форму электронной орбитали
* Д. ориентацию электронной орбитали в пространстве
Атомные орбитали
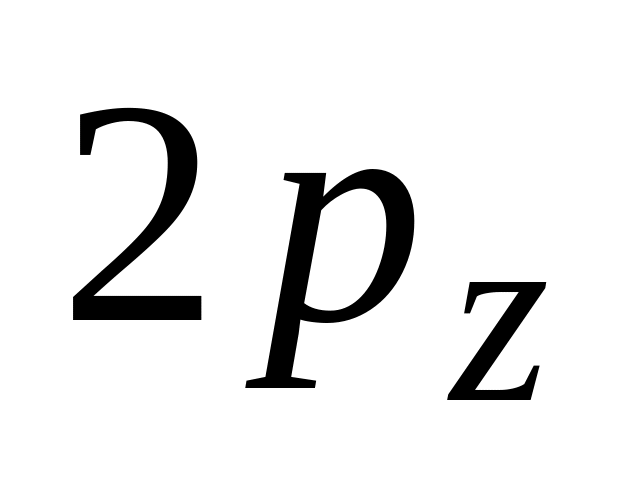 и
и
 отличаются
отличаются
А. формой
* Б. энергией
В. ориентацией в пространстве
* Г. размерами
Атомные орбитали
 и
и
 отличаются
отличаются
А. формой
Б. энергией
* В. ориентацией в пространстве
Г. размерами
Атомные орбитали
 и
и
 находятся
находятся
* А. на одном энергетическом уровне
Б. на разных энергетических уровнях
* В. на разных энергетических подуровнях
Г. на одном энергетическом подуровне
Собственный магнитный момент электрона характеризует
А. главное квантовое число
Б. орбитальное (побочное) квантовое число
В. магнитное квантовое число
* Г. спиновое квантовое число
Значение спинового квантового числа
 от значения главного квантового числа
n
от значения главного квантового числа
n
А. зависит
* Б. не зависит
Число орбиталей на 5s-подуровне равно
* А. 1
Б. 3
В. 5
Г. 7
Число орбиталей на 4f-подуровне равно
А. 1
Б. 3
В. 5
* Г. 7
Состояние электрона на атомной орбитали характеризуется значениями квантовых чисел
А. n=3; l=1; ml - одно из значений –1, 0, +1; ms = ½
Б. n=3; l =2; ml = –1; ms = ½
* В. n=3; l=2; ml - одно из значений –2,–1, 0, +1, +2; ms = ½
Г. n=3; l=3; ml - одно из значений –3, -2,–1, 0, +1, +2, +3; ms = ½
Атомная орбиталь
 характеризуется значениями квантовых
чисел
характеризуется значениями квантовых
чисел
А. n=4; l=0; ml - одно из значений –1, 0, +1
* Б. n=4; l=0; ml = 0
В. n=4; l=1; ml =0
Г. n=4; l=0; ml = +1
Максимальное число электронов на энергетическом уровне, главное квантовое число которого равно трем
А. 2
Б. 8
В. 16
* Г. 18
Д. 32
Порядок заполнения электронами атомных орбиталей определяется
* А. принципом Паули
* Б. принципом наименьшей энергии
В. принципом Гейзенберга
* Г. правилом Гунда
Д. только правилом Клечковского
Принцип наименьшей энергии справедлив для атома
А. в основном и возбужденном состоянии
* Б. в основном состоянии
В. в возбужденном состоянии
Атом в невозбужденном состоянии
* А. имеет минимальную энергию
Б. имеет максимальную энергию
* В. содержит на внешнем энергетическом уровне не более 8 электронов
Г. содержит на внешнем энергетическом уровне от 1 до 18 электронов
Формулировка “в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел” отражает
А. правило Гунда
Б. принцип наименьшей энергии
* В. принцип Паули
Г. правило Клечковского
В соответствии с правилом Клечковского атомные орбитали заполняются в последовательности
А. 3d - 4s - 4p - 5s
* Б. 4s - 3d - 4p - 5s
В. 3d - 4s - 5s - 4p
Г. 4s - 3d - 5s - 4p
Электронная формула
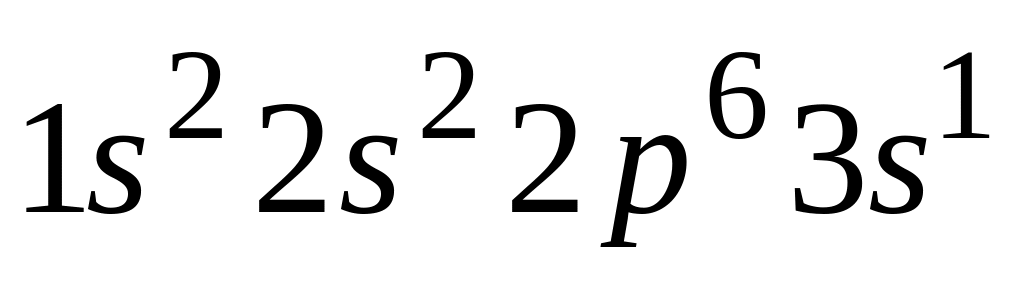 отражает строение невозбужденного
атома
отражает строение невозбужденного
атома
А. магния
Б. цинка
* В. натрия
Г. скандия
Д. калия
Правилу Гунда противоречат электронные конфигурации
* А. [Ne]![]()
Б. [Ne]![]()
* В. [Ne]![]()
* Г. [Ne]![]()
Основному состоянию атома фосфора соответствует электронная формула
* А. [Ne]
Б. [Ne]![]()
В. [Ne]![]()
Г. [Ne]
Возбужденному состоянию атома фосфора соответствует электронная формула
А. [Ne]
* Б. [Ne]
В. [Ne]
Г. [Ne]
Электронные формулы атома хлора и иона хлора соответственно
А. ![]() и
и
![]()
* Б. и
В.
и
![]()
Г. ![]() и
и
![]()
Д. и
Электронные формулы не могут содержать фрагменты
* А. …![]()
* Б. …![]()
В. …![]()
* Г. …![]()
Д. …![]()
К d-блоку относятся элементы с электронными формулами
А. [Ar]![]()
* Б. [Ar]![]()
* В. [Ar]![]()
Г. [Ar]![]()
Элемент с электронной формулой [Xe]
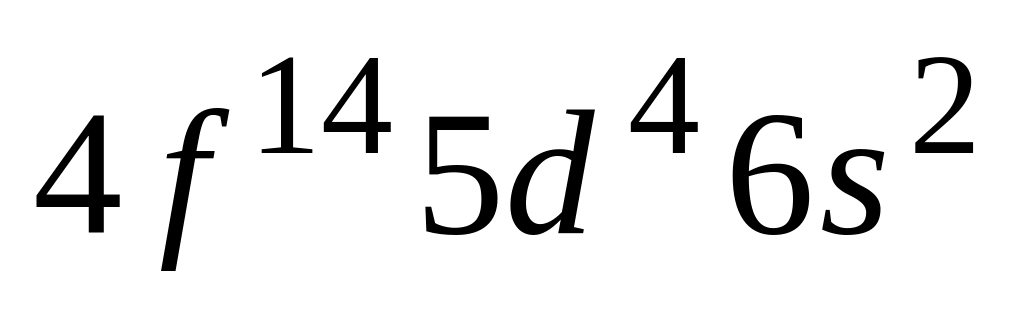 относится к
относится к
А. s - блоку
Б. p - блоку
* В. d - блоку
Г. f - блоку
У элементов p-семейства валентными являются электроны на подуровнях
* А. ns
* Б. np
В. nd
Г. (n-1)d
У элементов d-семейства валентными являются электроны на подуровнях
А. только ns
Б. только np
В. только (n-1)d
Г. ns, np, (n-1)d
* Д. ns и (n-1)d
Число электронов на внешнем уровне равно номеру группы для элементов
А. s-, p-, d- и f- семейств
Б. s-, p-, d- семейств
* В. s-, p- семейств
Г. только s- семейства
Д. только p- семейства
Атомы марганца и хлора имеют одинаковое число
А. электронов на внешнем энергетическом уровне
* Б. валентных электронов
В. энергетических уровней, заполняемых электронами
В атоме скандия валентными являются электроны
* А. 4s - подуровня
Б. 4p - подуровня
В. 4d - подуровня
* Г. 3d - подуровня
Атомная орбиталь на которой находится валентный электрон в атоме калия, характеризуется значениями квантовых чисел n, l,

А. 3, 0, 0 соответственно
* Б. 4, 0, 0 соответственно
В. 4, 1, 0 соответственно
Г. 4, 0, 1 соответственно
Элементы, максимальная валентность которых не соответствует номеру группы
* А. кислород
Б. углерод
В. сера
* Г. азот
Д. фосфор
В возбужденном состоянии атом серы может приобретать электронные конфигурации
* А. [Ne]![]()
Б. [Ne]![]()
* В. [Ne]![]()
Г. [Ne]![]()
Железо, кобальт и никель объединяют в одно семейство, так как они имеют
А. одинаковое число валентных электронов
* Б. одинаковую электронную конфигурацию внешнего уровня
В. одинаковую электронную конфигурацию 3d-подуровня
* Г. близкие значения атомных радиусов
* Д. близкие значения энергии ионизации
Пять электронов на 3d-подуровне содержат в основном состоянии атомы
* А. марганца
* Б. хрома
В. железа
Г. кобальта
Д. молибдена
Полностью заполненный 4d-подуровень содержат в основном состоянии атомы
* А. кадмия
Б. марганца
* В. цезия
Г. меди
* Д. серебра
Электронная конфигурация иона

А. [Ar]![]()
Б. [Ar]![]()
В. [Ar]![]()
Г. [Ar]![]()
* Д. [Ar]![]()
В основном состоянии атом ванадия содержит неспаренных электронов
А. 5
* Б. 3
В. 1
Г. 0
Ионы
 и
и

* А. изоэлектронны
Б. имеют одинаковое число протонов
* В. имеют разные размеры
* Г. имеют
электронную конфигурацию
![]()
Д. имеют
электронную конфигурацию
![]()
В паре йод – фтор
* А. фтор имеет большую энергию сродства к электрону
Б. йод имеет большую энергию сродства к электрону
* В. фтор имеет большее значение первого потенциала ионизации
* Г. йод имеет меньшее значение первого потенциала ионизации
* Д. фтор имеет более высокую электроотрицательность
Чем больше энергия сродства к электрону, тем у данного атома
* А. выше окислительная способность
Б. выше восстановительная способность
В. лучше выражены металлические свойства
* Г. лучше выражены неметаллические свойства
В каждом периоде наибольший радиус имеет атом
* А. элемента, стоящего в начале периода
Б. элемента, стоящего в конце периода
* В. щелочного металла
Г. галогена
Д. инертного газа
В пределах одного периода
* А. наибольшую энергию ионизации имеют инертные газы
Б. наибольшую энергию ионизации имеют щелочные металлы
* В. с увеличением заряда ядра увеличивается энергия ионизации
Г. с увеличением заряда ядра уменьшается энергия ионизации
В главных подгруппах сверху вниз
* А. уменьшается энергия сродства к электрону
* Б. уменьшается энергия ионизации
* В. уменьшается электроотрицательность
Г. увеличивается энергия сродства к электрону
Д. увеличивается энергия ионизации
В ряду Si
 P
S
Cl
P
S
Cl
* А. возрастает электроотрицательность
Б. уменьшается электроотрицательность
В. ослабевают неметаллические свойства
* Г. усиливаются неметаллические свойства
Чем выше электроотрицательность, тем в большей степени выражены у элемента
А. металлические свойства
* Б. неметаллические свойства
* В. окислительные свойства
Г. восстановительные свойства
Наиболее ярко металлические свойства выражены у элементов
* А. IA-подгруппы
Б. IБ-подгруппы
В. VIIA-подгруппы
Г. VIIБ-подгруппы
Элементы, относительная электроотрицательность которых близка к двум, относят к
А. типичным металлам
Б. типичным неметаллам
* В. амфотерным элементам
Электронную конфигурацию [Ar]
 имеют частицы
имеют частицы
* А. ![]()
Б. ![]()
* В. ![]()
Г. ![]()
Д. ![]()
Спаренные электроны имеют
А. разные значения всех четырех квантовых чисел
Б. одинаковые значения всех четырех квантовых чисел
В. одинаковые значения орбитального, магнитного и спинового квантовых чисел
* Г. одинаковые значения главного, орбитального и магнитного, но разные значения спинового квантового числа
Электроны, имеющие одинаковые значения главного, орбитального и магнитного квантовых чисел, но различные значения спиновых квантовых чисел
А. называют неспаренными
* Б. называют спаренными
* В. находятся на одной атомной орбитали
Г. находятся на разных атомных орбиталях
Сумме (n + l), равной 5, соответствуют электронные подуровни
* А. 5s
Б. 5p
В. 4d
* Г. 4p
* Д. 3d
В возбужденном атоме электроны
А. подчиняются принципу наименьшей энергии
* Б. не подчиняются принципу наименьшей энергии
В. переходят на более низкий энергетический уровень
* Г. переходят на более высокий энергетический уровень
Сходство свойств элементов одной подгруппы обусловлено
* А. аналогией в строении валентных оболочек атомов
Б. одинаковым строением электронных оболочек атомов
В. одинаковым числом энергетических уровней, заполняемых электронами
Различие свойств элементов одной подгруппы и их соединений обусловлено
А. различным строением валентных электронных оболочек
* Б. различным числом электронов в электронных оболочках
* В. различными зарядами ядер атомов
* Г. различными атомными радиусами
Наполовину заполненный 4f-подуровень содержат частицы
* А. ![]()
* Б. ![]()
В. ![]()
* Г. ![]()
Д. ![]()
В атомах элементов одного периода
* А. происходит заполнение одинакового числа электронных слоев
* Б. значение главного квантового числа внешнего электронного уровня одинаково
В. общее число валентных электронов одинаково
Г. общее число электронов одинаково
Энергия сродства к электрону уменьшается в ряду:
* А. Cl Br I
Б. I Br Cl
В. Cl I Br
Электроны иона
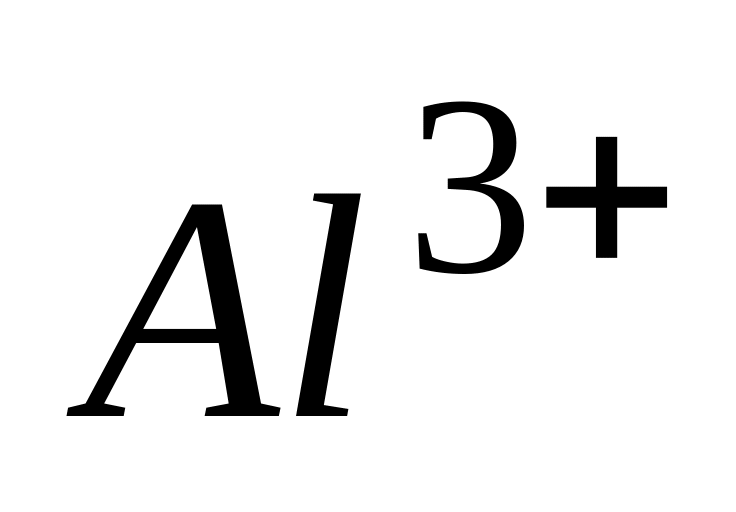 могут находится на орбиталях
могут находится на орбиталях
* А. 2p
Б. 1p
В. 3d, если ион в основном состоянии
* Г. 3d, если ион в возбужденном состоянии
На энергетическом уровне с порядковым номером n число атомных орбиталей
А. 2n+1
* Б. n2
В. 2n2
Г. n–1
Д. n+1
Если элемент имеет электронную конфигурацию (n‑1)d10ns2np4, то он находится в
А. IV группе, побочной подгруппе
Б. VI группе, побочной подгруппе
В. IV группе, главной подгруппе
* Г. VI группе, главной подгруппе
Одинаковое число электронов на внешнем энергетическом уровне в невозбужденном состоянии имеют атомы элементов
А. B, C, N, O
* Б. B, Al, Ga, In
* В. Mn, Fe, Co, Ni
Г. O, S, N, P
Д. H, He, Li, Na
Некоторый элемент X образует хлорид состава
 .
Формула высшего оксида этого элемента
.
Формула высшего оксида этого элемента
* А. ![]()
Б. ![]()
В. ![]()
Г. ![]()
Д. ![]()
Степень окисления элементов главных подгрупп в высших оксидах
А. возрастает сверху вниз
Б. уменьшается сверху вниз
* В. как правило, равна номеру группы
* Г. не соответствует номеру группы для элементов VI и VII групп второго периода
Д. всегда соответствует номеру группы
Природный бром содержит два изотопа. Массовая доля изотопа
 равна 55%. Относительная атомная масса
брома равна 79,9. Второй изотоп в составе
природной смеси
равна 55%. Относительная атомная масса
брома равна 79,9. Второй изотоп в составе
природной смеси
А. ![]()
* Б. ![]()
В. ![]()
Г. ![]()
Природный хлор имеет два изотопа
 и
и
 .
Относительная атомная масса хлора
равна 35,45. Массовые доли изотопов
составляют соответственно
.
Относительная атомная масса хлора
равна 35,45. Массовые доли изотопов
составляют соответственно
* А. 77,5% и 22,5%
Б. 22,5% и 77,5%
В. 79,9% и 20,1%
Г. 77,5% и 20,1%
Д. 50% и 50%
