
- •С.А. Герус
- •Предисловие
- •Глава I. Введение в геохимию.
- •§1. Предмет, история и методология геохимии
- •§2. История геохимии
- •§ 2. Распространённость химических элементов в оболочках Земли.
- •§ 3. Геохимия планет земной группы и космохимия.
- •§ 4. Факторы и общие характеристики миграции элементов.
- •§ 5. Механическая миграция (механогенез).
- •Глава 2. Физико-химическая миграция.
- •§ 6. Общие закономерности физико-химической миграции.
- •§ 7. Миграция газов.
- •§ 8.Общие закономерности водной миграции.
- •§ 9. Магматические и гипергенные физико-химические системы.
- •Глава 3. Биогенная миграция.
- •§ 10.Общие особенности биогенной миграции.
- •§ II. Геохимия ископаемых органических веществ, биологические системы.
- •§ 12. Геохимия биокосных систем.
- •Глава 4.Техногенная миграция.
- •§13. Характеристика техногенной миграции.
- •Глава 5. Геохимия отдельных элементов.
- •§ 14. Геохимия элементов I группы.
- •§ 15. Геохимия элементов II группы.
- •§ 16. Геохимия элементов III группы.
- •§ 14. Г.Какие принципы положены в основу геохимической классификации элементов?
- •§ 15. I.Охарактеризуйте геохимию отдельных элементов II группы.
- •§ 16. I. Охарактеризуйте геохимию нескольких контрактных элементов Периодической системы д.И. Менделеева.
- •§ 14. Г.Какие принципы положены в основу геохимической классификации элементов?
- •§ 15. I.Охарактеризуйте геохимию отдельных элементов II группы.
- •§ 16. I. Охарактеризуйте геохимию нескольких контрактных элементов Периодической системы д.И. Менделеева.
§ 2. Распространённость химических элементов в оболочках Земли.
1. Земная кора.
а) Изучение скоростей распространения сейсмических волн позволило построить «сейсмическую модель Земли», выделать земную кору, мантию и ядро. Мантия и земное ядро недоступны для непосредственных исследований, и представления об их геохимии основаны на косвенных, главным образом геофизических данных. Большинство построений в этой области носит характер гипотез, хотя исходные геофизические данные бесспорны. Так, установлено, что средняя плотность Земли составляет 5,52 г/см3, а пород земной коры – 2,8 г/см3. Отсюда следует вывод о высокой плотности земных глубин. Это может быть связано как с изменением состава (например, с увеличением количества тяжёлых металлов Fe, Ni), так и с фазовыми превращениями лёгких минералов. О возможности второго пути свидетельствует открытие тяжёлых полиморфных разновидностей SiO2 – стишовита с плотностью 4,35 и коэсита – 2,93 (у кварца – 2,65).
б) Границу Мохо (Мохоровичича, М.) считают нижней границей земной коры. Наибольшую мощность она имеет под горными хребтами (до 75 км), наименьшую – на дне океанов (5 – 15 км).
В земной коре скорость распространения сейсмических волн неодинакова. На континентах была выделена «граница Конрада» (К), отделяющая верхний – «гранитный» слой коры от нижнего «базальтового» В океанах гранитный слой отсутствует.
Количественную распространённость химических элементов в земной коре впервые установил Ф.У. Кларк. В земную кору он включил также гидросферу и атмосферу. Однако масса гидросферы составляет лишь несколько процентов, а атмосферы – сотые доли процента от массы твёрдой земной коры, поэтому числа Кларка в основном отражают состав последней. Сводка учёного 1889 г. содержала сведения о распространённости 10 элементов, а 1924 г. – 50 элементов.
Отдавая должное Кларку, свыше 40 лет посвятившему этим исследованиям, Д.. Е. Ферсман в 1923 г. – предложил термином «кларк» обозначать среднее содержание химического элемента в земной коре, какой-либо её части, Земле в целом, в планетах и других космических объектах. Со дня опубликования первой таблицы Кларка прошло 100 лет и общая картина распространённости элементов выявилась достаточно отчётливо. Подтвердилось гениальное положение Вернадского о рассеянном состоянии химических элементов. Для I, Hf, Sc, Rb, In, Cs, Ra и некоторых других редких элементов оно является основным, т. к. они не образуют или почти не образуют собственных минералов; для большинства элементов – преобладавшим, и только для O, Si, Al, Fe, Ca, Na, K и Mg главной формой нахождения являются собственные минералы. Итак, все элементы есть везде, речь может идти только о недостаточной чувствительности анализа, не позволяющего определить содержание того или иного элемента в изучаемой системе. Это положение о всеобщем рассеянии химических элементов Н.И. Сафронов предложил называть законом Кларка – Вернадского.
в) Кларки, земной коры.
А.П. Виноградов, предположив, что земная кора на 2/3 состоит из кислых пород и на 1/3 - из основных, вычислил её средний состав.
А.А. Беус установил кларки, исходя из соотношения мощностей гранитного и базальтового слоёв 1:2.
Представления о составе базальтового слоя весьма гипотетичны. По А.А. Беусу, его средний состав (%) близок к диоритам:

Эти данные свидетельствуют, что почти половина земной коры состоит из одного элемента – кислорода. Таким образом, земная кора – это «кислородная сфера», кислородное вещество. На втором месте стоит кремний (кларк-29,5), на третьем – алюминий (8,05). В сумме они составляют 84,55%. Если к этому числу добавить Fe (4,65), Ca (2,96), Na (2,50), K (2,50), Mg (1,87), Ti (0,45), то получим 99,48 %, т.е. практически почти вся земная кора. Остальные 80 элементов занимают менее 1%. Кларки большинства элементов не превышают 0,01 – 0,0001%. Такие элементы называются редкими. Бели они обладают слабой способностью к концентрации, то именуются редкими рассеянными (Br, In, Ra, I, Hf, Re, Sc и др.). Например, у U Br кларки почти одинаковы (2,5∙10-4 и 2,1∙10-4%), но U просто редкий элемент, т.к. известны его месторождения, а Br – редкий рассеянный, т.к. он почти не концентрируется в земной коре и известен лишь один собственный минерал этого элемента.
В геохимии употребляется термин «микроэлементы» - это элементы, содержащиеся в данной системе в малых количествах (порядка 0,01% и менее). Так, Al – микроэлемент в организмах и макроэлемент в силикатных породах.
Итак, содержание элементов в земной коре колеблется в миллиарды миллиардов раз (n∙I0 - n∙10-16), причём представления, почерпнутые из повседневного опыта, не всегда совпадают с данными геохимии. Например, Zn и Сu широко распространены в быту и технике, а Zr и Ti для нас «редкие элементы». Вместе с тем в земной коре почти в 4 раза больше, чем Cu, а Ti - даже в 95 раз. «Редкость» Zr и Ti объясняется трудностью извлечения их из руд, которая была преодолена только в середине XX в., когда эти металлы стали широко использоваться в промышленности.
В чём же причина столь неравномерного распределения элементов в земной коре? Ответ на этот вопрос связан с особенностями строения атомов элементов. Так, щелочные металлы Li, Na, K, Rb, Cs, Fr в химическом отношении близки друг другу - у них один валентный электрон, но кларки их резко различны: Na и K много (2,50), Rb - мало (1,5∙10-2), Li - ещё меньше (3,2∙10-3), Cs - очень редок (3,7∙10-4), а Fr - получен искусственно.
Резко различны кларки у F, Cl, Br, I; у Si (29,5) и Ge (1,4∙10-4), у Ba (6,5∙10-2) и Ra (2∙10-10). С другой стороны, различные в химическом отношении элементы имеют близкие кларки: Mn (0,1) и P(0,093), Rb (1,5∙10-2) и Cl (1,7∙10-2).
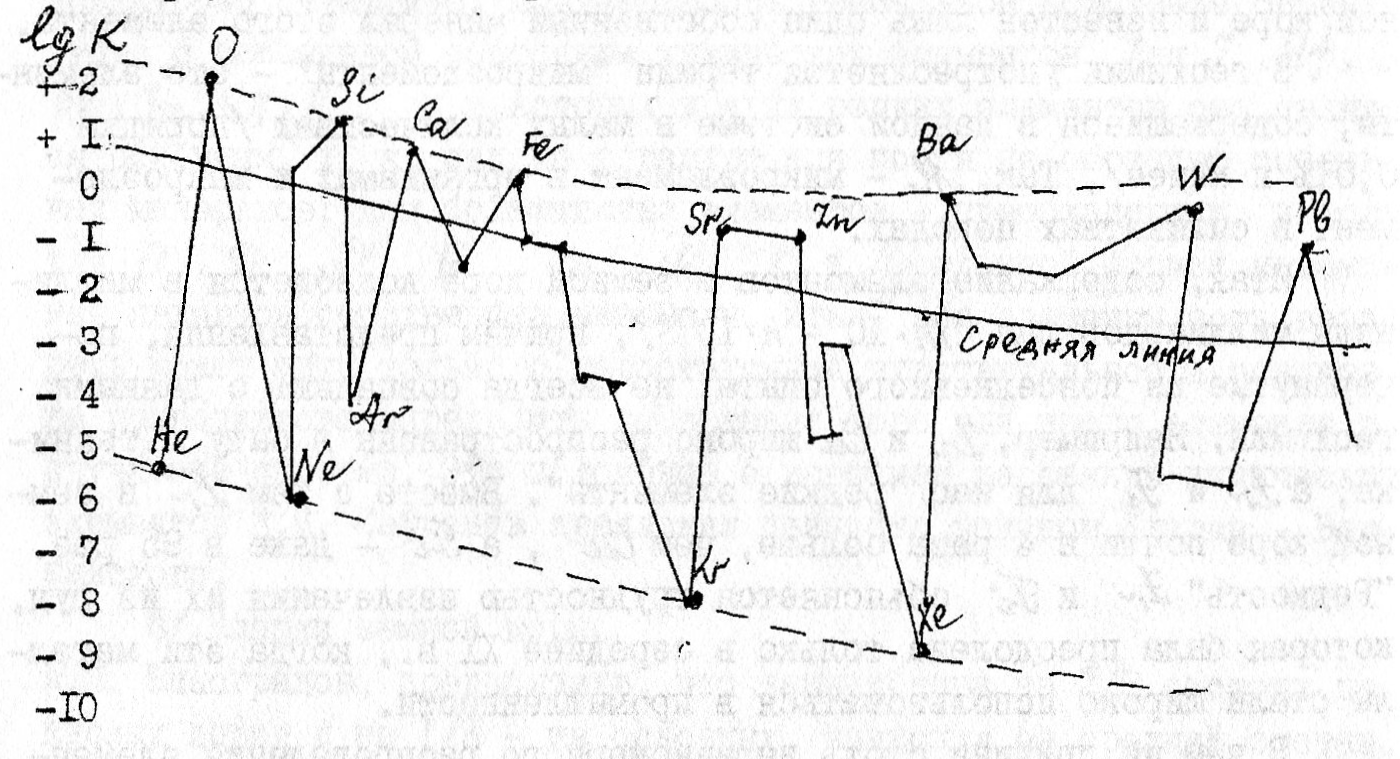
А.Е. Ферсман построил график зависимости атомных кларков для чётных и нечётных (по порядковому номеру) элементов периодической системы (Рис. 1.).
С усложнением строения атомного ядра, утяжелением его, кларки уменьшаются. Кривые оказались не монотонными, а ломанsми. Ферсман прочертил гипотетическую среднюю линию, которая плавно понижалась по мере возрастания порядкового номера. Элементы, расположенные выше линии, – образующие пики, учёный назвал избыточными (O, Si, Fe и др.), а расположенные ниже – дефицитными /инертные газы и др./ Следовательно в земной коре преобладают лёгкие атомы, занимающие начальные клетки периодической системы, ядра которых содержат небольшое число протонов и нейтронов. Действительно, после Fe (№26) нет ни одного распространённого элемента.
Логарифмы атомных кларков элементов (по А.Е. Ферсману).
 Другая
особенность распространённости,
элементов установлена в 1914 г. итальянцем
Г. Оддо и более детально в 1915-1928 г.
американцем В. Гаркинсом. Они выявили,
что в земной коре преобладают элементы
с чётными порядковыми номерами и атомными
массами. Среда соседних элементов у
чётных кларки почти всегда выше, чем у
нечётных. Для первых по распространённости
9 элементов массовые кларки чётных
составляют в сумме 86,43%, кларки нечётных
– 13,03%. Особенно велики кларки элементов,
атомная масса которых делится на 4. Это
O,
Mg,
Si,
Ca
и т.д. Среди атомов одного и того же
элемента преобладают изотопы с массовыми
числами, кратными 4, например у O
и S:
Другая
особенность распространённости,
элементов установлена в 1914 г. итальянцем
Г. Оддо и более детально в 1915-1928 г.
американцем В. Гаркинсом. Они выявили,
что в земной коре преобладают элементы
с чётными порядковыми номерами и атомными
массами. Среда соседних элементов у
чётных кларки почти всегда выше, чем у
нечётных. Для первых по распространённости
9 элементов массовые кларки чётных
составляют в сумме 86,43%, кларки нечётных
– 13,03%. Особенно велики кларки элементов,
атомная масса которых делится на 4. Это
O,
Mg,
Si,
Ca
и т.д. Среди атомов одного и того же
элемента преобладают изотопы с массовыми
числами, кратными 4, например у O
и S:
16O - 99,76 32S - 95,01
17O - 0,04 33S - 0,75
18O - 0,20 34S - 4,22
36S - 0,02
По Ферсману ядра типа 4q (q - целое число) слагают 86,3% земной коры. Менее распространены ядра типа 4q+3 (12,7%) и совсем мало ядер 4q+1 и 4q+2 (1%). Отмечено также, что среди чётных элементов, начиная с He, наибольшими кларками обладает каждый шестой: O (№8), Si (№14), Ca (№20), Fe (№26).
Для нечётных существует аналогичное правило (начиная c Н); N (№7), Al (№13), К (№19), Mn (№ 25). Итак, в земной коре преобладают ядра с небольшим и чётным числом протонов и нейтронов.
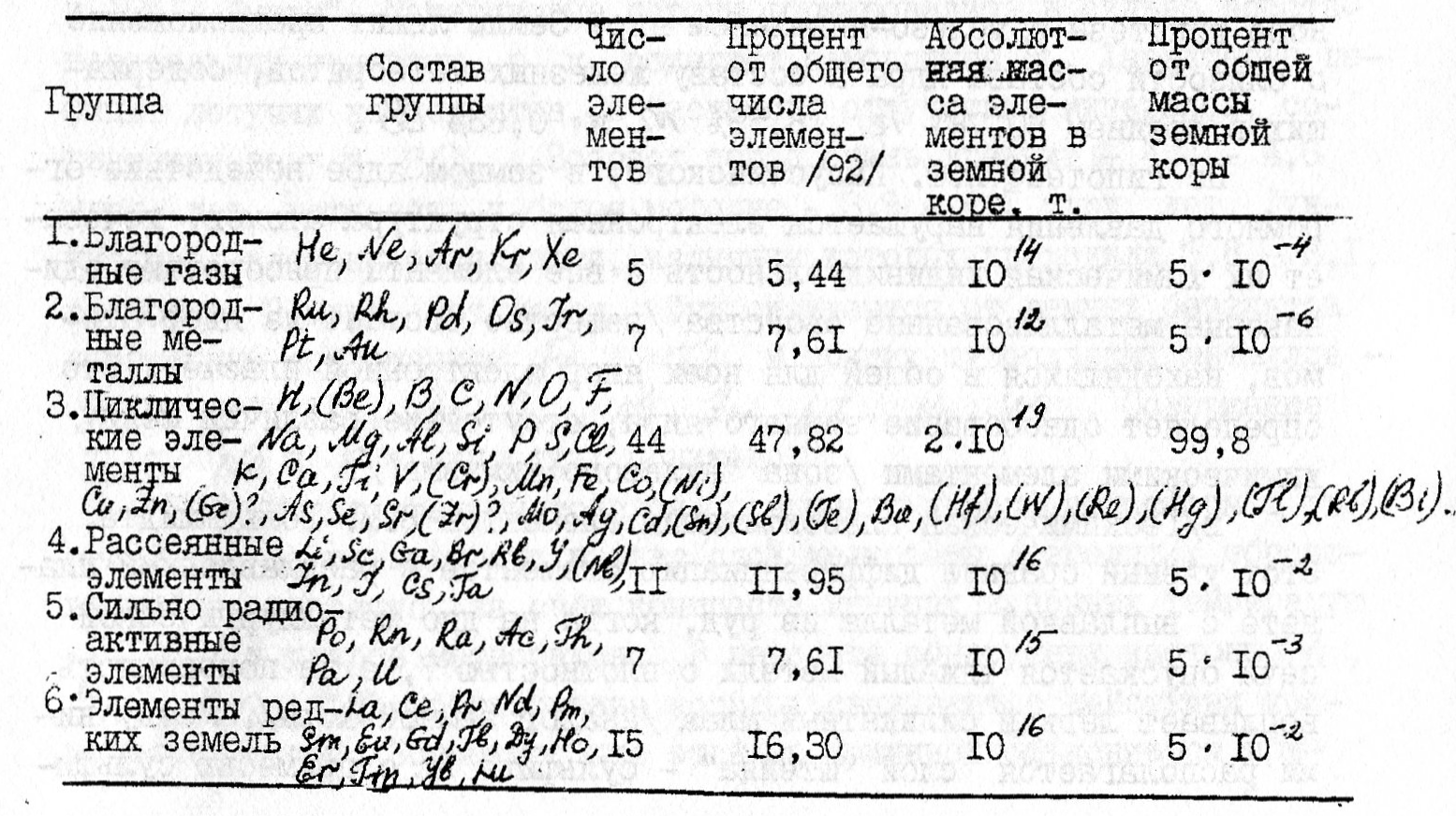
г). Геохимическая классификация элементов В.И. Вернадского. Родственные по периодической системе элементы ведут себя в земной коре далеко неодинаково. Так, Na и K, Fe и Ni, Сl и I, Cr и Mo - аналоги в химии, но в земной коре мигрируют по-разному. Это связано со свойствами элементов, которые с общехимических позиций второстепенны. В.И. Вернадский создал особую геохимическую классификацию, в которой учтены саше важные моменты истории элементов в земной коре. Главное значение ученый придавал радиоактивности, обратимости или необратимости миграции, способности элементов давать минералы, состоящие из нескольких разнородных атомов. Вернадский выделил 6 групп элементов. Наиболее крупная из них - "циклические элементы", участвующие в сложных круговоротах. По массе они преобладают в земной коре, из них в основном состоят горные породы, вода, организмы. Эта классификация дополнена ещё двумя группами элементов: элементами, по-видимому, вымершими в земной коре, но известными в космосе, - Tc, Am, Cm, Bk и Cf, и элементами, неизвестными в природе, но полученными искусственно, - Pm, Es, Md, No, Ku и др.
Таблица 1. Геохимические группы элементов по В.И. Вернадскому (1934 г).
2. а) Верхняя мантия.
В середине XX века английские геофизики Г. Джеффрис и К.Буллен по сейсмическим данным разделили мантию на верхнюю (до 400 км), переходную зону (400 – 1000 км) и нижнюю (1000 – 2900 км). Верхняя мантия неоднородна по элементарному и изотопному составу. Изучение изотопного состава глубинных газов позволило установить «гелиевое», «аргоновое», «неоновое», «ксеноновое» дыхание Земли. Для глубинных газов характерны CO, H2, CH4 - показатели резко восстановительной среды. Состав верхней мантии ряд авторов считает аналогичным хондритам (состоят из стекла). Составу верхней мантии отвечает смесь трёх частей ультраосновных пород и одной щелочного базальта.
б) Переходная зона, нижняя мантия и земное ядро.
Переходная зона и нижняя мантия, вероятно, также имеют силикатный состав. Их большую плотность объясняют образованием более плотной модификации минералов – стишовита, шпинели, периклаза и др. По элементарному составу нижняя мантия сильно отличается от земной коры, хотя в ней всё ещё преобладает O. Второе место принадлежит Fe и лишь третье - Si. Высоки кларки Mg, Ni, S, сравнительно малы – Ca и Al.
По сейсмическим данным большая часть земного ядра жидкая (внешнее ядро) и только на глубинах более 5100 км расположено твёрдое внутреннее ядро с плотностью около 12 - 13 г/см3. В основе гипотезы о железо-никелевом ядре Земли лежит предположение о близости состава ядра к составу железных метеоритов, содержащих в среднем 80,78% Fe, 8,59% Ni и 0,63% Co.
По гипотезе А.Ф. Капуетинского, в земном ядре вследствие огромного давления нарушается электронная структура атомов, исчезает их химическая индивидуальность и все элементы приобретают одинаковые металлизованные свойства (вещество состоит из ядер.атомов, находящихся в общей для всех ядер электронной плазме). Это определяет однообразие земного ядра, отсутствие различий между химическими элементами (зона «нулевого химизма»).
в) Геохимическая классификация элементов В.М. Гольдшмидта. Этот учёный сравнил дифференциацию элементов в расплавленной планете с выплавкой металла из руд, когда на дно металлургической печи опускается тяжёлый металл с плотностью 7, а на поверхность всплывает лёгкий силикатный шлак (аналог земной коры). Между ними располагается слой «штейна» - сульфида Fe с примесью сульфидов других металлов (аналог мантии). Распределение элементов на оболочках, по Гольдшмидту, зависело от их атомных объёмов. Элементы, занимающие минимумы по кривой атомных объёмов, дают сплавы с Fe, в ходе дифференциации они образовали земное ядро (си- дерофильные элементы). Элементы, занимающие максимумы на кривой, обладают большим сродством к кислороду. При дифференциации они образовали земную кору и верхнюю мантию (литофильные элементы). Элементы с высоким сродством к S, Se, Fe (халъкофильные) занимают восходящие части кривой; они сосредоточены в нижней мантии; образуют сульфидно-оксидную оболочку. Инертные газы относятся к атмофильной группе. Данная классификация широко применяется в геохимии.
