
- •1. Предмет коллоидной химии
- •1.1. Основные понятия и определения
- •1.2. Классификация дисперсных систем
- •1.3. Поверхностное натяжение. Свободная поверхностная энергия
- •1.3.1. Поверхностное натяжение индивидуальных жидкостей
- •1.3.2. Поверхностное натяжение многокомпонентных растворов
- •2. Поверхностные явления
- •2.1. Классификация поверхностных явлений
- •2.2. Адсорбция
- •2.2.1. Основные понятия и определения
- •2.2.2. Природа адсорбционных сил
- •2.2.3. Теории адсорбции
- •Теория мономолекулярной адсорбции Ленгмюра
- •1 Моль – частиц,
- •Теория полимолекулярной адсорбции Поляни (потенциальная теория адсорбции)
- •Теория полимолекулярной адсорбции бэт
- •2.2.4. Уравнения адсорбции
- •Фундаментальное адсорбционное уравнение Гиббса
- •Закон Генри
- •Уравнение Фрейндлиха
- •2.2.5. Адсорбция на границе жидкость-газ Понятие о пав
- •Ориентация молекул пав в поверхностном слое
- •Изотермы поверхностного натяжения и адсорбции пав
- •Физический смысл констант уравнения Шишковского
- •Поверхностная активность. Правило Дюкло – Траубе
- •Методы определения величины адсорбции
- •2.2.6. Адсорбция на твердой поверхности Особенности адсорбции на поверхности твердых тел
- •Классификация твердых адсорбентов
- •Требования, предъявляемые к адсорбентам
- •Адсорбция газов. Капиллярная конденсация
- •Адсорбция из жидких сред
- •1. Молекулярная адсорбция
- •2. Ионная адсорбция
- •3. Ионообменная адсорбция
- •Применение адсорбционных процессов
- •2.3. Адгезия и смачивание
- •2.3.1. Основные понятия
- •2.3.2. Работа адгезии и когезии
- •2.3.3. Смачивание
- •2.3.4. Связь между работой адгезии и краевым углом смачивания
- •3. Электрические свойства дисперсных систем. Электрокинетические явления
- •3.1. Возникновение электрического заряда на поверхности раздела фаз
- •3.2. Современные представления о строении дэс
- •3.3. Строение мицеллы гидрофобного золя
- •3.4. Факторы, влияющие на электрокинетический потенциал
- •3.4.1. Влияние температуры
- •3.4.2. Влияние электролитов
- •Влияние индифферентных электролитов
- •Влияние неиндифферентных электролитов
- •3.4.3. Влияние рН среды
- •3.4.4. Влияние природы дисперсионной среды
- •3.5. Электрокинетические явления
- •3.5.1. Электрофорез
- •3.5.2. Потенциал седиментации
- •3.5.3. Электроосмос
- •3 .5.4. Потенциал течения
- •4. Устойчивость и нарушение устойчивости лиофобных золей
- •4.1. Седиментационная устойчивость
- •4.2. Агрегативная устойчивость и коагуляция
- •Теория устойчивости гидрофобных золей длфо
- •Факторы, определяющие агрегативную устойчивость коллоидных систем
- •4.3. Коагуляция гидрофобных дисперсных систем
- •4.3.1. Коагуляция золей электролитами
- •Концентрационная коагуляция
- •Нейтрализационная коагуляция
- •Явление неправильных рядов
- •4.3.2. Кинетика коагуляции
- •Константа скорости быстрой коагуляции
- •Константа скорости медленной коагуляции
- •5. Свойства дисперсных систем
- •5.1. Оптические свойства дисперсных систем
- •5.1.1. Рассеяние света
- •Теория светорассеяния Рэлея
- •5.1.2. Поглощение света и окраска золей
- •5.1.3. Оптические методы исследования коллоидных растворов
- •5.2. Молекулярно-кинетические свойства дисперсных систем
- •5.2.1. Броуновское движение
- •5.2.2. Диффузия
- •5.2.3. Осмос
- •5.3. Получение дисперсных систем
5.1.2. Поглощение света и окраска золей
Многие коллоидные растворы имеют окраску, что указывает на поглощение ими света. Поглощение света – ослабление светового потока при прохождении его сквозь среду.
Для истинных растворов поглощение света описывается законом Бугера-Ламберта-Бера:
![]() ,
(72)
,
(72)
где
![]() ,
– интенсивность прошедшего и падающего
света соответственно;
,
– интенсивность прошедшего и падающего
света соответственно;
– толщина слоя раствора;
– концентрация раствора;
– коэффициент поглощения.
Преобразуем уравнение:
![]() ;
;
![]() ,
(73)
,
(73)
где – оптическая плотность раствора.
При падении света на систему, представляющую собой истинный раствор, происходит поглощение и частичное прохождение света. В коллоидных растворах наряду с поглощением света всегда происходит рассеяние света частицами дисперсной фазы. Поэтому интенсивность прошедшего света значительно уменьшается. Ослабление светового потока, вызванное светорассеянием, называется фиктивным поглощением. С учетом этого, оптическая плотность коллоидного раствора определяется по формуле:
![]() ,
(74)
,
(74)
где
![]() – коэффициент фиктивного поглощения,
зависит от показателей преломления
дисперсной фазы и дисперсионной среды,
размера частиц, длины волны.
– коэффициент фиктивного поглощения,
зависит от показателей преломления
дисперсной фазы и дисперсионной среды,
размера частиц, длины волны.
Т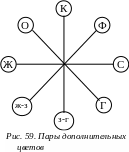 ак
как окраска золя обусловлена частичным
пропусканием света соответствующей
длины волны, золь всегда окрашен в цвет,
дополнительный к поглощенному. Пропущенный
и поглощенный световые потоки, составляющие
вместе белый цвет называются парами
дополнительных цветов (рис. 59).
ак
как окраска золя обусловлена частичным
пропусканием света соответствующей
длины волны, золь всегда окрашен в цвет,
дополнительный к поглощенному. Пропущенный
и поглощенный световые потоки, составляющие
вместе белый цвет называются парами
дополнительных цветов (рис. 59).
Например, при поглощении синевато-зеленой части спектра (490–500 нм) золь принимает красную окраску. С явлениями поглощения и рассеяния связана окраска драгоценных камней и самоцветов обусловлена, содержащих высокодисперсные металлические включения (например, рубин это коллоидный раствор хрома или золота в Al2O3). Если объект поглощает излучение всего видимого спектра, то он кажется черным.
Для исследования цветных золей применяют светофильтры, поглощающие свет из области спектра, дополнительной к окраске исследуемого золя, например, для красных золей – зеленый светофильтр.
Лекция 16
5.1.3. Оптические методы исследования коллоидных растворов
На явлении рассеяния света коллоидными частицами основан ряд важнейших методов их исследования.
Ультрамикроскопия.
При использовании видимого света обычный микроскоп позволяет рассмотреть частицы размером не менее 200 нм. Ультрамикроскоп увеличивает в то же количество раз, что и обычный микроскоп, но его разрешающая способность составляет 2–3 нм, что достигается наблюдением света, рассеянного отдельными частицами. При применении бокового освещения свет не попадает в объектив микроскопа и в глаз наблюдателя, фон поля зрения остается темным. На темном фоне становится заметным слабый свет, рассеиваемый коллоидными частицами. Они представляются наблюдателю в виде отдельных светящихся точек.
Размер и форма частиц дисперсной фазы
могут быть определены косвенным путем.
Для этого подсчитывают число частиц
в определенном объеме раствора
![]() и находят частичную концентрацию:
и находят частичную концентрацию:
![]() .
.
Другим методом (например, измеряя
оптическую плотность коллоидного
раствора) определяют массовую концентрацию
![]() ,
которая связана с частичной концентрацией
уравнением:
,
которая связана с частичной концентрацией
уравнением:
,
находим объем частицы:
![]() .
.
Зная объем можно найти радиус частицы:
![]() .
.
Электронная микроскопия.
В электронном микроскопе вместо световых лучей применяются пучки электронов с длиной волны всего 0,002 – 0,005 нм, что резко увеличивает его разрешающую способность и дает возможность непосредственно видеть и фотографировать коллоидные частицы. Внутри электронного микроскопа поддерживается глубокий вакуум. Поэтому образцы исследуемых материалов должны быть тщательно высушены, что может приводить к существенным изменениям свойств изучаемых систем. Это является недостатком метода.
