
- •1. Предмет коллоидной химии
- •1.1. Основные понятия и определения
- •1.2. Классификация дисперсных систем
- •1.3. Поверхностное натяжение. Свободная поверхностная энергия
- •1.3.1. Поверхностное натяжение индивидуальных жидкостей
- •1.3.2. Поверхностное натяжение многокомпонентных растворов
- •2. Поверхностные явления
- •2.1. Классификация поверхностных явлений
- •2.2. Адсорбция
- •2.2.1. Основные понятия и определения
- •2.2.2. Природа адсорбционных сил
- •2.2.3. Теории адсорбции
- •Теория мономолекулярной адсорбции Ленгмюра
- •1 Моль – частиц,
- •Теория полимолекулярной адсорбции Поляни (потенциальная теория адсорбции)
- •Теория полимолекулярной адсорбции бэт
- •2.2.4. Уравнения адсорбции
- •Фундаментальное адсорбционное уравнение Гиббса
- •Закон Генри
- •Уравнение Фрейндлиха
- •2.2.5. Адсорбция на границе жидкость-газ Понятие о пав
- •Ориентация молекул пав в поверхностном слое
- •Изотермы поверхностного натяжения и адсорбции пав
- •Физический смысл констант уравнения Шишковского
- •Поверхностная активность. Правило Дюкло – Траубе
- •Методы определения величины адсорбции
- •2.2.6. Адсорбция на твердой поверхности Особенности адсорбции на поверхности твердых тел
- •Классификация твердых адсорбентов
- •Требования, предъявляемые к адсорбентам
- •Адсорбция газов. Капиллярная конденсация
- •Адсорбция из жидких сред
- •1. Молекулярная адсорбция
- •2. Ионная адсорбция
- •3. Ионообменная адсорбция
- •Применение адсорбционных процессов
- •2.3. Адгезия и смачивание
- •2.3.1. Основные понятия
- •2.3.2. Работа адгезии и когезии
- •2.3.3. Смачивание
- •2.3.4. Связь между работой адгезии и краевым углом смачивания
- •3. Электрические свойства дисперсных систем. Электрокинетические явления
- •3.1. Возникновение электрического заряда на поверхности раздела фаз
- •3.2. Современные представления о строении дэс
- •3.3. Строение мицеллы гидрофобного золя
- •3.4. Факторы, влияющие на электрокинетический потенциал
- •3.4.1. Влияние температуры
- •3.4.2. Влияние электролитов
- •Влияние индифферентных электролитов
- •Влияние неиндифферентных электролитов
- •3.4.3. Влияние рН среды
- •3.4.4. Влияние природы дисперсионной среды
- •3.5. Электрокинетические явления
- •3.5.1. Электрофорез
- •3.5.2. Потенциал седиментации
- •3.5.3. Электроосмос
- •3 .5.4. Потенциал течения
- •4. Устойчивость и нарушение устойчивости лиофобных золей
- •4.1. Седиментационная устойчивость
- •4.2. Агрегативная устойчивость и коагуляция
- •Теория устойчивости гидрофобных золей длфо
- •Факторы, определяющие агрегативную устойчивость коллоидных систем
- •4.3. Коагуляция гидрофобных дисперсных систем
- •4.3.1. Коагуляция золей электролитами
- •Концентрационная коагуляция
- •Нейтрализационная коагуляция
- •Явление неправильных рядов
- •4.3.2. Кинетика коагуляции
- •Константа скорости быстрой коагуляции
- •Константа скорости медленной коагуляции
- •5. Свойства дисперсных систем
- •5.1. Оптические свойства дисперсных систем
- •5.1.1. Рассеяние света
- •Теория светорассеяния Рэлея
- •5.1.2. Поглощение света и окраска золей
- •5.1.3. Оптические методы исследования коллоидных растворов
- •5.2. Молекулярно-кинетические свойства дисперсных систем
- •5.2.1. Броуновское движение
- •5.2.2. Диффузия
- •5.2.3. Осмос
- •5.3. Получение дисперсных систем
3.5.2. Потенциал седиментации
Потенциал седиментации – возникновение разности потенциалов при седиментации (оседании) заряженных частиц дисперсной фазы в неподвижной дисперсионной среде.
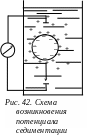 Рассмотрим
коллоидную систему, находящуюся в
емкости (например, в отстойнике) (рис.
42).
Рассмотрим
коллоидную систему, находящуюся в
емкости (например, в отстойнике) (рис.
42).
Под действием силы тяжести частицы дисперсной фазы оседают. Процесс оседания частиц называют седиментацией. При оседании частиц дисперсионная среда остается практически неподвижной. Перемещение частиц относительно жидкой дисперсионной среды происходит по границе скольжения, то есть частицы движутся вместе с потенциалопределяющими ионами и адсорбционным слоем противоионов. Это приводит к тому, что диффузионная часть ДЭС отстает от частицы, поэтому в сплошной среде концентрируются противоионы. Чем выше от днища сосуда, тем больше концентрация противоионов.
Если в сосуд на разной высоте поместить электроды, то вольтметр, включенный в цепь, покажет разность потенциалов, которую называют потенциалом седиментации (оседания).
Потенциал седиментации обратен электрофорезу. В обоих случаях происходит движение частиц. Но при электрофорезе перемещение происходит в результате взаимодействия электрического поля с избыточным зарядом частиц, а при потенциале седиментации – в процессе оседания частиц возникает разность потенциалов.
С потенциалом седиментации приходится сталкиваться в различных производствах при осаждении суспензий, эмульсий, разделении фаз. На концах аппаратов могут возникать достаточно высокие разности потенциалов, что приводит к возникновению искровых разрядов и пожаров.
3.5.3. Электроосмос
Электроосмос – движение дисперсионной среды через неподвижную капиллярно-пористую перегородку под действием внешнего электрического поля.
 Э
Э лектроосмос
обычно происходит в капиллярах и каналах
пористых тел. Пусть в центр U-образной
трубки помещена мембрана, представляющая
собой мелкопористый стеклянный фильтр
(рис. 43). Трубка заполнена электропроводящей
жидкостью. Рассмотрим сечение одного
капилляра (рис. 44). Возникновение заряда
на стенках капилляров стеклянного
фильтра происходит за счет диссоциации
молекул поверхностного слоя:
лектроосмос
обычно происходит в капиллярах и каналах
пористых тел. Пусть в центр U-образной
трубки помещена мембрана, представляющая
собой мелкопористый стеклянный фильтр
(рис. 43). Трубка заполнена электропроводящей
жидкостью. Рассмотрим сечение одного
капилляра (рис. 44). Возникновение заряда
на стенках капилляров стеклянного
фильтра происходит за счет диссоциации
молекул поверхностного слоя:
![]() .
.
Ионы
![]() переходят в раствор, а
переходят в раствор, а
![]() связаны с кристаллической решеткой
стекла и создают на поверхности капилляра
отрицательный заряд, т.е. являются
потенциалопределяющими ионами. Возле
стенок капилляра формируется ДЭС. Пленка
жидкости вместе с противоионами
адсорбционного слоя «прилипает» к
стенке капилляра и остается неподвижной.
А противоионы диффузной части ДЭС под
действием внешнего электрического поля
перемещаются к катоду. Противоионы
гидратированы, следовательно, вместе
с ними к отрицательному электроду
двигается и дисперсионная среда. Таким
образом, перемещение дисперсионной
среды относительно стенок капилляров
происходит по плоскости скольжения. В
результате в левой части трубки уровень
жидкости понижается, а в правой –
повышается. Процесс прекратится, когда
величина гидростатического давления
станет достаточной для того, чтобы
остановить движение противоионов.
связаны с кристаллической решеткой
стекла и создают на поверхности капилляра
отрицательный заряд, т.е. являются
потенциалопределяющими ионами. Возле
стенок капилляра формируется ДЭС. Пленка
жидкости вместе с противоионами
адсорбционного слоя «прилипает» к
стенке капилляра и остается неподвижной.
А противоионы диффузной части ДЭС под
действием внешнего электрического поля
перемещаются к катоду. Противоионы
гидратированы, следовательно, вместе
с ними к отрицательному электроду
двигается и дисперсионная среда. Таким
образом, перемещение дисперсионной
среды относительно стенок капилляров
происходит по плоскости скольжения. В
результате в левой части трубки уровень
жидкости понижается, а в правой –
повышается. Процесс прекратится, когда
величина гидростатического давления
станет достаточной для того, чтобы
остановить движение противоионов.
Применение электроосмоса.
1. Метод электроосмоса, как и электрофореза широко используется для определения потенциала.
Суммарный объем жидкости , протекающей через мембрану с общей площадью поперечного сечения всех капилляров в единицу времени равен
![]() ,
,
где – скорость течения жидкости (электроосмотическая скорость), равна (47)
![]() .
(47)
.
(47)
Тогда
![]() .
(48)
.
(48)
Из уравнения (48) следует, что объем жидкости, перенесенный через мембрану прямо пропорционален поперечному сечению капилляров , диэлектрической проницаемости среды, градиенту электрического поля и обратно пропорционален вязкости жидкости. Полученную формулу трудно применять для расчета потенциала, так как суммарное поперечное сечение капилляров мембраны измерить весьма сложно. Преобразуем уравнение (48). Согласно закону Ома
![]() ,
,
где
– разность потенциалов;
![]() – сила тока;
– сила тока;
![]() – сопротивление.
– сопротивление.
Применительно к электропроводящей жидкости, перемещающейся в капиллярах под действием электрического поля:
![]() ,
,
где – удельное сопротивление; – расстояние между электродами;
![]() – удельная электропроводность.
– удельная электропроводность.
Тогда
![]() .
(49)
.
(49)
Градиент внешнего электрического поля равен
![]() .
.
Подставляем в (48)
![]() .
(50)
.
(50)
Таким образом, для определения потенциала методом электроосмоса необходимо знать свойства дисперсионной среды ( , , ), силу тока и объем жидкости, перенесенный через мембрану.
2. Электроосмос применяют при обезвоживании древесины и др. пористых материалов: продуктов питания, сырья для пищевой промышленности (сахарных сиропов, желатина) и т.д. Влажную массу помещают между электродами и вода, в зависимости от заряда противоионов ДЭС, движется к одному из них и собирается в специальной емкости.
Лекция 12
