
- •1. Предмет коллоидной химии
- •1.1. Основные понятия и определения
- •1.2. Классификация дисперсных систем
- •1.3. Поверхностное натяжение. Свободная поверхностная энергия
- •1.3.1. Поверхностное натяжение индивидуальных жидкостей
- •1.3.2. Поверхностное натяжение многокомпонентных растворов
- •2. Поверхностные явления
- •2.1. Классификация поверхностных явлений
- •2.2. Адсорбция
- •2.2.1. Основные понятия и определения
- •2.2.2. Природа адсорбционных сил
- •2.2.3. Теории адсорбции
- •Теория мономолекулярной адсорбции Ленгмюра
- •1 Моль – частиц,
- •Теория полимолекулярной адсорбции Поляни (потенциальная теория адсорбции)
- •Теория полимолекулярной адсорбции бэт
- •2.2.4. Уравнения адсорбции
- •Фундаментальное адсорбционное уравнение Гиббса
- •Закон Генри
- •Уравнение Фрейндлиха
- •2.2.5. Адсорбция на границе жидкость-газ Понятие о пав
- •Ориентация молекул пав в поверхностном слое
- •Изотермы поверхностного натяжения и адсорбции пав
- •Физический смысл констант уравнения Шишковского
- •Поверхностная активность. Правило Дюкло – Траубе
- •Методы определения величины адсорбции
- •2.2.6. Адсорбция на твердой поверхности Особенности адсорбции на поверхности твердых тел
- •Классификация твердых адсорбентов
- •Требования, предъявляемые к адсорбентам
- •Адсорбция газов. Капиллярная конденсация
- •Адсорбция из жидких сред
- •1. Молекулярная адсорбция
- •2. Ионная адсорбция
- •3. Ионообменная адсорбция
- •Применение адсорбционных процессов
- •2.3. Адгезия и смачивание
- •2.3.1. Основные понятия
- •2.3.2. Работа адгезии и когезии
- •2.3.3. Смачивание
- •2.3.4. Связь между работой адгезии и краевым углом смачивания
- •3. Электрические свойства дисперсных систем. Электрокинетические явления
- •3.1. Возникновение электрического заряда на поверхности раздела фаз
- •3.2. Современные представления о строении дэс
- •3.3. Строение мицеллы гидрофобного золя
- •3.4. Факторы, влияющие на электрокинетический потенциал
- •3.4.1. Влияние температуры
- •3.4.2. Влияние электролитов
- •Влияние индифферентных электролитов
- •Влияние неиндифферентных электролитов
- •3.4.3. Влияние рН среды
- •3.4.4. Влияние природы дисперсионной среды
- •3.5. Электрокинетические явления
- •3.5.1. Электрофорез
- •3.5.2. Потенциал седиментации
- •3.5.3. Электроосмос
- •3 .5.4. Потенциал течения
- •4. Устойчивость и нарушение устойчивости лиофобных золей
- •4.1. Седиментационная устойчивость
- •4.2. Агрегативная устойчивость и коагуляция
- •Теория устойчивости гидрофобных золей длфо
- •Факторы, определяющие агрегативную устойчивость коллоидных систем
- •4.3. Коагуляция гидрофобных дисперсных систем
- •4.3.1. Коагуляция золей электролитами
- •Концентрационная коагуляция
- •Нейтрализационная коагуляция
- •Явление неправильных рядов
- •4.3.2. Кинетика коагуляции
- •Константа скорости быстрой коагуляции
- •Константа скорости медленной коагуляции
- •5. Свойства дисперсных систем
- •5.1. Оптические свойства дисперсных систем
- •5.1.1. Рассеяние света
- •Теория светорассеяния Рэлея
- •5.1.2. Поглощение света и окраска золей
- •5.1.3. Оптические методы исследования коллоидных растворов
- •5.2. Молекулярно-кинетические свойства дисперсных систем
- •5.2.1. Броуновское движение
- •5.2.2. Диффузия
- •5.2.3. Осмос
- •5.3. Получение дисперсных систем
Лекция 1
1. Предмет коллоидной химии
1.1. Основные понятия и определения
Коллоидная химия (КХ) берет свое начало с изучения коллоидов («коллоид», от др. - греч. k (колла) – клей и εἶδος (айдос) – вид; «клеевидный») или коллоидных растворов (водные растворы золота, серы, кремниевой кислоты и др.) и растворов ВМС (желатин, пектин, казеин).
В настоящее время объектами КХ является широкий диапазон дисперсных систем (ДС) от грубодисперсных до высокодисперсных, в том числе коллоидных (наносистем). Постепенно КХ существенно расширила свои границы и в 60-х годах 19 столетия, из раздела физической химии (ФХ), преобразовалась в самостоятельную науку. Основоположниками отечественной КХ были Антон Владимирович Думанский (основатель и первый зав. кафедрой физической и коллоидной химии ВГТА), Иван Иванович Жуков, Петр Александрович Ребиндер, Борис Владимирович Дерягин, Михаил Михайлович Дубинин и др. ученые.
КХ – устоявшееся традиционное, но не раскрывающее содержания, название науки. В некоторых странах КХ переименована в «Поверхностные явления», «Поверхностные явления и дисперсные системы».
Объектом изучения ФХ являются гомогенные системы (или истинные растворы) и гетерогенные системы, характеризующиеся незначительной поверхностью раздела фаз, которая существенно не влияет на свойства этих систем. КХ химия изучает ДС, имеющие развитую (т.е. значительную) поверхность раздела фаз, поэтому протекающие на ней явления, оказывают значительное влияние на свойства ДС, и мы уже не можем пренебрегать этим влиянием.
Коллоидная химия – наука, изучающая свойства ДС на основании исследования поверхностных явлений, а также физико-химические свойства ВМС и их растворов.
Поверхностные явления (ПЯ) – процессы, вызванные самопроизвольным уменьшением поверхностной энергии и протекающие на поверхности раздела фаз (межфазной границе). К ПЯ относятся: адсорбция, адгезия, смачивание, образование двойного электрического слоя (ДЭС) и др.
Дисперсными системами (ДС) (или дисперсиями) называют гетерогенные, преимущественно микрогетерогенные, системы, состоящие из двух и более фаз, по меньшей мере одна из которых находится в дисперсном (т.е. раздробленном) состоянии.
Например, если гетерогенную систему, состоящую из растительного масла и воды, взболтать, то образуется ДС типа эмульсия (рис. 1):
Р аздробленную
(прерывную) часть ДС 1
называют дисперсной
фазой (ДФ)
(масло), а
нераздробленную (непрерывную) 2
– дисперсионной
(сплошной)
средой (ДСр)
(вода).
аздробленную
(прерывную) часть ДС 1
называют дисперсной
фазой (ДФ)
(масло), а
нераздробленную (непрерывную) 2
– дисперсионной
(сплошной)
средой (ДСр)
(вода).
Необходимым условием образования ДС является нерастворимость или ограниченная растворимость ДФ и ДСр, между которыми образуется граница раздела. Итак, основными признаками объектов КХ являются гетерогенность и дисперсность.
Большинство продуктов и материалов, создаваемых и используемых человеком, являются ДС, поэтому КХ является базовой дисциплиной для специалистов различных технологических специальностей. Примерами ДС в пищевой промышленности являются: сливочное масло, пиво, газированная вода, молоко, хлеб и др.
Д ля
количественной характеристики ДС
применяются три величины:
ля
количественной характеристики ДС
применяются три величины:
1. Характерный
размер частиц
ДФ
![]() ,
,
![]() (для сферических частиц – это диаметр
сферы
(для сферических частиц – это диаметр
сферы
![]() ,
для кубических – ребро куба
).
,
для кубических – ребро куба
).
2. Дисперсность
(раздробленность)
![]() – определяют как отношение суммарной
межфазной поверхности
– определяют как отношение суммарной
межфазной поверхности
![]() ,
,
![]() к суммарному объему частиц ДФ
к суммарному объему частиц ДФ
![]() ,
,
![]() :
:
![]() ,
,
![]() .
(1)
.
(1)
Системы, состоящие из частиц одинакового размера, называют монодисперсными, а из частиц различного размера – полидисперсными. Большинство систем являются полидисперсными. Монодисперсные системы можно приготовить только искусственно, используя специальные приемы.
В общем случае для монодисперсных систем, содержащих частицы произвольной формы
![]() ,
,
где
![]() – коэффициент, зависящий от формы частиц
(для кубических и сферических частиц –
= 6).
– коэффициент, зависящий от формы частиц
(для кубических и сферических частиц –
= 6).
Таким образом, дисперсность – величина, обратная размеру частиц.
3. Удельная
поверхность –
это отношение суммарной поверхности
раздела фаз
,
к суммарной массе частиц ДФ
![]() ,
,
![]()
![]() ,
,
![]() ,
(2)
,
(2)
где
![]() – плотность частиц ДФ,
– плотность частиц ДФ,
![]() .
.
Рассмотрим, как влияет дробление фазы на ее дисперсность.
Пусть форма частиц ДФ – куб, тогда
-
,
,
1
6

60

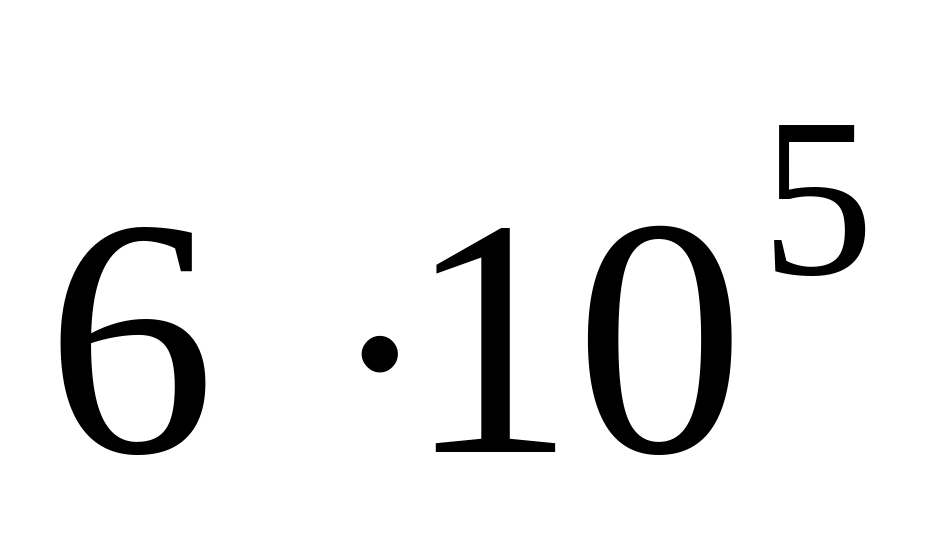
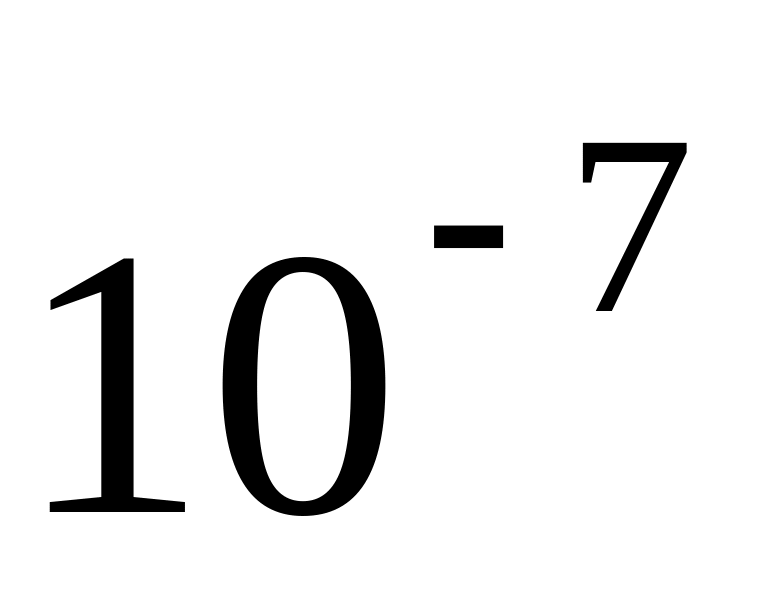



Таким образом, с уменьшением размера частиц ДФ (при дроблении) резко возрастает их дисперсность и удельная поверхность.
