
- •Состав атома
- •Основные положения квантовой механики для описания строения атома
- •Происхождение линейчатых спектров
- •Физический смысл волновой функции
- •Электронные структуры многоэлектронных атомов
- •Основные правила заполнения орбиталей
- •5. Структура периодической системы
- •Периодический закон
- •Типы окислительно-восстановительных реакций.
Периодический закон
«Свойства хим. элементов, а также форма и свойства их соединений находятся в периодической зависимости от заряда ядра атома хим. элемента».
Периодичность свойств хим. элементов с точки зрения строения атомов можно объяснить так: возрастание положительного заряда атомных ядер приводит к возрастанию числа электронов в атоме. Число электронов в атоме равно заряду его ядра. Электроны же располагаются в атоме по электронным слоям. Каждый электронный слой имеет определенное количество электронов. По мере заполнения одного слоя начинает заполняться другой. А поскольку от числа электронов на внешнем слое зависят свойства элементов, то и свойства периодически повторяются.
6. 6)Индивид характеристики атомов: орбитальный радиус. Характер изменения радиусов атомов в периодах и группах для s-, p-, d- элементов. Понятие ЭО и степени окисления элементов. За радиус свободного атома можно принять теоретически рассчитанное положение главного максимума плотности внешних электронных облаков. Это так называемый орбитальный радиус. Орбитальные радиусы атомов с ростом заряда ядра в целом уменьшаются. Поэтому изменение атомных и ионных радиусов в периодической системе носит периодический характер. В периодах атомные и ионные радиусы по мере возрастания заряда ядра уменьшаются. В малых периодах 1-3 наблюдается резкое уменьшение радиусов, так как происходит заполнение у s- и p- элементов внешнего валентного слоя. В больших периодах f- , d- элементов наблюдается плавное изменение радиуса, он уменьшается. d- и f- сжатие. В подгруппах радиус атомов увеличивается с ростом числа квантовых слоёв. С увеличением порядкового номера в периоде орбитальные радиусы атомов уменьшаются, а в группе увеличиваются. ЭО,величина, характеризующая способность атома к поляризации хим связей. Под ЭО понимают относительную способность атомов притягивать электроны при связывании с другими атомами. ЭО атома зависит от многих факторов, в частности от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе. Степень окисления – это + или - число, которое присваивается элементу в соединении. Физ смысла степень окисления не имеет. Лишь в случае идеального ионного соединения степень окисления элементов соответствует заряду их ионов. С увеличением степени окисления реальный заряд на атоме в соединении уменьшается. Знак степени окисления зависит от ЭО образующих соединение элементов. Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице.
8.Природа хим связи.Энергия связи и длина связи.Типы хим связи:ионная, метал,ковалент,водород.
Хим связь явл электролитической силой притяжения между+заряж ядрами и-заряж электронами взаимодейств частиц(атомов,ионов,молекул или любой комбинации из них).
Хим связь между атомами имеет электростат природу. Хим связь образ,если при движении2х или более атомов полная энергия системы(потенц + кинет энергия)пониж.
Энергия связи —это энергия,выдел.при образ связи или необход для разъедин двух связ атомов.Она служит мерой прочности связи:чем больше энергия,тем связь прочнее.
Длина связи-это расст между центр связ атомов.Двойная связь короче одинарной,а тройная -короче двойной.Для связей между атомами углерода,наход в разном сост гибридизации,характерна общая закономерность:с увелич доли s-орбитали в гибридной орбитали уменьш длина связи..
При образ хим.связи происх перераспред в пространстве электрон плотностей,первоначально принадлеж разным атомам.Поскольку наим прочно связ с ядром электроны внеш уровня,то этим электронам принадлеж гл роль в образ хим.связи.Кол-во хим.связей,образован данным атомом в соед,назыв валентностью.Электроны,приним участие в образ хим связи,назыв валентными:у s- и р элементов—это внеш электроны,у d- элементов—внеш s-электр и предпослед d-электроны.На устойчивым явл атом,на внешнем уровне которого сод макс число электронов(2и8).Такой уровень назыв завершенным.Заверш уровни отлич большой прочностью и характерны для атомов благородных газов, поэтому при обычных условиях они наход в сост хим инертного одноатомного газа. Ионная связь- электростатическая сила притяжения между зарядами противополож знака. Эта связь легче всего образ между щелоч метал и галогенами.Вещества с ионным типом связи имеют структуру ионной металлич(кристал)решетки,где ионы противополож знака чередуются в ее узлах.
Ковалентн связь образ между двумя атомами парой электронов,принадлеж обоим атомам.Эта связь локализована,образ между атомами неметал .Различ полярную ковалент связь, когда взаимод атомы разных немет с разнойЭО и ковалент неполяр связь, когда взаимод атомы одинаковых немет с одинаковой ЭО.
Вещества с ковалентн типом связи имеют атомно-молек или молек кристалл решётку, узлы молек решётки образованы молекулами, в кристаллах молекулы связаны засчет молек взаимод.
Алмаз - атомно-молекулярная решетка. Фосфор – атомная.
Металл связь,образ между атомами металлов,объед в кристаллы.Атомы в кристалле несвязанны друг с другом локализованн 2-х электронными связями, т. К. число орбиталей атома металла значительно больше числа электронов на них.Металл связь декализована и в металлах, небольш число электронов одновременно связ большое число атомных ядер, а сами электроны могут перемеща в металле. Водород связи могут образов между атомом водорода, связ с атомом электроотрицат элемента, и электроотриц элементом, имеющим свободную пару электронов(О,F,N). Водород связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода, и отчасти, донорно-акцепторным взаимодействием. Водородная связь может быть межмолекулярной и внутримолекулярной. Связи 0-Н имеют выраженный полярный характер: Водород связь гораздо более слабая, чем ионная или ковалентная, но более сильная, чем межмолекулярное взаимод.Водород связи обуславливают некоторые физ свойства веществ (нр, высокие t кипения).Особенно распр водород связи в молекулах белков,нукл кислот и др биолог важных соединений, обеспечивая им опред пространственную структуру.
9.Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер. Ковалентная связь это когда два атома делятся электронами и держатся вместе.
существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и отрицательного иона водорода H-, называемого гидрид-ионом:
H+ + H- → H2
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо от механизма образования, поэтому называть химическую связь, полученную по донорно-акцепторному механизму, донорно-акцепторной связью не корректно.
В качестве донора электронной пары, кроме гидрид-иона, выступают соединения элементов главных подгрупп V—VII групп периодической системы элементов в низшей степени окисления элемента
H+ + H2O → H3O+
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот.
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония:
NH3 + H+ → NH4+
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений, в состав которого входят аммониевые, оксониевые, фосфониевые, сульфониевые и другие соединения.
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H3+:
H2 + H+ → H3+
Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи
Однако понятие насыщаемости ковалентной связи нельзя рассматривать как абсолютное. Можно себе представить, что при сближении двух молекул Н2 внешнее воздействие преодолеет силы отталкивания и четыре электрона разместятся на двух орбиталях, охватывающих все четыре ядра водорода. Очевидно, два из этих электронов должны будут подняться на орбиталь более высокую, чем они занимали в молекулах Н2, и это будет сопряжено с большой затратой энергии за счет внешних сил
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
10.Направленность ковалентной связи обусловлена определенным пространственным расположением электронных орбиталей взаимодействующих атомов. Так, угол между связями, образованными p-орбиталями атома, должен быть равен примерно 90°. Примером может служить молекула сероводорода H2S (валентный угол составляет 92°).
Однако в большинстве молекул аналогичного с сероводородом состава AB2 (CO2, H2O, BeCl2) валентные углы значительно отличаются от прямого и составляют величину от 104,5° в молекулах H2O до 180° в молекулах CO2 и BeCl2.
Для предсказания величин валентных углов и, следовательно, геометрического строения молекул целесообразно использовать теорию гибридизации атомных орбиталей, разработанную американским ученым ЛайнусомПолингом.
Гибридизация — воображаемый процесс выравнивания (усреднения) атомныхорбиталей по энергии и форме. В результате гибридизации из разных исходных орбиталей («чистых») образуются гибридные орбитали, одинаковые по форме и энергии, но отличающиеся от исходных меньшей симметрией.
Благодаря наличию области с повышенной электронной плотностью гибридные орбитали полнее перекрываются с орбиталями других атомов, в результате чего образуются более прочные химические связи. При этом всегда имеет место s-перекрывание (s-связь).
В зависимости от формы исходных орбиталей различают несколько видов гибридизации, которые обусловливают валентные углы и геометрическую форму молекул. Рассмотрим важнейшие из них.
sp-гибридизация (линейная) означает, что в процессе участвуют 2 исходныхорбитали: одна s и одна p. При этом образуются 2 sp-гибридные орбитали.
sp-гибридные орбитали отталкиваются друг от друга участками с повышенной электронной плотностью и в результате ориентируются в пространстве вдоль прямой. Вследствие этого валентный угол между связями, образованными двумя sp-гибридными орбиталями какого-либо атома, равен 180°.
В молекулах BeH2, BeCl2, BeF2 имеются только s-связи.
В молекуле CO2 атом углерода также находится в состоянии sp-гибридизации. Атом углерода образует с двумя атомами кислорода две s-связи за счет перекрывания sp-гибридных орбиталей, и две p-связи путем перекрывания негибридных p-орбиталей. Так образуются кратные (двойные) связи в молекуле углекислого газа.
В молекуле ацетилена (C2H2) и его гомологов между атомами углерода тройная связь. Каждый атом углерода имеет две sp-гибридные орбитали и две негибридные p-орбитали. Гибридные орбитали образуют две s-связи, перекрываясь с s-орбиталью атома водорода и sp-гибридной орбиталью соседнего атома углерода. Две негибридные p-орбитали каждого атома углерода в результате бокового перекрывания образуют 2 p-связи, расположенные во взаимно перпендикулярных плоскостях.
sp2-гибридизация (плоско-тригональная) означает, что в процессе участвуют 3 исходных орбитали: одна s и две p. При этом образуются 3 sp2-гибридные орбитали:
Оси трех sp2-гибридных (смешанных) орбиталей в атоме располагаются в одной плоскости под углом 120°, т.е. участки орбиталей с повышенной электронной плотностью направлены к вершинам равностороннего треугольника. Таким образом, молекулы (или ионы), центральный атом которых находится в состоянии sp2-гибридизации и образует 3 s-связи, плоские, причем валентные углы равны 120°.
sp2-гибридизация характерна также для углерода в кристаллической решетке графита.
Примером молекулы с sp2-гибридизацией электронныхорбиталей центрального атома и кратными (двойными) связями могут служить этилен и его гомологи. Три гибридных орбитали атома углерода образуют 3 s-связи: одну — с соседним атомом углерода, а две другие — с атомами водорода. Негибридные p-орбитали атомов углерода образуют p-связь в результате бокового перекрывания над плоскостью атомных ядер и под ней.
sp3-гибридизация (тетраэдрическая) означает, что в процессе участвуют 4 исходных орбитали: одна s и три p.При этом образуются 4 sp3-гибридные орбитали, которые отталкиваются друг от друга, ориентируясь в пространстве под углом 109°28' к вершинам правильной тригональной пирамиды — тетраэдра
Тетраэдрическая форма частиц (молекул, ионов) широко распространена в природе. Это все соединения четырехвалентного углерода, в которых нет кратных связей: метан и его гомологи, галогенпроизводные алканов (например, CCl4, CF4, CCl2F2, CHCl3 и т.д.); многие оксоанионы, т.е. анионы кислородсодержащих кислот (SO42–, PO43–, SiO44–, ClO4–, MnO4–, CrO42–); катион аммония NH4+, а также аммиачные комплексы катионов многих металлов, например, [Cu(NH3)4]2+. Условно их состав можно обозначить AB4, где A — центральный атом в состоянии sp3-гибридизации, B — окружающие его частицы.
Есть молекулы, в которых центральный атом окружен не четырьмя, а всего тремя (NH3) или даже двумя (H2O) атомами, однако валентный угол приближается к тетраэдрическому. Поэтому предполагают, что и в этом случае имеет место sp3-гибридизация, но одна из гибридных орбиталей в молекуле аммиака и две в молекуле воды не образуют химической связи, их занимают неподеленные электронные пары.
Валентный угол — угол, образованный направлениями химических связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома. Для простых молекул валентный угол, как и другие геометрические параметры молекулы, можно рассчитать методами квантовой химии. Экспериментально их определяют из значений моментов инерции молекул, полученных путем анализа их вращательных спектров (смотри Инфракрасная спектроскопия, Молекулярные спектры, Микроволновая спектроскопия). Валентный угол сложных молекул определяют методами дифракционного структурного анализа.
12. кратность ковел.связи-количество эллектронныхпар,связывающих два атома или группу атомов.Чем больше кратность,тем меньше длина связи и больше энергия.Для ковал.связи:1)двойная связь; 2)тройная связь.
П-связи обр-я при перекрывании облаков по обе стороны от линии,соединяющей ядра атомов.
Сигма-связи обр-я перекрыванием п,d облаков по котор.они вытянуты всеми 4-мя лепестками располож-ям паралл.в плоскостях.
В результате того,что кратность связи N2 больше,чем F 2 длина связи N2<F2 =>энергия связи N2>F2 => устойчивость N2>F2 (от Каюмовой и Глуховой)
13. полярность ков.св.-это признак ков.связи обусловленный неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
Полярные молекулы являются диполями,т.е. системами,состоящими из двух равных по величине и противоположных по знаку зарядов,находящихся на некотором расстоянии друг от друга.
Неполярные молекулы-это молекулы симметричного строения,центры «тяжести» (+Q) и (-Q) зарядов в отсутствии электрического поля совпадают.Дипольный момент=0.
NF3 – тригонально-пирамидальная, полярная, дипольный момент=0,07 * 10 в степени -29;заряды компенсируются за счет формы молекулы.
( 5 электр.+1*3=8:2=4 ЛЭП,3 СЭП,1 НЭП)
BeСL2 – линейная,неполярная.
(2 электр.+1*2=4:2=2 ЛЭП,2СЭП,0НЭП)
14. Тепловой эффект – кол-во тепла, выделяющееся или поглащающееся при протекании реакции.=Энтальпия – термодинамическое свойство в-ва,указывающее уровень энергии, сохраненной в его молекул. структуре.
Экзотермическая р. – реакция,сопровождающаясяпоглащениемтеплоты,т.е увеличением энтальпии.
Эндо – р.,сопров. Выделение теплоты, энтальпия уменьшается.
Закон Гесса:Тепловой эффект зависит только от вида – природы и состоянии исходных веществ и конечных продуктов, но не зависит от пути процесса.
Энтальпия данной реакции = - 121,89 кДж на моль.(см. значения по таблице и вычисляем по формуле: Сумма продуктов р. – сумма исходных веществ)
15. Энтропия – количественная мера беспорядка.
Энтропия = сумма энтропии продуктов р. – сумма энтропии исход.в-в.
Пр: Энтропия = 205,27 Дж. На К*моль
Качественно предсказать изменение энтропии в х.р. можно с помощью:
С увеличением объема увеличивается энтропия.
1) Не изменяется
2) Увеличивается.
16. Вычисляем на основании следствия из з.Гесса: G= Сумма G прод. реакции - Cумма G исходных в-в.
Оценить:G МЕНЬШЕ НУЛЯ,значит принципиально возможен;
G больше нуля,значит,невозможен.Если H=T*S - ХИМ.РАВНОВЕСИЕ.
Пр:G=- 893,92 кдЖ на моль
17) Влияние температуры на направление реакции:
Согласно уравнению G=H-T*S влияние температуры на направление и G определяется знаком и величиной S.
Повышение температуры приводит к увеличению отрицательного значения G, Уменьшение температуры приводит к уменьшению отриц. значения G.
Если S не изменяется,энергия Гиббса от температуры практически не зависит/
Процессы, протекающие с уменьшением энтальпии и увеличением энтальпии, практически необратимы , значит, G отриц. всегда, какую бы температуру ни применяли.
Вычисление: H = -129.73 кДж на моль; S= - 91,9 Дж на К*МОЛЬ.; G = -102,34.
А при T= 1450 ( G=H-T*S) G= 133125.27 кДЖ НА МОЛЬ.
Возможность данной реакции определяет энтальпийный фактор, т.к. H и S меньше нуля/
18. При рассмотрении вопроса о скорости реакции необходимо различать гомогенные реакции и гетерогенные реакции.
Гомогенной(однородной) называется система, состоящая из одной фазы. Гетерогенной(неоднородной) — система, состоящая из нескольких фаз.
Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы.
Скорость гетерогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции, важнейшими из которых являются следующие: концентрация с, температура t, присутствие катализаторов, а также от некоторых других факторов
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентрации. Порядок реакции – сумма порядков реакции по всем компонентам
Если реакция осуществляется путем последовательно протекающих стадий (не обязательно все из них являются химическими) и одна из этих стадий требует значительно большего времени, чем остальные, то есть идет намного медленнее, то такая стадия называется лимитирующей. Именно эта самая медленная стадия определяет скорость всего процесса. Лимитирующая стадия-всегда самая медленная стадия реакции.
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает.
С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах.
Катализаторы - это вещества, которые повышают скорость химической реакции. Влияние, оказываемое катализаторами на химические реакции, называется катализом.
19. Химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты, называются необратимыми. К ним откосятся как гетерогенные, так и гомогенные реакции. Например, реакции горения простых веществ — фосфора, угля, железа и сложных — метана СН4, сероуглерода СS2. Однако необратимых реакций не так много. Большинство реакций обратимы.
Химические реакции, которые протекают одновременно а двух противоположных направлениях — прямом и обратном — называются обратимыми. Например, 3H2 + N2 ⇌ 2NH3.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
Константа равновесия гетерогенной реакции не зависит от концентраций твердых веществ и определяется лишь температурой. В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются постоянными. Таким образом, константы равновесия гетерогенных реакций могут быть написаны по тем же правилам, что и для гомогенных газовых реакций, но только через парциальные давления или концентрации веществ, находящихся в газообразных состояниях.
СО2+С=2СО
Т.к. система гетерогенная , учитываем только вещества в газовой фазе => K=[СО]/[СО2].
Константа равновесия связана со стандартной энергией Гиббса реакции соотношением:
![]()
Изменение энергии Гиббса позволяет определить направление протекания реакции:
ΔG<0 самопроизвольно протекает в прямом направлении,
Δ G>0 прямая реакция невозможна и протекает в обратном направлении,
Δ G=0 реакция находится в состоянии равновесия, т.е. скорость прямой реакции равна скорости обратной.
Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточные состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
Константа равновесия для гомогенной реакции
При выводе константы равновесия для гомогенных реакций учитывается зависимость химического потенциала каждого компонента от парциального давления его паров. Если же в реакции участвуют жидкие или твердые вещества, не образующие жидких и твердых растворов, то их химический потенциал равен энергии Гиббса, и, следовательно, при постоянной температуре является величиной постоянной так же, как постоянно в этих условиях давление насыщенного пара над чистой фазой данного вещества
Константа равновесия для гетерогенной реакции
С(к) + 2Н2О = СО2 + 2Н2
Как и в случае гомогенной химической реакции, константа гетерогенного равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении. Для реакции пароводяной конверсии углерода константа равновесия имеет вид:
Кр = (рСО2)р (рН2)2р / (рН2О)2р
Стандартная константа равновесия связана со стандартной энергией Гиббса системы соотношением:
20. Изменение температуры:
N2(г)+3H2(г)=2NH3(г)
При нагревании происходит смещение равновесиия влево(в сторону эндотерм. реакции); при охлаждении вправо(в сторону экзотерм.реакции)
Изменение концентраций реагирующих веществ:
FeCl3+3KCNS=Fe(CNS)3+3KCl
при увеличении концентраций исходных веществ (FeCl3, KCNS) равновесие сместится вправо, а при уменьшении конц. тех же веществ-влево.
при увелич. концентрации продуктов реакции (Fe(KCNS)3, KCl) равновесие сместится влево, а при уменьшении конц. тех же веществ-вправо.
Изменение давления:
N2(г)+3H2(г)=2NH3(г)
Увеличение давления смещает равновесие в сторону образования аммиака(уменьшения объема)
При уменьшении давления-в сторону исходных веществ (увеличения объема)
24.Диссоциация слабых электролитов - обратимый процесс. Для диссоциации слабого бинарного электролита KA:
KA Ky+ + Ax-
на основании закона действия масс справедливо соотношение:
![]()
Константу равновесия в данном случае называют константой диссоциации (константой ионизации). Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры и не зависит от концентрации раствора.
Константа диссоциации - важная характеристика слабых электролитов. Чем меньше величина Kд , тем слабее диссоциирует электролит в данном растворителе.
Kд связана с простой зависимостью. Если общую молярную концентрацию электролита в растворе обозначить СКА , то для бинарных электролитов концентрации ионов Ky+ и Ax- будут равны·CKA . Очевидно, что
[Ky+] = [Ax-] = ·CKA ,
[KA] = CKA - ·CKA = CKA·(1- ), тогда
![]()
Для слабых электролитов 0 и (1 - ) 1. Следовательно,
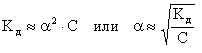
Полученная зависимость является математическим выражением закона разбавления Оствальда (1888 г.): степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.
Сильные электролиты в водном растворе диссоциированы почти полностью. В растворах сильных электролитов отсутствуют, поэтому о недиссоциированных молекулах мы можем говорить только условно, фактически это будут лишь ионные пары Na+Cl~ , а не NaCl , т.е. сблизившиеся противоположно заряженные ионы. По отношению к сильным электролитам мы можем говорить не об истинной,а о кажущейся степени диссоциации.
К сильным электролитам относятся:
1.почти все соли . 2.многие минеральные кислоты :H2SO4 ,HNO3 , HCl, HBr, HI, HMnO4. 3.основания щелочных металлов, например: NaOH и KOH, также Ba(OH)2, Ca(OH)2
Слабые электролиты в водных растворах диссоциируют лишь частично. В растворе имеется большое кол-во недиссоциированных молекул.
К слабым электролитам относятся:
1.Некоторые минеральные кислоты: H2CO3, H2S, HNO2, H2SiO3, HCN и почти все органические кислоты
2.Многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH
3.вода
25. начало такое же как и у 24
Наиболее
важное значение имеет автопротолиз
воды. Константа автопротолиза для воды
обычно называется ионным
произведением воды и
обозначается как ![]() .
Ионное произведение численно равно
произведению равновесных концентраций
ионов гидроксония и гидроксид-анионов.
Обычно используется упрощенная запись:
.
Ионное произведение численно равно
произведению равновесных концентраций
ионов гидроксония и гидроксид-анионов.
Обычно используется упрощенная запись:
![]()
При стандартных условиях ионное произведение воды равно 10−14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.
На основе ионного произведения воды вычисляются водородный показатель и константа гидролиза солей, константа сольватации (произведение растворимости) — важнейшие характеристики равновесных процессов в растворах электролитов.
Если концентрация протонов H2>чем 1×10-7, то раствор будет кислым
pH= 7 –нейтральная
pH<7- кислая
pH>7 – щелочная
26. Равновесие в гетерогенных системах подчиняется закону действия масс и количественно характеризуется константами равновесия, которые называются константой экстракции (/(экстр) для системы жидкость — жидкость и произведением растворимости (ПР) для системы раствор — осадок. Так же как и в случае равновесия в гомогенной системе, равновесие в гетерогенной системе характеризуется термодинамической и концентрационной константами равновесия (реальной и условной)
Растворимость – способность вещества растворяться в том или ином растворителе. Она характеризуется концентрацией насыщенного раствора. Растворимость часто выражают количеством граммов растворяемого вещества в 100 г растворителя. Если раствор содержит растворенного вещества больше, чем это соответствует растворимости при данной температуре, то он называется пересыщенным. Возможность существования пересыщенного раствора объясняется трудностью возникновения центров кристаллизации. В случае растворения твердых или жидких веществ в жидкостях растворимость возрастает с повышением температуры, а для газов – убывает. На растворимость газов большое влияние оказывает давление.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
28.На
конкретных примерах покажите сущность
реакций гидролиза ионных соед по катиону
и по аниону; какая среда(кислая или
щелочная)образуется при их гидролизе?Приведите
константы гидролиза по аниону и катиону
и рассмотрите их связь с константами
ионизации кислоты и основания.
Под гидролизом
понимают реакции обменного разложения
обменного разложения между водой и
соответствующим элементом. Гидролиз
обычно протекает без изменения степени
окисления элементов. Сущность
гидролиза состоит в том, что катион соли
(слабое основание) либо её анион (слабая
кислота) связывают соответственно ионы
OH
или H+
с образованием слабого электролита.
При
гидролизе ионных соединений возможны
4 случая:1) растворы солей образованы
катионами сильных оснований, анионами
сильной кислоты, характер среды
нейтральный.
NaCl↔Na⁺+Cl⁻
Na⁺+HOH≠
Cl⁻+HOH≠
2) растворы
солей образованы катионами сильного
основания и анионами слабой кислоты,
подвергаются гидролизу по аниону.
Характер среды щелочной.
Na₂CO₃↔2Na⁺+CO₃²⁻
Na⁺+HOH≠
(1)
CO₃²⁻+HOH=(HCO)₃⁻
+OH⁻
гидролизу
подвергается лишь часть соли и в растворе
устанавливается равновесие между солью
и образующимся основанием, тогда
константа равновесия для уравнения
(1)( Кравн·[H2O]=
Кгидролиза.)
К=![]() Учитывая
что концентрация ионов равна [OH⁻]=
Учитывая
что концентрация ионов равна [OH⁻]=![]() ,подставим уравнение это равнение в
уравнение для Кравн, получим уравнение
К(гидрол) по аниону.
в разбавленных
растворах концентрация воды величина
постоянная, тогда К(гидролиза)=[HOH].
константа по аниону связана с константой
ионизации кислоты.Чем слабее кислота,
тем в большей степени подвергается
гидролизу её соли.
3) растворы
солей образованы катионами слабого
основания и анионами сильной
кислоты,подвергаются гидролизу по
катиону, характер среды
кислый.
CuCl₂↔Cu²⁺+2Cl⁻
Cl⁻+HOH≠
(2)
Cu²⁺
+ HOH↔
(CuOH)⁺
+H⁺
CuCl+HOH↔CuOH
запишем
Кравн для уравнения (2)
Кр=
,подставим уравнение это равнение в
уравнение для Кравн, получим уравнение
К(гидрол) по аниону.
в разбавленных
растворах концентрация воды величина
постоянная, тогда К(гидролиза)=[HOH].
константа по аниону связана с константой
ионизации кислоты.Чем слабее кислота,
тем в большей степени подвергается
гидролизу её соли.
3) растворы
солей образованы катионами слабого
основания и анионами сильной
кислоты,подвергаются гидролизу по
катиону, характер среды
кислый.
CuCl₂↔Cu²⁺+2Cl⁻
Cl⁻+HOH≠
(2)
Cu²⁺
+ HOH↔
(CuOH)⁺
+H⁺
CuCl+HOH↔CuOH
запишем
Кравн для уравнения (2)
Кр=![]() Учитывая,
что концентрация протона водорода равна
[H⁺]=
Учитывая,
что концентрация протона водорода равна
[H⁺]=![]() и подставим в уравнение для константы
равновесия получим константу гидролиза
по катиону.
Константа по катиону
связана с константой ионизации основания.
Чем слабее основания, тем в большей
степени подвергаются гидролизу
образованные им соли.
степень гидролиза
возрастает с повышением температуры и
уменьшением концентрации соли, т.е. с
разбавление раствора.
и подставим в уравнение для константы
равновесия получим константу гидролиза
по катиону.
Константа по катиону
связана с константой ионизации основания.
Чем слабее основания, тем в большей
степени подвергаются гидролизу
образованные им соли.
степень гидролиза
возрастает с повышением температуры и
уменьшением концентрации соли, т.е. с
разбавление раствора.
4) растворы солей образованы катионами и анионами слабого основания и слабой кислоты. Подверг гидролизу и по катиону и по аниону, характер среды опред относительной силой кислоты и основания. 29. На конкретных примерах (KCl, MnBr₂, K₃PO₄, PCl₅, Al(CO₃)₃) покажите сущность реакций гидролиза ионных и ковалентных соединений. В чем отличие реакций гидролиза ионных и ковалентных соединений? Под гидролизом понимают реакции обменного разложения обменного разложения между водой и соответствующим элементом. Гидролиз обычно протекает без изменения степени окисления элементов. Сущность гидролиза состоит в том, что катион соли (слабое основание) либо её анион (слабая кислота) связывают соответственно ионы OH или H+ с образованием слабого электролита. Гидролиз ковалентных соединений. при этом происходит полное гидролитическое разложение вещества с образованием двух кислот - кислородосодержащей и бескислородной. просто примеры ковалентных соединений. Na₃PO₄↔3Na⁺+PO₄³⁻ Na⁺+HOH≠ l стадия(ионная) PO₄³⁻+HOH↔[HPO₄]²⁻+OH, pH-щелочная l ст(молек) Na₃ PO₄+HOH↔Na₂HPO₄²⁻ + NaOH ll ст(ион) HPO₄²⁻ +HOH↔[H₂PO₄]⁻ + OH⁻ ll ст(мол) Na₂HPO ₄+ HOH↔ NaH₂PO₄⁻ + NaOH AlCl₃↔Al³⁺ +3Cl⁻ Cl⁻+HOH≠ lст(ион) Al³⁺ +HOH ↔ AlOH³⁺ +H⁺ lст(мол) AlCl₃ + HOH ↔ [AlOH]Cl₂+HCl llст(ион) AlOH²⁺ +HOH ↔ [Al(OH)₂]+H⁺ llст(мол) AlOHCl₂+HOH [Al(OH)₂]Cl+HCl среда щелочная. KCl гидролизу не подвергается, т.к. соль образована катионом сильного основания и анионом сильной. Соль образована слабым основанием и сильной кислотой,гидролиз по катиону: MnBr2 + H2O =MnOHBr + HBr Mn(2+) + H2O = MnOH(+) + H(+) Mn(2+) + 2Br(-) + H2O = MnOH(+) +2Br(-) + H(+); pH<7;среда кислая Соль сильного основания (КOH) и слабой кислоты (H3РO4). Гидролиз по аниону. Среда щелочная. K₃PO₄ + H₂O = K₂HPO₄ + KOH PO₄³⁻ + H₂O = HPO₄²⁻ + OH⁻ K₂HPO₄ + H₂O = KH₂PO₄ + KOH HPO₄²⁻ + H₂O = H₂PO₄⁻ +OH⁻ KH₂PO₄ + H₂O = H₃PO₄ + KOH H₂PO₄⁻ +H₂O = H₃PO₄ + OH⁻ PCl5 + 4H2O = 5HCl + H3PO4 HCl + H2O = Сl− + H3O+ H3PO4 + H2O=H2PO4− + H3O+, pH < 7
30.
Реакции протекающие с изменением степени окисления элемента называются –окислительно –восстановительными.
Степень окисления элементов меняется в следствии перехода электронов от одной частиц к другим.
2Na +Cl 2=2NaCL
Na -1e=Na процесс окисления ( Восстановитель)
Cl+1e=Cl процесс восстановления ( Окислитель)
Вещество содержащие элемент у которого в ходе реакции степень окисления понижается
,называется ОКИСЛИТЕЛЕМ
Вещество содержащие элемент у которого в ходе реакции степень окисления повышается ,называется ВОССТАНОВИТЕЛЕМ
ТИПЫ ОВР
