
- •Получение солей
- •Спиртовка.
- •Тестовые вопросы.
- •Взаимодействие металлов с водой
- •Химическая активность металлов в водном растворе
- •Взаимодействие металлов с солями
- •Тест по теме взаимодействия металлов с солями
- •Химические свойства оснований
- •Взаимодействие оснований с кислотными оксидами
- •Взаимодействие оснований с кислотами
- •Взаимодействие оснований с солями
- •Разложение оснований при нагревании
- •Стеклянная трубочка.
- •Спиртовка.
- •Тестовые вопросы.
- •Гидролиз солей
- •I. Ориентировочно-мотивационный этап.
- •II. Операционно-исполнительский этап.
- •Выводы (делают сами учащиеся):
- •III. Рефлексивно-оценочный этап.
- •Растворимость твердых веществ в воде.
- •Контрольный тест
- •Приготовления раствора заданного состава.
- •Тест по теме приготовление раствора заданного состава
- •Зависимость скорости реакций от условий их протекания .
- •9) Спиртовка
- •Сравнение химической активности галогенов
- •Получение и свойства хлороводородной кислоты
Гидролиз солей
Цель урока:
- изучить сущность процесса гидролиза, рассмотреть особенности протекания этого процесса у солей разного состава, начать формирование умений учащихся составлять сокращенные, полные ионные и молекулярные уравнения реакций гидролиза, показать роль этого процесса в природе и жизни человека.
Задачи: 1. Исследовать с помощью индикаторов среду раствора у разных солей, убедиться в том, что соли ведут себя по- разному. 2. Развивать логическое мышление учащихся с помощью ЛСМ (логико-смысловых моделей), переходя при изучении гидролиза солей разных типов последовательно от одной философской категории к другой:

«Алгоритм составления уравнений реакций гидролиза» 3. Воспитывать у учащихся культуру общения при выполнении заданий совместного характера, взаимоконтроля приобретенных знаний и умений, бережное отношение к химическим реактивам.
I. Ориентировочно-мотивационный этап.
Исследование (1,2,3 ряды)
Эксперимент |
1 ряд: AlCl3 + м.о. водный раствор |
2 ряд: Na2CO3+ м.о. водный раствор |
3 ряд: NаCl + м.о. водный раствор |
Результат |
Розовый |
желтый |
Оранжевый |
Вывод |
среда раствора кислотная |
среда раствора щелочная |
среда раствора нейтральная |
Актуализация знаний: как изменяется окраска индикаторов в разных средах? Используйте для ответа таблицу «Изменение окраски индикаторов в разных средах». Постановка проблемы: почему соль состава AlCl3 в водном растворе показывает себя как кислота, а другая соль состава Na2CO3 – как щелочь? Что с ними происходит при растворении в воде? Поиск решения. Объяснения учителя. Соли при попадании в воду гидролизуются, но не все. Чтобы начался гидролиз, соль должна быть образована электролитами, разными по силе.
II. Операционно-исполнительский этап.
«Сущность» ЛСМ №1. Портрет гидролиза.
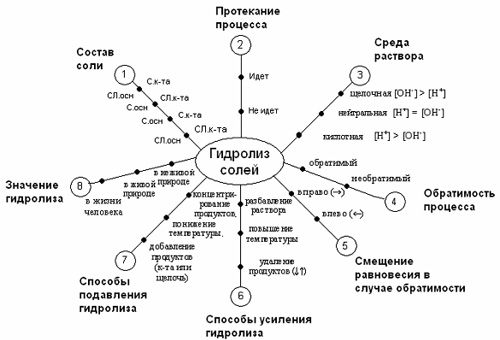
«Особенное» ЛСМ №2. Гидролиз соли, образованной слабым основанием и сильной кислотой.

ЛСМ №3. Гидролиз соли, образованной сильным основанием и слабой кислотой.

ЛСМ №4. Гидролиз соли, образованной сильным основанием и сильной кислотой.

«Единичное» Таблица. Алгоритм составления уравнений реакций гидролиза.
AlCl3 |
Na2CO3 |
NaCl |
|
|
|
Сокращенное ионное уравнение |
Соль гидролизу не подвергается |
|
Al3+ + H2O = (AlOH)2+ + H+ |
CO32- + H2O = HCO3- + OH- |
|
Полное ионное уравнение |
||
Al3+ + 3Cl- + H2O = (AlOH)2+ + H+ +3Cl- |
2Na+ + CO32- + H2O = 2Na+ + HCO3- + OH- |
|
Молекулярное уравнение (I ступень) |
||
AlCl3 + H2O = (AlOH)Cl2 + HCl |
NaCO3 + H2O = NaHCO3 + NaOH |
|
Среда раствора |
||
[H+] > [OH-] кислотная |
[OH-] > [H+] щелочная |
[H+] = [OH-] нейтральная |

 Соль образована катионом слабого
электролита и анионом сильного
электролита.
Соль образована катионом слабого
электролита и анионом сильного
электролита. Соль
образована катионом сильного
электролита и анионом слабого
электролита.
Соль
образована катионом сильного
электролита и анионом слабого
электролита. Соль
образована катионом сильного
электролита и анионом сильного
электролита.
Соль
образована катионом сильного
электролита и анионом сильного
электролита.