
- •Неорганическая химия. Химия элементов
- •Глава 11
- •11.1. Общая характеристика
- •11.1.1. Положение в Периодической системе
- •11.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •11.1.3. Нахождение в природе, изотопный состав
- •11.1.4. Краткие исторические сведения
- •11.2. Простые вещества
- •11.3. Сложные соединения элементов 11-й группы
- •11.3.1. Кислородные соединения
- •11.3.1.1. Оксиды и гидроксиды
- •11.3.1.2. Соли кислородосодержащих кислот, основные соли.
- •11.3.2. Галогениды
- •11.3.2.4. Высшие степени окисления
- •11.3.3. Другие бинарные соединения
- •11.3.3.1. Халькогениды
- •11. 3.3.2. Нитриды и фосфиды
- •11.3.3.3. Карбиды
- •11.3.3.4. Гидриды
- •11.4. Комплексные и металлоорганические соединения элементов 11-й группы
- •11.4.1. Комплексные соединения эi
- •11.4.2. Комплексные соединения эii
- •11.4.3. Комплексные соединения эiii
- •11.4.4. Комплексные соединения эiv и эv
- •11.4.5. Металлоорганические соединения
- •11.5. Технологические процессы в химии элементов 11-й группы
- •11.5.1. Получение меди
- •11.5.2.Получение серебра
- •11.5.3 Получение золота
- •11.5.4. Основные процессы серебряной фотографии
- •11.6. Биологическая роль элементов 11-й группы
11.3.1.2. Соли кислородосодержащих кислот, основные соли.
Элементы 11-й группы образуют большое число солей кислородосодержащих кислот, причем на практике наиболее широко используют производные меди (II) и серебра (I). Однако и соли меди(I) представляют интерес.
С т е п е н ь о к и с л е н и я +1
Для меди (I) из числа солей кислородосодержащих кислот известны лишь сульфат Cu2SO4 сульфит Cu2SO30,5H2O и ацетат CuCH3COO
Сульфат меди(I) можно получить взаимодействием меди с концентрированной серной кислотой при 200°С:
2Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
Среди солей серебра наиболее широко используется нитрат AgNO3 - в неорганическом и органическом синтезе, для серебрения зеркал, как бактерицидное лекарственное средство (ляпис), реагент в аналитической химии (аргентометрия) это бесцветное кристаллическое вещество, хорошо растворимо в воде, спирте ацетонитриле и в других органических растворителях. Нитрат AgNO3 плавится при 2120С, выше 3000С начинает разлагаться
2AgNO3 2Ag + 2NO2 + O2.
Другие соли серебра(I) чаще всего малорастворимы в воде, что позволяет использовать реакции их образования для идентификации анионов фосфорных, мышьяковой и мышьяковистой кислот (см. разд. 15.3.1.4 и 15.3.1.6). Среди плохорастворимых солей следует отметить также: бесцветный термически устойчивый сульфат Ag2SO4, разлагающийся при нагревании до 10000С (Ag2SO4 = 2Ag + SO2 + О2) и образующий в серной кислоте более растворимый гидросульфат AgHSO4; желтоватый карбонат Ag2CO3, подвергающийся разложению уже при 1000С (Ag2CO3 Ag2O + СО2); ацетат AgCH3COO. Плохорастворимыми являются также соли йодной (Ag2H3IO6 и Ag5IO6), йодноватой, бромноватой и хлорноватой кислот.
В отличие от перхлоратов калия, рубидия и цезия, размеры однозарядных катионов которых сходны с Ag+, перхлорат серебра (I) хорошо растворяется в воде. Кроме того, для AgClO4 характерна высокая растворимость в толуоле, глицерине, уксусной кислоте и др.
Соли Ag(I) получают растворением металла или оксида серебра (I) в кислотах (азотной, серной, хлорной) или реакциями обмена, например:
Ag2O + 2НСlО4 = 2AgClO4 + Н2О,
AgNO3 + NaClO3 = AgClO3↓ + NaNO3.
Соли золота (I) с кислородсодержащими кислотами неизвестны.
С т е п е н ь о к и с л е н и я +2
Соли меди (II) известны для большинства кислородсодержащих кислот. В отличие от солей одновалентного серебра, они, как правило, выделяются из растворов в виде кристаллогидратов. Растворы солей сильных кислот из-за гидролиза имеют кислую реакцию среды, так как гидроксид меди (II) является слабым основанием (см. разд. 11.3.1.1).
Безводный сульфат меди (II), часто используемый как исходное вещество при получении других соединений меди, представляет собой бесцветные кристаллы, хорошо растворимые в воде, разлагающиеся при 5500С (2CuSO4 = 2CuO + 2SO2 + О2). На воздухе безводный CuSO4 притягивает влагу и окрашивается в синий цвет вследствие гидратации. Из водных растворов сульфат меди (II) выделяется в виде голубых кристаллов пентагидрата - CuSO45Н2О («медный купорос»).
Медь (II) в CuSO45Н2О имеет КЧ = 6; координационный полиэдр представляет собой искаженный октаэдр. Экваториальную плоскость занимают атомы кислорода четырех молекул Н2О. На оси, перпендикулярной этой плоскости, располагаются бидентатные мостиковые сульфатогруппы. Структуру медного купороса можно представить в виде цепочек, состоящих из чередующихся квадратов [Сu(ОН2)4]2+ и анионов SO42−(XXXIII).
Пятая молекула Н2О не входит в координационную сферу СuII, однако она играет важную структурную роль: она образует две водородные связи с кислородом ионов SO42− из соседних цепочек и одну связь с экваториальной молекулой Н2О (XXXIV).
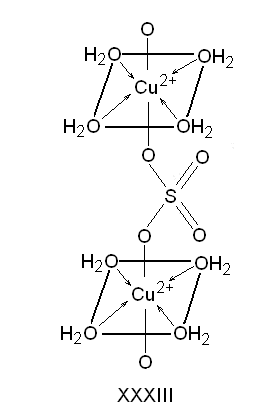

При нагревании CuSO45H2O в первую очередь отщепляются четыре молекулы внутрисферной воды и только при более высокой температуре - пятая молекула Н2О, связанная с сульфат-анионами. Таким образом, не всегда (и совершенно не обязательно) внутрисферная вода удерживается неорганическими соединениями более прочно, чем внешнесферная. То, что в гидратированном сульфате меди (II) связь гидратной воды с SO42− прочнее, чем с Сu2+, неудивительно, если учесть большое сродство H2SO4 и сульфат-ионов к воде.
В соответствии с эффектом Яна-Теллера расстояния Сu-О в экваториальной плоскости CuSO45Н2О более короткие, чем по оси, перпендикулярной к этой плоскости. Это связано и с тем, что ионы SO42− выполняют мостиковую функцию, соединяя два атома меди (II) в аксиальном направлении. Мостиковая группа SO42− также ослабляет аксиальную связь Сu-О.
Таким образом, связь Сu2+—SO42−является менее прочной, чем связь меди (II) с водой. Поэтому неудивительно, что в водных растворах сульфат меди (II), как и подобает солям, диссоциирует на ионы Сu2+aq и SO42−aq. Вместе с тем изучение водных растворов CuSO4 показало, что в них присутствуют сульфатные комплексы, диссоциация которых ([CuSO4] → Cu2+ + SO42−) регулируется константой равновесия (~ 410−3 для 250С). Поэтому сульфат меди (II) можно квалифицировать как комплексное соединение «средней» устойчивости.
Интересно, что дегидратация окрашенного в синий цвет CuSO45Н2О приводит к получению практически бесцветного безводного CuSO4. Разницу в окраске гидратированного и безводного CuSO4 можно объяснить большей жесткостью системы Сu2+—SO42−, нежели Сu2+—ОН2. Действительно, жесткий мало поляризующийся анион SO42−, формируя внутреннюю координационную сферу иона Сu2+ в безводном CuSO4, испытывает лишь незначительную деформацию под действием Сu2+, в отличие от более «мягкой» воды. Еще легче деформируются под действием Сu2+ ион гидроксила [в Сu(ОН)2aq] и молекула NH3 (в комплексе [Cu(NH3)4]2+aq). Оба эти соединения окрашены в синий цвет, интенсивность которого существенно больше, чем у CuSO45Н2О в таких же условиях.
Влияние поляризуемости лигандов, входящих в координационную сферу Сu2+, на интенсивность окраски можно объяснить переносом заряда (с лиганда на центральный ион), сопровождающимся возникновением ковалентной связи медь (II) - лиганд и снятием по этой причине запрета на d—d − электронные переходы.
Сульфат меди (II) в промышленности получают из отходов обработки металлической меди серной кислотой. В лаборатории используют взаимодействие меди с концентрированной серной кислотой (см. разд. 11.2). Выделяющийся при концентрировании и охлаждении раствора кристаллогидрат CuSO45Н2О при нагревании ступенчато обезвоживается, переходя выше 2600С в безводную соль:
CuSO45Н2О CuSO43Н2О + 2Н2О,
CuSO43Н2О CuSO4Н2О + 2Н2О,
CuSO4Н2О CuSO4 + Н2О.
Нитрат меди (II) представляет собой хорошо растворимое синее кристаллическое вещество, плавящееся при 2120С и возгоняющееся в вакууме при 2000С. Известно несколько кристаллогидратов, в том числе Cu(NO3)26Н2О и Cu(NO3)22,5Н2О. Последний подвергается термолизу по схеме
2Cu(NO3)22,5Н2О 2СuО + 4NO2↑ + О2↑ + 5Н2О↑.
Строение нитрата меди(II) существенно зависит от того, гидратирована ли эта соль.
Безводный Cu(NO3)2 (в парах) имеет структуру XXXV.

Как видно, нитрат-ионы в Cu(NO3)2 проявляют бидентатность, однако взаимное расположение групп NO3 в молекуле пока определить не удалось.
Конденсация паров Cu(NO3)2 изменяет структуру безводного нитрата меди: характерная для паров молекулярная структура XXXV в твердом Cu(NO3)2 не сохраняется (XXXVI). Каждая NO3-гpyппa здесь связывает два атома меди, т.е. является бидентатной мостиковой, тогда как в парообразных молекулах NO3-грyппы - бидентатные циклические.
Гидратированный нитрат меди(II) Cu(NO3)22,5Н2О имеет октаэдрическое строение (XXXVII).
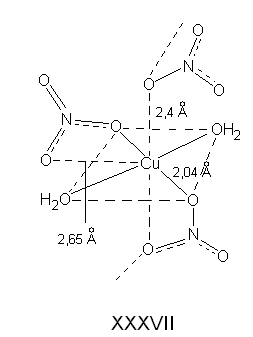
Квадратную экваториальную плоскость составляют атомы кислорода двух молекул Н2О и двух ионов NO3−. Нитрат-ионы NO3− выполняют роль псевдохелатных лигандов. Помимо этого атом кислорода одного из NO3−−ионов образует две связи: одну с собственным атомом меди, другую - с соседним. Таким образом, ион NO3− проявляет тридентатность, причем позиции в вершине октаэдра занимают те атомы кислорода нитрат-ионов, которые осуществляют связь Сu—О—Сu, сшивая тем самым плоские квадраты в каркас. «Полмолекулы» Н2О в Cu(NO3)22,5Н2О не входят в координационную сферу СuII. Эта вода является мостиковой внешнесферной (μ-Н2О), она связывает цепочки [Cu(OH2)2(NO3)2] в единое целое, образуя водородные, связи между ионами NO3 и внутрисферной гидратной водой: [Cu(OH2)2(NO3)2](H―O―H)[Cu(OH2)2(NO3)2].
Гидратированный нитрат меди (II) кристаллизуется из раствора, полученного при взаимодействии Сu с HNO3 (см. разд. 11.2.).
Безводный Cu(NO3)2 нельзя получить обезвоживанием гидрата Cu(NO3)22,5H2O, так как при этом протекает гидролиз и образуется гидроксонитрат Cu2(OH)3(NO3). Синтез безводного Cu(NO3)2 осуществляют действием жидкого N2O4 или смеси N2O4 с этилацетатом (способствующим диссоциации N2O4 → NO+ + NO3−) на металлическую медь или какое-либо другое ее соединение:
Сu + 3N2O4 = [NO]+[Cu(NO3)3]− + 2NO.
Кристаллический промежуточный продукт [NO][Cu(NO3)3] сине-зеленого цвета разлагается при нагревании в вакууме с образованием безводного нитрата меди (II):
NO[Cu(NO3)3] Cu(NO3)2 + 2NO2↑,
который можно очистить сублимацией.
Среди других водорастворимых солей меди (II) большой интерес представляют карбоксилаты - соли карбоновых кислот. Так, одноосновные кислоты жирного ряда образуют с медью (II) формиат, ацетат, пропионат, бутират и т.д., состав которых можно отобразить формулой CuL2, где L− - кислотный остаток одноосновной карбоновой кислоты.
Строение гидрата ацетата меди(II) состава [Сu(СН3СОО)2Н2О]2 (темно-зеленого цвета) имеет кластерный характер и не отличается от такового для ацетата хрома (II) (см. разд. 6.3.1.4). Каждый атом меди (II) находится в центре квадрата, образованного четырьмя атомами кислорода четырех мостиковых карбоксильных групп ацетат-ионов, входящих в состав этого димера. Пятое место в координационной сфере каждого атома меди (II) занято молекулой Н2О, а шестое место занимает кластерная связь Сu-Сu. Так возникает координационный октаэдр (искаженный) вокруг атома меди (II).
Заключение о кластерном характере взаимодействия (связь медь-медь) в ацетате меди (II) основано на том, что расстояние Сu—Сu в димере [Сu(СН3СОО)2Н2О]2 аномально короткое - всего 2,64 Å. Однако оно больше, чем расстояние Сu—Сu в металле (2,56 Å). Действительно, связь Сu—Сu в ацетате меди (II) является одинарной и поэтому слабой: энергия связи металл—металл даже меньше, чем в таком же соединении хрома (II), где она тоже относительно невелика (45 кДж/моль). С этим хорошо согласуется тот факт, что в растворах димерные карбоксилаты практически полностью диссоциируют (исключение составляет монохлорацетат меди (II), сохраняющий димерную структуру и в водном растворе). Существенно меньшие значения магнитного момента димерных карбоксилатов, чем чисто спиновые значения для мономерных соединений меди(II), и диамагнетизм ацетата меди (II) позволяют отнести эти димеры к кластерным соединениям. Диамагнитные свойства димерных карбоксилатов меди (II) можно объяснить только спариванием электронов двух атомов меди(II), имеющих электронную конфигурацию d9. Связь Сu—Сu возникает потому, что два атома меди (II) как бы стягиваются друг к другу мостиковыми карбоксильными группами. Происходит «боковое» перекрывание орбиталей 3dXY . В результате возникает так называемая δ-связь Сu—Сu.
Гидратированный и безводный формиат меди (II), в отличие от димерных ацетатов и других карбоксилатов меди (II) - производных карбоновых кислот с более длинным, чем метальный, углеводородным радикалом, имеют полимерное (а не олигомерное) строение и представляют собой бесконечные образования, в которых бидентатные карбоксильные группы связывают каждый атом меди (II) не с одним соседним атомом меди (II), как в димерном ацетате, а с несколькими. В такой структуре не происходит «придавливания» друг к другу атомов меди (II); они располагаются свободно, не образуют кластерной δ-связи и проявляют магнитные свойства, в полной мере соответствующие 3d9-электронной конфигурации атомов меди (II).
К растворимым солям меди(II) относится также перхлорат, возгоняющийся в вакууме и выделяющийся из растворов в виде Сu(СlO4)26Н2О. В форме кристаллогидратов получены галогенаты Сu(ХО3)2, где X = Сl, Вr, I. Иодат выделен и в безводном состоянии. При 2900С он разлагается:
2Cu(IO3)2 2CuO + 2I2 + 5О2.
Растворимость иодата в воде гораздо меньше, чем хлората и бромата.
Средний карбонат СuСО3 получить в водном растворе не удается из-за интенсивно протекающего гидролиза [аналогия с карбонатами хрома (II) и бериллия (II)]. Негидролизованный СuСО3 (неустойчивый при нормальных условиях) синтезируют из СuО, малахита Сu2(ОН)2СО3 или азурита Сu3(ОН)2(СО3)2 взаимодействием с углекислым газом под давлением 20 кбар и 5000С, например:
Сu2(ОН)2СО3 + СО2 2СuСО3 + Н2О.
Структура СuСО3 является трехмерной (каркасной). Она состоит из квадратно-пирамидальных фрагментов [СuО5], в которых атомы меди (II) окружены атомами кислорода пяти различных групп СО32-.
Среди основных (нерастворимых или малорастворимых) солей меди (II) наиболее известен основной карбонат, образующийся при действии соды на водные растворы растворимых солей меди(II):
2CuSO4 + 2Na2CO3 + Н2О = Cu2(OH)2CO3↓ + 2Na2SO4 + СО2↑.
Не только основные карбонаты, но и продукты гидролиза других солей меди (II) малорастворимы. Они образуются в виде осадка бирюзового или синего цвета, когда к водному раствору средних солей меди (II) (сульфату, нитрату, хлориду, ацетату и др.) постепенно добавляют щелочь или раствор NH3aq.
Иногда считают, что добавление щелочи к растворам солей многозарядных катионов обязательно приводит к образованию гидроксидов. В действительности это не так; нужно создать особые условия, чтобы получить не основную соль, а гидроксид меди (II), например, взаимодействием CuSO4 и NaOH:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4.
С этим процессом конкурирует реакция образования основной соли:
4CuSO4 + 6NaOH = Cu4(OH)6SO4 + 3Na2SO4.
Чтобы процесс образования Cu(OH)2 преобладал, нужно в реакционной среде обеспечить избыток ионов ОН− по сравнению с конкурирующим за связь с катионом Сu2+ анионами SO42− . Проще всего такие условия создать при постепенном добавлении раствора CuSO4 к раствору щелочи, а не наоборот. Обратный порядок сливания реагентов приводит к преобладанию в реакционной среде анионов SO42−, и они входят в состав образующегося осадка основной соли.
Состав основных солей существенно зависит от концентрации реагентов и природы аниона исходной соли. Если анион исходной соли мал по размеру (сульфат, бромид и т. д.), образуются осадки бирюзового цвета, представляющие собой основные соли и принципиально отличающиеся по консистенции и цвету от желеобразного темно-синего осадка Сu(ОН)2. Если же анион исходной соли меди (II) имеет большие размеры и относительно маленький заряд (ацетаты, этилендиаминтетраацетаты), выпадает синий осадок гидроксидного типа. Видимо, большие малозарядные анионы исходной соли меди (II), входя в состав основной соли, способствуют созданию более рыхлой (и сильнее гидратируемой) структуры по сравнению с маленькими анионами типа сульфата или формиата.
Зависимость строения основных солей от природы аниона исходной соли подчеркивает важность структурной роли анионов, входящих в состав гидроксо- сульфатов, нитратов, хлоридов, карбонатов и других основных солей меди. Анион исходной соли в гидроксосоединениях типа Cu(OH)1,5(SO4)0,25 [или Cu4(OH)6SO4] - не примесь, не загрязнение гидроксида анионами исходной соли, адсорбировавшимися на поверхности его частиц, а равноправная структурная составляющая.
Попытки «отмыть» осадок той или иной основной соли от содержащегося в ней аниона исходной соли, неправомерны, так как удалить анион исходной соли из основного сульфата, карбоната и т. д. можно, только разрушив эту основную соль. «Отмыть» же, пропуская ток воды через осадок основной соли в течение нескольких часов, можно лишь ничтожно малые примеси различных катионов и анионов, действительно адсорбированных развитой поверхностью гидроксосоединения, но не конституционно связанные анионы.
Индивидуальность основных солей как химических соединений подтверждается еще и тем, что многие из них существуют в природе в форме «вторичных» минералов, образовавшихся под действием воды и воздуха из минералов «первичных», возникающих при застывании лавы или магмы. Примером медьсодержащих минералов, представляющих собой основные соли, кроме известных малахита (состоит из бесконечного трехмерного массива ионов Сu2+, СО32−, ОН−) и азурита, служат брошантит Cu4(OH)6SO4 и атакамит Сu2(ОН)3Сl.
К числу малорастворимых солей меди (II), кроме основных солей, относятся периодат Сu2HIО6 и его кристаллогидраты, гидраты ортофосфата Сu3(РО4)2nН2О и оксалата СuС2О4Н2О. Последний при термолизе в атмосфере азота восстанавливается:
СuС2О4Н2О Сu + 2СО2↑ + Н2О↑.
Соли серебра (II) малочисленны. Бесцветный фосфат Ag3(PO4)2 хорошо растворим в воде в отличие от желтого плохорастворимого ортофосфата серебра (I).
С т е п е н ь о к и с л е н и я +3
Катионсодержащие соли кислородсодержащих кислот элементов 11-й группы в степени окисления +3 известны лишь для золота. Они легко гидролизуются и восстанавливаются. В кристаллическом виде удалось выделить лишь селенат Au2(SeO4)3 (желтого цвета), который образуется при растворении золота в безводной селеновой кислоте (см. разд. 11.2). Вероятно, стабилизация золота (III) именно в селенате объясняется тем, что селеновая кислота является одной из самых сильных минеральных кислот (H2SeO4 сильнее серной кислоты, см. разд. 16.3.2.1). Очевидно, что селенат-ион SeO42− слабо взаимодействует не только с Н+ (в селеновой кислоте), но и с другими катионами, в том числе с Аu3+, что и способствует стабильности АuIII в его «простой» соли Au2(SeO4)3.
