
- •Неорганическая химия. Химия элементов
- •Глава 11
- •11.1. Общая характеристика
- •11.1.1. Положение в Периодической системе
- •11.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •11.1.3. Нахождение в природе, изотопный состав
- •11.1.4. Краткие исторические сведения
- •11.2. Простые вещества
- •11.3. Сложные соединения элементов 11-й группы
- •11.3.1. Кислородные соединения
- •11.3.1.1. Оксиды и гидроксиды
- •11.3.1.2. Соли кислородосодержащих кислот, основные соли.
- •11.3.2. Галогениды
- •11.3.2.4. Высшие степени окисления
- •11.3.3. Другие бинарные соединения
- •11.3.3.1. Халькогениды
- •11. 3.3.2. Нитриды и фосфиды
- •11.3.3.3. Карбиды
- •11.3.3.4. Гидриды
- •11.4. Комплексные и металлоорганические соединения элементов 11-й группы
- •11.4.1. Комплексные соединения эi
- •11.4.2. Комплексные соединения эii
- •11.4.3. Комплексные соединения эiii
- •11.4.4. Комплексные соединения эiv и эv
- •11.4.5. Металлоорганические соединения
- •11.5. Технологические процессы в химии элементов 11-й группы
- •11.5.1. Получение меди
- •11.5.2.Получение серебра
- •11.5.3 Получение золота
- •11.5.4. Основные процессы серебряной фотографии
- •11.6. Биологическая роль элементов 11-й группы
11.3. Сложные соединения элементов 11-й группы
11.3.1. Кислородные соединения
Как уже упоминалось в разд. 11.1.2, устойчивость соединений, существующих в растворах, зависит от проявляемой элементами 11-й группы степени окисления. Кислородные соединения этих элементов для разных степеней окисления различаются также по устойчивости.
11.3.1.1. Оксиды и гидроксиды
С т е п е н ь о к и с л е н и я +1
Оксиды Э2О представляют собой кристаллические вещества, имеющие различные устойчивость и окраску (Сu2О - красную, Ag2O - коричневую, Аu2О - серо-фиолетовую).
В элементарной ячейке оксида меди (I) атом кислорода тетраэдрически окружен четырьмя атомами меди, каждый из которых образует две линейные связи с атомами кислорода (рис. 11.1).
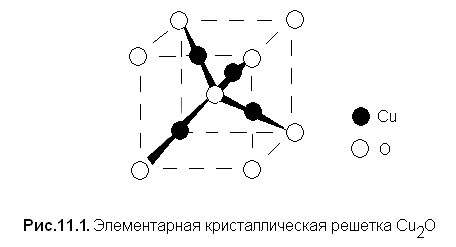
Оксид серебра (I) изоструктурен оксиду меди, но менее устойчив - разлагается при температуре >3000С, в то время как Сu2О плавится без разложения при 12360С (термолиз имеет место выше 18000С). Оксид Аu2О еще менее устойчив (его распад на простые вещества происходит уже при 2000С).
Таким образом, термическая устойчивость оксидов Э2О понижается от меди к золоту.
В воде оксиды Э2О почти нерастворимы и присоединяют Н2О с образованием гидроксидов ЭОН в очень малой степени. Тем не менее при суспензировании Ag2O в воде повышается рН среды, т. е. в раствор переходят ионы Ag+ и ОН−
Ag2O + Н2О 2Ag+ + 2OH−.
Используя эту реакцию, в препаративной химии получают растворимые гидроксиды низкозарядных катионов из их галогенидов. Например, чтобы получить RbOH из RbCl, готовят суспензию Ag2O и смешивают ее с водным раствором RbCl. Происходит осаждение AgCl, а в растворе остается практически чистый гидроксид рубидия:
2RbCl + Ag2O + H2O = 2RbOH + 2AgCl↓.
Медь (I) и серебро (I) можно перевести из оксидов Э2О в раствор за счет комплексообразования, например:
Э2О + 4NH3 + Н2О = 2[Э(NH3)2]OH,
Cu2O + 4НСlКОНЦ = 2H[CuCl2] + Н2О,
Ag2O + 2NaOHKOНЦ + Н2О = 2Na[Ag(OH)2].
Разбавленные кислоты растворяют Ag2O, если с анионами этой кислоты катионы Ag+ не образуют осадка:
Ag2O + 2HNO3 = 2AgNO3 + Н2О.
Соли меди(I), получающиеся при действии кислот на Сu2О, диспропорционируют:
Сu2О + H2SO4 = Cu↓ + CuSO4 +Н2О.
Если для этой реакции использовать концентрированную H2SO4 и нагревать раствор, металлическая медь, образовавшаяся в результате диспропорционирования, растворяется:
Сu2О + 3H2SO4 = 2CuSO4 + SO2↑ + 3H2O.
Соединения серебра (I) легко восстанавливаются до металла, чем пользуются для серебрения поверхностей, например, при получении зеркал и елочных украшений («реакция серебряного зеркала»).
К водному раствору нитрата серебра (I) добавляют по каплям концентрированный водный раствор аммиака до растворения первоначально выделяющегося осадка Ag2O. Суммарная реакция имеет вид
AgNO3 + 3NH3 + Н2О = [Ag(NH3)2]OH + NH4NO3.
Растворы аммиачного комплекса серебра нельзя долго хранить, так как при его стоянии возможно образование чрезвычайно взрывчатого нитрида cepeбpa (I) Ag3N (см. разд. 11.3.3.2).
В качестве восстановителя используют органические вещества - формальдегид, глюкозу. Процесс серебрения проводят при слабом нагревании (50 – 600С), например, на водяной бане. Очень скоро внутренняя поверхность стеклянного сосуда, содержащего реакционную смесь, покрывается блестящим налетом серебра в результате протекания следующих реакций:
4|Ag(NH3)2]OH + Н2С=О + 4Н2О = 4Ag↓+ (NH4)2CO3 + 6NH3Н2О.
2[Ag(NH3)2]OH + C6HI2O6 + 2Н2О = Ag↓+ C6H11O7NH4 + 3NH3H2O.
Если в качестве восстановителя используют глюкозу, то к ее раствору в воде добавляют небольшое количество концентрированной азотной кислоты (с последующим непродолжительным кипячением). Это необходимо для быстрого переведения циклической формы глюкозы в открытую, в которой есть активная альдегидная группа, проявляющая восстановительные свойства по отношению к серебру (I). Приготовление раствора глюкозы завершается охлаждением и разбавлением равным объемом этанола, что способствует лучшей адгезии серебра на стеклянной поверхности.
К сожалению, на стекле в виде зеркала оседает лишь несколько процентов восстановленного серебра, остальное остается в растворе во взвешенном состоянии подлежит регенерации. Надо отметить, что для успешного проведения реакции серебряного зеркала необходимо весьма тщательно очищать стеклянные предметы, подлежащие серебрению.
Оксид меди (I) можно получить нагреванием меди при ограниченном доступе кислорода (4Сu + О2 = 2Сu2О), а также восстановлением солей СuII в щелочной среде глюкозой или гидразином:
2CuSO4
+ 5NaOH
+ С6Н12О6
![]() Cu2O↓
+ C6H11O7Na
+ 2Na2SO4
+ 3Н2О,
Cu2O↓
+ C6H11O7Na
+ 2Na2SO4
+ 3Н2О,
4CuSO4 + 8NaOH + N2H4 2Cu2O↓ + N2 + 4Na2SO4 + 6H2O.
Фактически на первой стадии этих реакций при взаимодействии растворов солей меди (II) и щелочи образуется Сu(ОН)2, т.е.
2Сu(ОН)2 + С6Н12О6 + NaOH → Cu2O↓ + C6H11O7Na + 2Na2SO4 + 3Н2О,
4Cu(OH)2
+ N2H4
![]() 2Cu2O↓
+ N2
+ 6H2O.
2Cu2O↓
+ N2
+ 6H2O.
Получение Cu2O путем восстановления меди (II) гидразином можно проводить и в кислой среде, избегая избытка гидразина, чтобы исключить образование металлической меди:
4Сu(СН3СОО)2 + N2H4 + 2Н2О = 2Cu2O↓ + N2↑ + 8СН3СООН.
Оксид меди(I) синтезируют также нагреванием эквимольных количеств СuО и Сu в вакуумированном кварцевом сосуде при 10000С:
СuО + Сu Сu2О.
Оксид серебра (I) выпадает в осадок при взаимодействии растворов нитрата серебра (I) и щелочи:
2AgNO3 + 2NaOH = 2NaNO3 + Ag2O↓ + H2O.
Он образуется как промежуточный продукт также в ходе реакции «серебряного зеркала».
Оксид золота (I) получается при осторожном (до 2000С) нагревании гидроксида золота (I):
2АuОН Au2O↓ + Н2О.
Элементы 11-й группы в степени окисления +1, кроме бинарных оксидов Э2О, образуют с тяжелыми ЩЭ сложные оксиды состава (ЩЭ)ЭО и (ЩЭ)3ЭО2. Для меди (I) и серебра (I) получены также ЭМIIIО2, где MIII = Al, Ga, Cr, Fe, Co.
Гидроксиды ЭОН - неустойчивые, нерастворимые в воде соединения, проявляющие основные свойства. За счет комплексообразования гидроксиды способны растворяться в концентрированных растворах щелочей и в водных растворах аммиака.
Гидроксид СuОН (желтого цвета) является промежуточным продуктом при синтезе Сu2О восстановлением производных меди (II). Его можно получить также действием щелочи на раствор комплекса Н[СuСl2]:
Н[СuСl2] + 2NaOH = CuOH↓ + 2NaCl + Н2О.
Гидроксид cepeбpa (I) является сильным основанием, сходным в этом отношении с NaOH и КОН (близкие ионные радиусы и эффективный заряд катионов), что подтверждается отсутствием гидролиза солей, образованных серебром (I) с анионами сильных кислот, например, рН водного раствора нитрата серебра(I) при комнатной температуре равен ~7.
Гидроксид AgOH в твердом состоянии (белого цвета) удалось синтезировать взаимодействием AgNO3 и КОН только при низкой температуре (-500С).
Темно-фиолетовый гидроксид АuОН (или Аu2ОxН2О) можно получить при слабом нагревании суспензии AuBr в растворе КОН.
С т е п е н ь о к и с л е н и я +2
Только в случае меди оксид стехиометрического состава ЭО содержит элемент-металл в степени окисления +2, хотя известны оксиды серебра и золота такого же состава.
Оксид меди (II) СuО - черное кристаллическое вещество, отщепляющее кислород при температуре выше 11000С:
4СuО 2Сu2О + О2↑.
Под давлением кислорода СuО плавится выше 13350С, в атмосфере водорода восстанавливается уже при 2500С:
СuО + Н2 Сu + Н2О.
Восстановление до металла можно провести и при нагревании с углеродом (углем) или в токе СО:
2CuO + С 2Cu + СО2, СuО + СО Сu + СО2.
Атом меди (II) в кристаллическом СuО образует четыре копланарные (лежащие в одной плоскости) связи с кислородом. Валентные углы О—Сu—О составляют 84,50 (два) и 95,50 (два), так что обычный для меди (II) экваториальный квадрат сильно искажен. Связи Сu—О, соединяющие медь с атомами кислорода, лежащими над и под экваториальной плоскостью, намного длиннее (2,78 Å), чем экваториальные связи (1,96 Å) в плоском четырехугольнике. Поэтому об октаэдрической координации атома меди (II) в СuО можно говорить лишь с большой натяжкой (к тому же аксиальное направление О—Сu—О отклонено на 170 от нормали к плоскости четырехугольника). Таким образом, у меди (II) в СuО - плоский координационный полиэдр, а координация кислорода является тетраэдрической.
Оксид меди (II) не взаимодействует с водой, но легко растворяется в кислотах и водном растворе аммиака:
СuО + 2НСl = СuСl2 + Н2О,
СuО + 4NH3 + Н2О = [Cu(NH3)4](OH)2.
При сплавлении со щелочами СuО образует купраты (II) различного состава: (ЩЭ)2СuO2, (ЩЗЭ)2СuO3, (ЩЗЭ)СuО2, представляющие собой или сложные оксиды, или оксосоли.
Оксид меди (II) обычно получают прокаливанием основного карбоната, нагреванием металла в кислороде или обжигом сульфидов:
(СuОН)2СО3
![]() 2СuО
+ СО2
+ Н2О,
2СuО
+ СО2
+ Н2О,
2Сu
+ О2
![]() 2СuО,
2СuО,
Cu2S + 2О2 2CuO + SO2.
В лаборатории СuО можно получить путем термолиза кристаллогидрата нитрата меди:
2Cu(NO3)23H2O = 2CuO + 4NO2↑ + O2↑ + 6H2O
или взаимодействием горячих растворов щелочи и соли меди(II), например сульфата:
CuSO4 + 2NaOH = CuO↓ + Na2SO4 + H2O.
При этом сначала выпадает бирюзовый осадок основного сульфата меди, который чернеет вследствие перехода в оксид СuО.
Гидроксид меди (II) Сu(ОН)2 - неустойчивое, плохо растворимое в воде вещество синего цвета, проявляющее амфотерные свойства с преобладанием основных (KbII = 10−7, КaI = 10−10, KaII = 10−13).
Соединению Сu(ОН)2 по данным порошковой рентгенографии соответствует структура, аналогичная γ-FeOOH (см. разд. 8-10.3.1.2), но модифицированная таким образом, что атомы Сu2+ имеют окружение в виде искаженного октаэдра (4 иона ОН− на расстоянии от меди (II), равном 1,94 Å, и два - на расстоянии 2,63 Å). Предполагают, что в этой структуре нет водородных связей.
Гидроксид меди (II) легко растворяется в кислотах, например:
Сu(ОН)2 + 2НСl = CuCl2 + 2Н2О,
но не претерпевает видимых изменений под действием растворов щелочей «средней» концентрации. В концентрированных же щелочах гидроксид меди (II) растворяется с образованием сначала фиолетового коллоидного раствора Сu(ОН)2, а затем ярко-синего раствора купрата (II), представляющего собой гидроксокомплекс:
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4].
При действии Ва(ОН)2 получено КС состава Ba2[Cu(OH)6], в котором атом меди находится в искаженном октаэдрическом окружении, в отличие от тетраэдрического окружения в тетрагидроксокомплексе натрия.
Образование купратов (II), представляющих собой гидроксокомплексы, свидетельствует о проявлении гидроксидом меди (II) амфотерности, хотя и слабо выраженной. О том же говорит и образование при сплавлении СuО со щелочами твердофазных купратов (см. выше).
Гидроксид Сu(ОН)2 взаимодействует с водным раствором аммиака с образованием темно-синего раствора аммиаката:
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2.
Гидроксид меди (II) легко отщепляет воду, превращаясь в оксид, поэтому его получают в условиях, препятствующих обезвоживанию, например, добавляя глицерин:
CuSO4
+ 2NaOH
![]() Cu(OH)2↓
+ Na2SO4.
Cu(OH)2↓
+ Na2SO4.
Важно учитывать, что при постепенном добавлении к раствору соли меди стехиометрического количества щелочи, необходимого для осаждения гидроксида меди (II), в осадок переходит не гидроксид меди, а основная соль, состав которой зависит от условий осаждения (см. разд. 11.3.1.2.). Основные соли отличаются от гидроксида меди по внешнему виду, например, основной сульфат Cu4(OH)6SO4 имеет вид плотного, быстро оседающего осадка бирюзового цвета, в отличие от слизистого, рыхлого темно-синего гидроксида меди (II). Получить гидроксид определенного состава непросто: необходимо обеспечить сохранение в растворе во время осаждения гидроксида преобладание концентрации ионов-осадителей ОН− над концентрацией аниона исходной соли, стремящейся сформировать основную соль.
Кристаллический Сu(ОН)2 синтезируют специальными методами, например действием водного раствора NaOH на основной сульфат Cu4(OH)6SO4 или путем медленного удаления аммиака из [Cu(NH3)4](OH)2 в вакууме (над H2SO4).
Оксид AgO - черные, плохо растворимые в воде кристаллы, разлагающиеся при 1000С на простые вещества. Диамагнетизм AgO доказывает, что оксид содержит не двухвалентное серебро, а атомы серебра в степени окисления +1 и +3, т. е. это смешанно-валентный оксид AgIAgIIIO2. В его структуре, в отличие от СuО (где все атомы Сu окружены четырьмя лежащими в одной плоскости атомами кислорода), атом серебра(I) координирует два коллинеарно расположенных атома кислорода (короткое расстояние AgI-О равно 2,18 Å), в то время как два других атома кислорода сильно искаженной плоскоквадратной координационной группы находятся от атома серебра (I) на расстоянии 2,66 Å. Атом серебра (III) окружен четырьмя лежащими в одной плоскости соседними атомами кислорода, расположенными на расстоянии 2,05 Å. Химическими препаративными методами подтверждено, что AgO - смешанный оксид, и его нельзя представить, в частности, как пероксидное соединение AgI-О-О-AgI.
Оксид AgO является очень сильным окислителем. Так, он взаимодействует с разбавленными кислотами с выделением кислорода:
4AgO + 2H2SO4 = 2Ag2SO4 + О2↑ + 2Н2О.
Концентрированные кислоты реагируют с AgO с образованием растворов, содержащих ионы Ag2+. Так, при действии 100%-й Н3РО4 на AgO получается, хорошо растворимая в воде соль Ag3(PO4)2.
Синтез AgO можно осуществить различными способами. В лаборатории для этой цели используют нагревание при 900С растворов нитрата серебра и щелочи в присутствии пероксодисульфата калия:
2AgNO3 + 4KOH + K2S2O8 = 2AgO↓ + 2K2SO4 + 2KNO3 + 2H2O.
AgO получают также взаимодействием кислорода, содержащего озон, с металлическим серебром при нагревании:
Ag + О3 = AgO + О2.
Можно использовать и гидролиз при нагревании оксонитрата Ag7O8NO3, образующегося при анодном окислении раствора AgNO3:
Ag7O8NO3
![]() 6AgO↓ + O2↑
+ AgNO3.
6AgO↓ + O2↑
+ AgNO3.
Есть сообщения о существовании очень неустойчивого оксида АuО - вещества темно-зеленого цвета, имеющего, видимо, строение, аналогичное AgO, т. е. AuIAuIIIO2.
Гидроксиды серебра (II) и золота (II) неизвестны.
С т е п е н ь о к и с л е н и я +3
Оксиды Э2О3 - твердые вещества гранатово-красного (Сu2О3), черного (Ag2O3) и коричневого (Аu2О3) цвета. Наиболее устойчивым является полуторный оксид золота, но и он разлагается на Аu и О2 при нагревании до температуры > 1600С. Оксид серебра (III) устойчив лишь ниже −200С. Таким образом, устойчивость оксидов Э2О3 уменьшается от золота к меди, т. е. здесь проявляется тенденция, противоположная той, которая наблюдается у кислородных соединений элементов группы меди в степени окисления + 1 и +2.
Производные трехвалентных меди и серебра являются сильными окислителями, например, окисляют соляную кислоту:
Сu2О3 + 6НСl = 2CuCl2 + Сl2↑ + 3Н2О.
Сu2О3 получают действием пероксодисульфата на гидроксид меди (II) в щелочной среде:
2Сu(ОН)2 + K2S2O8 + 2КОН = 2K2SO4 + Cu2O3↓ + 3Н2О.
Оксид Cu2O3 с растворами щелочей образует купраты (III), представляющие собой гидроксокомплексы, например К[Сu(ОН)4] - красное кристаллическое вещество, устойчивое до 200С. Этот гидроксокомплекс может быть получен действием гипохлоритов или гипобромитов на гидроксид меди (II) в щелочной среде:
2Сu(ОН)2 + КОСl + 2КОН + Н2О = 2K[Cu(OH)4] + KCl.
Известны и получаемые твердофазным синтезом купраты (III):
диамагнитные (ЩЭ)СuО2, где ЩЭ = Na - Cs, Ba(CuO2)2 и (ЩЭ)6[Сu2О6], где ЩЭ = Li, Na, изоструктурные аналогичным соединениям золота(III).
Структура купратов стала объектом пристального внимания исследователей в связи с обнаружением (Дж.Г. Беднорц и К.А. Мюллер, 1986 г.) высокотемпературной сверхпроводимости (ВТСП) у перовскитоподобных нестехиометрических сложных оксидов, прежде всего состава YBa2Cu3O7−X, содержащих медь в степени окисления больше +2.
Идеализированная структура перовскита AIIBIVO3 (cм. разд. 4.3.1.1) характеризуется кубической симметрией, причем атомы АII имеют КЧ по кислороду, равное 12, а атомы BIV - КЧ = 6. Однако даже в природном минерале перовските CaTiO3 такая структура претерпевает искажение. Понятно, что переход к более сложной оксидной системе невозможен без серьезных нарушений структуры перовскита, вплоть до изменения КЧ атомов некоторых элементов-металлов, составляющих оксидную систему. Сложность строения YBa2Cu3O7−X состоит не только в присутствии в этом соединении трех разных типов катионов, но и в существенном кислородном дефиците: стехиометрия этого сложного оксида соответствует формуле АВО2,3 вместо АВО3 в перовските (Y3+ и Ва2+ занимают позиции А, Сu - позиции В). Кислородные вакансии упорядочены, что также вносит изменения в структуру перовскита. Наличие кислородных вакансий понижает КЧ катионов РЗЭ3+ от 12 до 8, КЧ катионов Ва2+ - от 12 до 10, КЧ катионов Сu2+ - от 6 до 4. Изучение структуры различного состава купратов в трехкомпонентных оксидных системах актуально при обсуждении амфотерности меди (II).
Теория высокотемпературной сверхпроводимости керамических материалов еще не создана. Однако полагают, что обязательным условием возникновения сверхпроводимости является диспропорционирование СuII СuI + СuIII (для «безмедных» ВТСП - это BiIV BiIII + BiV). По-видимому, диспропорционирование имеет место, когда связь Сu-О (соответственно Bi-О) носит существенно ковалентный характер, а этому способствует усиление электроположительного характера иона А в соединении АВО3. Купраты типа La2CuIIO4 не являются ВТСП. Они проявляют металлическую проводимость при обычных условиях, а при низкой температуре становятся полупроводниками. Так как среди А3+ нет более электроположительного катиона, чем La3+, положение исправляют, вводя в купрат катионы Ва2+, Sr2+, Ca2+. Такое замещение приводит к сокращению расстояний Сu-О, что можно оценивать как следствие усиления ковалентности этой связи. Легирование стронцием дает в случае [La3+, (ЩЗЭ)2+]2СuО4 самое высокое значение критического тока (TC до 91 К), поскольку в этом смешанном оксиде расстояния Сu-О самые короткие.
Включение больших малозаряженных катионов в купраты РЗЭ способствует эффекту ВТСП благодаря стабилизации такими катионами высоких степеней окисления элементов-металлов в оксидных материалах.
Рост в купратах ковалентности связи Сu-О в присутствии Ва2+ и других больших электроположительных катионов может рассматриваться как следствие дополнительного эффекта поляризации; здесь эта модель работает очень хорошо.
Структура YBa2Cu3O7−X схематически изображена на рис. 11.2.
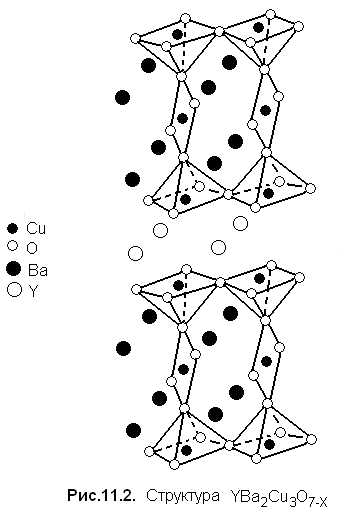
Важное свойство высокотемпературных сверхпроводников - анизотропию - хорошо иллюстрирует рисунок: видны слои, составленные из медькислородных квадратов [СuО4] и пирамид [CuO5]. Хотя на первый взгляд между структурами YBa2Cu3O7−X и перовскита мало общего, в действительности первая выводится из второй путем упорядоченного удаления части атомов кислорода и замещением катионов А3+ на смесь Y3+ и Ва2+.
Одним из результатов исследований купратов явилось признание факта повышения ковалентности связи Сu-О при введении в сложнооксидную систему электроположительных катионов, фиксация рентгеноструктурным и нейтронографическим методами локальных структурных фрагментов [CuO5], [CuO4] - все это можно интерпретировать как доказательство проявления медью (II) и (III) амфотерных свойств.
Таким образом, и в водных растворах, и в твердых оксидных системах для меди (II) и (III) характерна «умеренная» амфотерность.
Оксид Ag2O3 образуется при анодном окислении AgClO4, а также при действии озона на серебро в кислой среде:
2Ag + О3 = Ag2O3.
Оксид Au2O3 получают, нагревая при 1000С оксогидроксид АuО(ОН), который образуется при обезвоживании Аu(ОН)3.
Гидроксид золота (III) Аu(ОН)3 - коричневое вещество, мало растворимое в воде, проявляющее амфотерные свойства с преобладанием кислотных (KaI = 10−12, KaII = 10−14, KaIII = 10−16). Он растворим в сильных кислотах с образованием солей, содержащих катионы Аu3+, и в сильных щелочах с образованием ауратов (III), содержащих золото (III) в анионе:
Аu(ОН)3 + 3НСl = АuСl3 + 3Н2О, Аu(ОН)3 + КОН = К[Аu(ОН)4].
Методами твердофазного синтеза, например золота с селитрой, можно получать аураты (III) состава (ЩЭ)AuO2:
Au + NaNO3 = NaAuO2 + NO
Для Li и Na синтезированы аураты (III) состава (ЩЭ)6[Au2O6],где анион представляет собой два квадрата с общей стороной (расстояние Au―ОКОНЦ = 2,12Å, Au―ОМОСТ = 2,17 Å).
Гидроксиды меди (III) и серебра (III) неизвестны.
