
- •Неорганическая химия. Химия элементов
- •Глава 11
- •11.1. Общая характеристика
- •11.1.1. Положение в Периодической системе
- •11.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •11.1.3. Нахождение в природе, изотопный состав
- •11.1.4. Краткие исторические сведения
- •11.2. Простые вещества
- •11.3. Сложные соединения элементов 11-й группы
- •11.3.1. Кислородные соединения
- •11.3.1.1. Оксиды и гидроксиды
- •11.3.1.2. Соли кислородосодержащих кислот, основные соли.
- •11.3.2. Галогениды
- •11.3.2.4. Высшие степени окисления
- •11.3.3. Другие бинарные соединения
- •11.3.3.1. Халькогениды
- •11. 3.3.2. Нитриды и фосфиды
- •11.3.3.3. Карбиды
- •11.3.3.4. Гидриды
- •11.4. Комплексные и металлоорганические соединения элементов 11-й группы
- •11.4.1. Комплексные соединения эi
- •11.4.2. Комплексные соединения эii
- •11.4.3. Комплексные соединения эiii
- •11.4.4. Комплексные соединения эiv и эv
- •11.4.5. Металлоорганические соединения
- •11.5. Технологические процессы в химии элементов 11-й группы
- •11.5.1. Получение меди
- •11.5.2.Получение серебра
- •11.5.3 Получение золота
- •11.5.4. Основные процессы серебряной фотографии
- •11.6. Биологическая роль элементов 11-й группы
11.4.3. Комплексные соединения эiii
Медь (III) является сильным комплексообразователем, что легко объяснить, если учесть высокий эффективный заряд на катионе Сu3+ и удобную для образования квадратных низкоспиновых комплексов электронную конфигурацию 3d6 (катионы Сu3+ и Ni2+ изоэлектронны). Однако стабилизация валентного состояния СuIII происходит только тогда, когда лиганд способен противостоять сильному окислительному действию меди. Как всегда в таких случаях, преимущество имеют кислород и фтор, а иногда азотдонорные лиганды. Например, описаны диамагнитные комплексы состава Na5[Cu(HIO6)2]3,8H2O, Na5[Cu(H2TeO6)2]11,5H2O, Cs[CuF4], содержащие квадратный анионный комплекс, и парамагнитный фторид Cs3[CuF6], содержащий анионный комплекс октаэдрического строения. Периодатные и теллуратные соединения СuIII проявляют сильное окислительное действие в кислой среде, выделяя кислород и переходя в производные СuII.
В структуре комплексов меди (III) с периодатными и теллуратными лигандами имеются две октаэдрические группы (НIO6 или Н2ТеO6), связанные друг с другом посредством атома меди (по две связи Сu—О с каждым октаэдром). Пятая связь образуется с молекулой воды, находящейся в вершине тетрагональной пирамиды — координационного полиэдра меди(III).
Серебро (III), как и медь (III), стабилизируется в КС с лигандами, способными противостоять сильному окислительному действию AgIII. Это диамагнитные комплексы K5[Ag(HIO6)2]10Н2О, Na5[Ag(H2TeO6)2]18Н2О, структура которых, видимо, аналогична структуре таких же по стехиометрии соединений СuIII, и сильно гигроскопичные K[AgF4] и Cs[AgF4] с квадратной конфигурацией аниона.
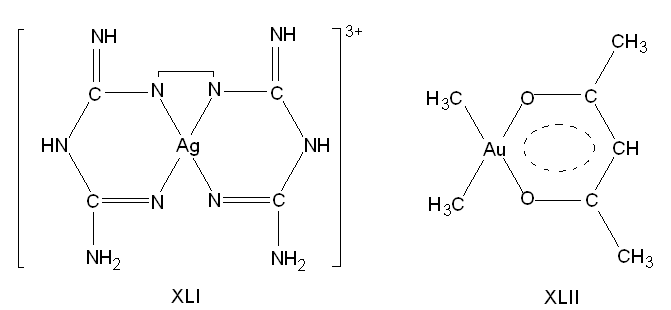
Известны и комплексные соединения AgIII с N-донорными лигандами, например образующийся в водных растворах в присутствии пероксодисульфата калия комплекс с этилендибигуанидином (XLI).
Комплексы золота (III) широко используются на практике, так как они более устойчивы в термическом и окислительно-восстановительном отношении, чем простые соли, которые к тому же сильно гидролизуются в растворе.
Самым доступным КС золота (III) является золотохлористоводородная (тетрахлорозолотая) кислота Н[АuСl4]. Известны ее бромидный и иодидный аналоги. Выделены светло-желтые кристаллы H[AuCl4]4Н2О, разлагающиеся выше 1200С на хлорид золота (III), хлороводород и воду. Получены соли этой кислоты (ЩЭ)[АuСl4], причем соединение цезия мало растворимо в воде. Анион этих комплексов (как и бромидных производных) представляет собой квадрат. Известны также комплексные фториды (ЩЭ)[AuF4], сульфаты (ЩЭ)[Au(SO4)2], нитраты (ЩЭ)[Au(NO3)4], ацетаты (ЩЭ)[Аu(СН3СОО)4] и др.
Как для СuIII и AgIII, так и для золота (III) получены периодатные и теллуратные комплексы - Na5[Au(HIO6)2]3,5Н2О и Na5[Au(H2TeO6)2]12Н2О.
Очень высокую устойчивость имеют роданидные H[Au(SCN)4]2Н2О, K[Au(SCN)4] и цианидные H[Au(CN)4]3Н2О, K[Au(CN)4] комплексные соединения золота (III): КУСТ([Au(SCN)4]−) = 1042, KУСТ([Au(CN)4]−) = 1056.
Известно большое число комплексов АuIII с органическими кислород- и азотдонорными лигандами; описан, например, смешанно-лигандный фенантролиновый комплекс [Au(phen)Cl2]Cl, комплекс с пиридином [Аu(ру)2Сl2]Сl и др.
Существуют также смешанно-лигандные КС, представляющие собой производные диметилзолота и β-дикетонов. Например, известен ацетилацетонат диметилзолота (CH3)2Au(AcAc)2 (XLII), который можно рассматривать как производное МОС - триметилзолота Аu(СН3)3 (см. разд. 11.4.5), где один метильный радикал замещен на шестичленный хелатный цикл, образованный ацетилацетонат-ионом.
Это соединение переходит в газовую фазу при сравнительно низкой температуре. Поскольку его температура начала разложения равна 1400С, оказывается возможным получать из газовой фазы тонкие пленки металлического золота, используемые в приборостроении и микроэлектронике.
В комплексных соединениях золото (III) чаще всего имеет КЧ = 4, координационный полиэдр - плоский квадрат, что характерно для NiII, PdII и PtII - ионов-комплексообразователей с электронной конфигурацией d8. ТКП объясняет это тем, что даже для лигандов слабого поля (ОН−, галогенид-ионы) расщепление d-орбиталей золота в кристаллическом поле оказывается достаточно большим, чтобы перестройка октаэдрического или тетраэдрического полиэдра в квадрат (в соответствии с эффектом Яна-Теллера) была энергетически целесообразной.
