
- •Растворы. Способы описания количественного состава р-ров. Приготовление р-ров.
- •0.2ОС таким образом, чтобы вещество находилось в непосредственной близости к
- •Метод опред. Плотности жид. С пом. Пикнометра и ареометра
- •Метод опред. Плотности тв. Жиров и воска
- •Абсол. И относ. Показ. Преломл. Прим. Показ. Прелом. В фармакоп анал.
- •Удельное опт. Вращ, угол опт вращ. Прим.В фармакоп. Ан.
- •Виды вязк.(динам,кинет,структ,удел,привед,характ)
- •Виды воды, которая может содержаться в лс:
- •Физические способы определения воды: высушивания и дистилляции.
- •Химический метод определения воды: акваметрия (метод Фишера)
- •Определение общей золы и сульфатной золы
- •Определение бесцветности и окраски растворов лв.
- •Физические свойства лекарственных веществ: агрегатное состояние, внешний вид, окраска, кристалличность, полиморфизм
- •Кислотно-основные свойства лекарственных веществ
- •Связь химического строения и спектральных характеристик лек. В-в
Связь химического строения и спектральных характеристик лек. В-в
На связи химического строения и спектральных характеристик основана:
1.Фотометрия
Молекулярную абсорбционную спектроскопию в УФ- и видимой областях спектра называют спектрофотометрией либо фотометрией.
Объектами исследования в спектрофотометрии чаще всего являются органические вещества. Зависимость между строением органических соединений и их способностью поглощать электромагнитное излучение УФ- и видимого диапазона обычно изучается в курсе органической химии. Напомним лишь, что в органических соединениях могут происходить 4 типа электронных переходов: сигма→сигма*, n →сигма*, π→π* и n→π*. Энергия переходов первых двух типов соответствует энергии УФ-излучения вакуумного диапазона. Энергия π→π* переходов изолированных π-связей соответствует ЭМИ с лямда< 200 нм. При сопряжении нескольких π-связей полосы поглощения смещаются в более длинноволновую область спектра.
Группы, обуславливающие появление полос поглощения в молекулярных спектрах, называются хромофорами. Атомы или группы атомов, которые сами по себе не обуславливают появление полос поглощения, но влияют на характер поглощения хромофоров, называются ауксохромами.
Ауксохромы имеют неподелённые электронные пары, находящиеся в сопряжении с π-электронной системой хромофора, и могут сдвигать полосу поглощения хромофора в более длинноволновую область (батохромный сдвиг) или в более коротковолновую область (гипсохромный сдвиг), увеличивать её интенсивность (гиперхромный эффект) или уменьшать её (гипохромный эффект).
ИК-спектроскопия
ИК-спектроскопия используется преимущественно для установления строения и идентификации лекарственных веществ.
К инфракрасному относят электромагнитное излучение с длинами волн примерно от 800 нм (0,8 мкм) до 103 мкм. С точки зрения использования в анализе наиболее полезной является средняя область ИК-диапазона (средняя область 4000 - 200 см-1(2500 - 50000 нм)).
Если молекула поглощает ИК-излучение, то она переходит из одного колебательного состояния в другое. Есть два вида колебаний: валентные, при которых происходит изменение длины связи и деформационные, которые сопровождаются изгибом связи.
ИК-излучение способно влиять только на такие колебания, которые приводят к изменению дипольного момента молекулы.
Область ИК спектра от 4000 до 1350 см-1 называется областью функциональных групп. Отсутствие полос поглощения в данной области, связанных с какой либо функциональной группой, может служить доказательством отсутствия данной группы в молекуле. Условно
область функциональных групп можно разделить на:
-область валентных колебаний N-H и O-H (3650 -2500 см-1);
-область валентных колебаний C-H (3300 - 2800 см-1): -С≡С-H - 3300 см-1, C(аром)-H - 3100 см-1, С(алиф)-H - 3000 - 2800 см-1;
-область «прозрачности» (2700-1850 см-1) - валентные колебания -С≡N, -C≡C, C=C=C и т.п.;
-область двойной связи (1950-1350 см-1) - валентные колебания связей С=О (сильное поглощение при 1850-1650 см-1), С=С (слабое поглощение около 1650 см-1) и т.п.
Область ИК спектра от 1350 до 750 см-1 называется областью «отпечатков пальцев».
ИК-спектроскопия используется преимущественно для установления строения и идентификации лекарственных веществ.
Хроматографические методы индинтификации лекарственных веществ
Для идентификации в-в (качественного определения ) используются: газовая хроматография, жидкостная хроматография(различные её виды)
В хроматографии для идентификации веществ используются следующие характеристики
(характеристики удерживания) :
Время от момента ввода пробы до момента регистрации максимума пика называется временем удерживания (tR). tR = tm + ts
Время удерживания не зависит от концентрации вещества, но зависит от его природы, а также от природы подвижной и неподвижной фазы и условий хроматографирования. Время удерживания вещества зависит от упаковки сорбента и поэтому может изменяться при переходе от одной колонки к другой.
Более надёжной характеристикой является исправленное время удерживания ( tR’),
которое равно разности между временем удерживания данного вещества и несорбируемого компонента (t0). Поскольку t0 = tm, то tR’ = tS.
Объём подвижной фазы, который необходимо пропустить через колонку с определённой скоростью для того, чтобы элюировать вещество, называется удерживаемым объёмом (VR). Аналогично понятию исправленное время удерживания существует понятие исправленныйудерживаемый объём (VR’ ) . VR= tR× F VR’=( tR- tm)× F = VR- Vm
где F - объёмная скорость подвижной фазы (см3/мин)
Отношение
равновесной концентрации вещества в
неподвижной фазе (Cs) к его равновесной
концентрации в подвижной фазе (Сm)
называется коэффициентом распределения
(D).
![]()
Удерживаемый
объём связан с коэффициентом
распределения уравнением, называемым
основным уравнением хроматографии:
![]()
Произведение коэффициента распределения на соотношение объёмов неподвижной и подвижной фазы называется коэффициентом ёмкости колонки ( k’ ):
![]()
![]()
Так
же используется параметр, называемый
индексом удерживания. В газовой
хроматографии для определения индекса
удерживания в качестве стандартов
берут два соседних н-алкана, один из
которых элюируется до исследуемого
соединения, а второй после. Логарифмический
индекс удерживания равен: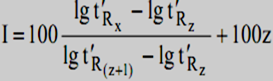
где z - число атомов углерода в молекуле н-алкана, который элюируется первым .
Затем по справочным таблицам можно определить круг веществ, которые имеют близкую к рассчитанной величину индекса Ковача.
При Анализе плоскостной хроматограммы используются свои характиристики.
Разделяемые компоненты образуют на хроматографической пластинке или полоске хроматографической бумаги отдельные зоны (пятна).
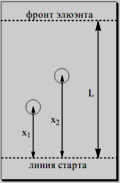
Положение отдельных хроматографических зон на хроматограмме характеризуют с помощью величины Rf, равной отношению расстояния, пройденного зоной вещества от стартовой линии до центра зоны (x), к расстоянию от стартовой линии до границы фронта растворителя к концу опыта (L)
![]()
Величина Rf может принимать значения от 0 до 1. Если Rf = 0, то вещество остаётся на старте, если Rf = 1, то оно поднимается с фронтом растворителя. Величина Rf является качественной хроматографической характеристикой вещества. Она зависит от природы вещества, подвижной и неподвижной фазы, условий хроматографирования и, в определённых пределах, не зависит от концентрации вещества. Подвижность разделяемых веществ можно также сравнить с подвижностью вещества, принятого за стандарт
![]()
Величина Rf связана с коэффициентом распределения вещества (D) и коэффициентом емкости неподвижной фазы по отношению к данному веществу (k’ ) следующими уравнениями:
![]()
![]()
