
- •Биохимия мышечной ткани.
- •Морфологическая организация поперечнополосатой мышцы
- •Химический состав поперечнополосатой мышцы
- •Мышечные белки
- •Небелковые азотистые экстрактивные вещества
- •Безазотистые вещества
- •Функциональная биохимия мышц
- •Источники энергии мышечной деятельности
- •Механизм мышечного сокращения
- •Ооооооооо
- •Биохимические процессы, происходящие в мышце при сокращении и расслаблении
- •Биоэнергетические процессы при мышечной деятельности источники энергии при мышечной работе
- •Биохимические изменения в мышцах при патологии
- •Химический состав мышечной ткани
- •Свойства и структурная организация сократительных белков
- •Биоэнергетические процессы при мышечной деятельности источники энергии при мышечной работе
- •Ресинтез атф в креатинфосфокиназной реакции
- •Ресинтез атф в процессе гликолиза
- •Ресинтез атф в миокиназной реакции
- •Соотношение процессов аэробного и анаэробного ресинтеза атф в упражнениях разной мощности и длительности
- •Динамика биохимических процессов в организме человека при мышечной деятельности
- •Транспорт кислорода к работающим мышцам
- •Мобилизация энергетических ресурсов при мышечной работе
- •Потребление кислорода при мышечной работе
- •Лимитирующие факторы спортивной работоспособности
- •Биоэнергетические критерии физической работоспособности спортсменов
- •Показатели аэробной и анаэробной работоспособности спортсменов
- •Специфичность спортивной работоспособности
- •Влияние тренировки на работоспособность спортсменов
- •Последовательность адаптационных изменений в процессе тренировки
- •Взаимодействие тренировочных эффектов и потенцирование адаптационных изменений при тренировке
- •Систематизация упражнений по характеру биохимических изменений при работе
- •Методы тренировки, способствующие развитию выносливости
- •Микроструктурные и биохимические изменения (% от исходного уровня) в мышечных волокнах под влиянием тренировки с использованием различных видов упражнений (н. Н. Яковлев, 1983)
- •Обратимость адаптации
- •Цикличность развития адаптации и периодизация тренировки
- •Эффективность адаптации и оптимизация тренировочного процесса
- •Влияние тренировки на работоспособность спортсменов
- •Биохимические основы методов скоростно-силовои подготовки спортсменов
- •Биохимические изменения в организме при утомлении и в период отдыха после мышечной работы
- •Динамика биохимических процессов в период отдыха после мышечной работы
Ооооооооо
ОООООО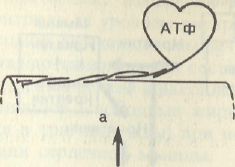



Схематическое
изображение функционирования мостиков
при сокращении поперечнополосатой
мышцы.
Изменение
миозиновых и актиновых нитей, и
одновременно начинается новый акт
зарядки (фосфорилирования)
свободного миозина путем взаимодействия
его с АТФ в присутствии
ионов Мg2+
. По-видимому, чем большее число мостиков
прикреплено
в данный момент к актиновым нитям, тем
больше сила мышечного сокращения.
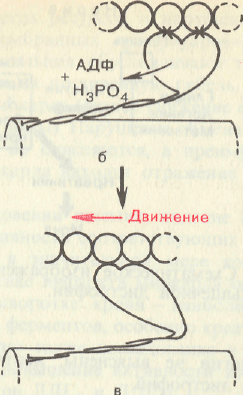
Наконец,
если возбуждение прекращается, содержание
ионов кальция в саркоплазме
снижается (кальциевая помпа), то циклы
прикрепление —
освобождение
прекращаются,
т. е. головки миозиновых нитей перестают
прикрепляться к актиновым нитям. При
этом в присутствии АТФ мышца расслабляется
и ее длина достигает исходной. Если же
прекращается поступление АТФ (аноксия,
отравление дыхательными ядами или
смерть), то мышца переходит в состояние
окоченения. Почти все поперечные мостики
толстых (миозиновых) нитей присоединены
при этом к тонким актиновым нитям,
следствием чего и является полная
неподвижность мышцы.
Миозиновые миофибриллы имеют толщину 10 нм, состоят из пучка продольно ориентированных молекул миозина (около 360)'. В результате электростатического взаимодействия между «хвостами» легкого меромиозина в толстых протофибриллах образуется структура, похожая на многожильный кабель, над поверхностью которого выступают «головки» тяжелого меромиозина. В центральной М-полосе толстых протофибрилл «головки» отсутствуют. Это значит, что миозиновые молекулы соединены здесь своими «хвостами» и «головы» их направлены в разные стороны. Выступающие «головки» расположены по правильным спиральным линиям. На поперечном срезе толстой протофибриллы насчитывается 18 молекул миозина.

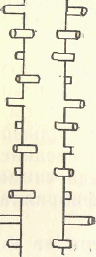
Рис.
Схема
взаимного расположения толстых и тонких
протофибрилл (поперечный
срез)
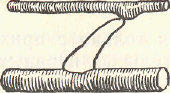
Сокращение спайки
Расслабление
Рис.
Образование и сокращение спайки между актином и миозином
Биохимические процессы, происходящие в мышце при сокращении и расслаблении
При мышечном сокращении происходит повторяющееся образование и разрушение спаек между «головками» миозиновых молекул толстых протофибрилл и активными центрами С-актиновых единиц тонких протофибрилл. Возникновение спайки можно представить себе следующим образом. В расслабленной мышце «головки» миозина, образующие боковые отростки толстых протофибрилл, расположены перпендикулярно по отношению к продольной оси толстой протофибриллы. В ходе сокращения «головка» переходит в угловое положение. При этом замыкается спайка между актином и миозином. Затем изменяется структура «головки» миозиновой молекулы, вследствие чего в спайке развивается напряжение; она укорачивается и продвигает актиновую нить вдоль миозиповой по направлению к центру саркомера на расстояние, равное длине Ф-актиновой единицы.
Чтобы полностью вдвинуть тонкие протофибриллы в промежутки между толстыми, одной спайки недостаточно. В момент сокращения образуется около 300 спаек в минуту в каждом центре.
Укорочение спайки и продвижение актиновой нити вдоль миозиновой -процесс, требующий затраты энергии. Веществом, химическая энергия которого может быть непосредственно преобразована в механическую работу мышечного сокращения, является АТФ. Такое преобразование энергии происходит при гидролитическом расщеплении АТФ, ускоряемом ферментативным центром миозина. Энергия при этом передается миозину, который, изменяя свою внутреннюю структуру, совершает механическую работу.
В покоящейся мышце имеется и миозин, и связанная с ним через ионы Мg-АТФ, однако расщепления АТФ миозином не происходит и спайки между миозином и актином не образуются. Этому препятствует связывание ионов Са++ белковым веществом, входящим в состав SR. АТФ в мышце находится в ионизированном состоянии в виде анионов АТФ~4 (свободная) и Мg-АТФ~2 (связанная с миозином). АТФ присоединяется к миозину в некотором отдалении от центра АТФ-азной активности, который также заря-отрицательно. Пока этот заряд не будет нейтрализован иона-
ми Са++, АТФ не может реагировать с центром и расщепляться, Образованию спаек миозина с актином в покое препятствует комплекс тропомиозина с тропонином, несущий (за счет тропонина) большой отрицательный заряд и блокирующий активные центры актина.
Положение меняется только с приходом нервного импульса, когда в области двигательных нервных окончаний выделяется передатчик импульсов — нейрогормон ацетилхолин. Его полярная молекула, взаимодействуя с белками сарколеммы, изменяет их структуру таким образом, что проницаемость сарколеммы для ионов Na+ становится значительно больше, чем в покое. Ионы Nа+ устремляются внутрь мышечного волокна, нейтрализуя отрицательный заряд на внутренней поверхности сарколеммы. Происходит деполяризация сарколеммы и связанных с ней поперечных трубочек саркоплазматического ретикулума. От трубочек волна возбуждения передается мембранам пузырьков и цистерн, основная масса которых оплетает миофибриллы на участках, где происходит взаимное наложение актиновых и миозиповых нитей. При этом освобождаются ионы Са++:
Получив тем или иным путем энергию АТФ, сократительные белки образуют богатый энергией актомиозиновый комплекс, способный произвести работу по сокращению.
За сокращением спайки следует ее разрыв, в котором также участвует АТФ, но она не расщепляется, а вновь образует фермент — субстратный комплекс с миозином:Ионы кальция связываются с тропонином, который теряет заряд и освобождает активные центры актиновых нитей.
Прекращение электростатического отталкивания тонких и толстых протофибрилл делает при участии Са++ возможным возникновение спайки между актином и миозином. Мg-АТФ~2, образовавшая в расслабленной мышце фермент-субстратный комплекс с миозином, в присутствии Са++ взаимодействует с центром ферментативной активности миозина и расщепляется. Освободившаяся энергия используется для сокращения спайки.
Для объяснения механизма передачи энергии молекулам сократительных белков было предложено несколько вариантов схем протекания химических реакций. Одни исследователи считают, что передача энергии с АТФ на актомиозин осуществляется путем образования макроэргического миозин-фосфата; другие полагают, что при распаде АТФ фосфат сразу выделяется в свободном состоянии.
Если в этот момент поступает новый нервный импульс, то реакции с 1-й по 3-ю повторяются. Если новый импульс не поступает, происходит расслабление мышцы. Один из белков сарколеммы действует как фермент холинэстераза, расщепляя ацетилхолин. Исчезновение ацетилхолина приводит к восстановлению на сарколемме и мембранах 5^ исходного распределения ионов Nа+ и К+. При этом механизм кальциевого насоса в пузырьках SR? вновь становится активным. Расщепляя АТФ, он использует ее энергию для связывания ионов Са++, а освобожденный от Са++ тропонин препятствует замыканию новых спаек:
Возвращение сокращенной мышцы при расслаблении в исходное состояние происходит при участии упругих сил, возникших в белках стромы.
 Рассмотренные
гипотезы мышечного сокращения
предполагают, что
в момент сокращения происходит только
скольжение актиновых нитей вдоль
миозиповых, однако некоторые
экспериментальные
данные указывают и на укорочение нитей.
Это может быть связано
с изменением во время сокращения
пространственной структуры
сократительных белков, например с
переходом длинной тонкой
а-спирали полипептидных цепей в более
короткую и толстую
(3-спираль.
Рассмотренные
гипотезы мышечного сокращения
предполагают, что
в момент сокращения происходит только
скольжение актиновых нитей вдоль
миозиповых, однако некоторые
экспериментальные
данные указывают и на укорочение нитей.
Это может быть связано
с изменением во время сокращения
пространственной структуры
сократительных белков, например с
переходом длинной тонкой
а-спирали полипептидных цепей в более
короткую и толстую
(3-спираль.
Когда мышца находится в состоянии покоя, АТФ cоединяется с миозином и препятствует образованию его спаек с актином (пластифицирующий эффект). В момент сокращения мышцы АТФ, расщепляясь, освобождает энергию, необходимую для укорочения спайки. Кроме того, расщепление АТФ обеспечивает энергией действие «кальциевого насоса» в пузырьках SR, Расщепление АТФ в мыщце происходит с очень большой скоростью: до 10 микромолей на 1 г мышцы в
минуту. Так как общие запасы АТФ в мышце невелики (их может хватить только на 0,5—1 с работы с максимальной мощностью), для обеспечения нормальной деятельности мышц АТф должна восстанавливаться с такой же скоростью, с какой она расщепляется.
