
- •Окислительно-восстановительные реакции. Сопряженная окислительно-восстановительная пара
- •Оценка окислительно-восстановительной способности. Потенциал окислительно-восстановительной системы
- •Соглашение о знаках
- •Зависимость окислительно-восстановительного потенциала от концентрации и температуры. Уравнение Нернста
- •Влияние химических взаимодействий на потенциал
- •Влияние рН
- •Влияние комплексообразования
- •Влияние образования малорастворимых соединений
- •Константы равновесия окислительно-восстановительных реакций. Оценка глубины протекания окислительно-восстановительных реакций
- •Окислительно-восстановительные свойства воды
- •Молярная масса эквивалента в реакциях окисления-восстановления
Влияние химических взаимодействий на потенциал
Рассмотрим влияние реагентов, которые, так или иначе, взаимодействуют с окисленной или восстановленной формами, на потенциал системы. Такие взаимодействия практически приводят к созданию новых редокс-систем, что широко используется в аналитической химии для управления химическими реакциями.
Влияние рН
Часто при протекании окислительно-восстановительных реакций перестраивается структура веществ, при этом не обойтись без участия других компонентов. При перестройке кислородсодержащих частиц таковыми являются ионы водорода. Кроме того, ионы водорода могут протонировать окисленную или восстановленную формы, если последние являются акцепторами протона. Во всех этих случаях ионы водорода вводят в уравнение Нернста:

Например, для реакции: MnO4- + 8H+ + 5e- ↔ Mn2+ + 4H2O уравнение Нернста имеет вид:

Влияние комплексообразования
Окисленная или восстановленная формы системы (или обе) могут связываться в комплексы.
Если в комплекс связана окисленная форма, то
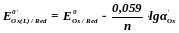
Если в комплекс связана восстановленная форма, то

Таким образом, связывание в комплекс окисленной формы понижает, а восстановленной – повышает стандартный потенциал системы.
Влияние образования малорастворимых соединений
Иногда либо окисленная, либо восстановленная формы (или обе) малорастворимы. Тогда, если в малорастворимое соединения связана окисленная форма, то
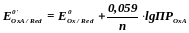
Если же в малорастворимое соединение связана восстановленная форма, то
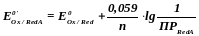
Константы равновесия окислительно-восстановительных реакций. Оценка глубины протекания окислительно-восстановительных реакций
Значения стандартных окислительно-восстановительных потенциалов редокс-пар можно использовать для определения направления протекания ОВР. Для этого необходимо из справочных данных получить значения стандартных потенциалов для обеих полуреакций и вычислить их разность. При этом следует помнить, что обе полуреакции должны быть записаны как процессы восстановления (присоединения электронов). Разность стандартных потенциалов находят, не меняя знаков потенциалов, приведенных в справочной литературе. Если разность потенциалов имеет отрицательное значение, то реакция протекает в обратном направлении (справа налево), а если же – положительное, то в прямом (слева направо).
Для количественной оценки глубины протекания ОВР служит константа равновесия реакции, которую можно вычислить по формуле:
 ,
,
где n – общее число электронов, отдаваемых восстановителем или принимаемое окислителем в соответствии с уравнением реакции.
Если вместо стандартных потенциалов использовать формальные, то можно рассчитать условную константу равновесия. Именно она и определяет направление и глубину протекания окислительно-восстановительной реакции в заданных условиях:

Если lgK'>>0, то реакция протекает в прямом направлении (слева направо);
Если lgK'<<0, то реакция протекает в обратном направлении (справа налево).
Окислительно-восстановительные свойства воды
Характеристика окислительно-восстановительных свойств воды очень важна для понимания многих окислительно-восстановительных реакций в водном растворе, суждения об устойчивости различных окислителей и восстановителей в водном растворе и т.д.
Потенциал стандартного водородного электрода условно принят за ноль, поэтому уравнение Нернста для СВЭ имеет вид:
2Н+ + 2е- = Н2
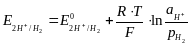
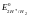 =0
при условии а(Н+)=1.
В чистой воде а(Н+)=1,00∙10-7
М и потенциал СВЭ в воде при 250С
и р(Н2)=1
атм. равен:
=0
при условии а(Н+)=1.
В чистой воде а(Н+)=1,00∙10-7
М и потенциал СВЭ в воде при 250С
и р(Н2)=1
атм. равен:

Следовательно, восстановители, у которых стандартный потенциал E0< -0,413 В, разлагают воду с образованием газообразного водорода.
Вода обладает также и восстановительными свойствами:
2Н2О = 4Н+ + О2 + 4е-
Стандартный потенциал этой пары при 250С равен 1,23 В, то есть:

В чистой воде а(Н+)=1,00∙10-7 М, тогда при р(О2)=1 атм.:
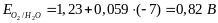
Следовательно, окислители, у которых стандартный потенциал E0>0,82 В, могут окислять воду с выделением кислорода.
Таким образом, в водных растворах устойчивы редокс-системы, потенциал которых находится в интервале (-0,413÷0,82) В, при этом активность ионов водорода в уравнении Нернста должна быть равна 1,00∙10-7 М. Окислительно-восстановительные системы, потенциал которых выходит за пределы данного интервала, могут разлагать воду с выделением водорода или кислорода, хотя и такие системы нередко в течение длительного времени остаются устойчивыми в связи с малой скоростью реакции взаимодействия и некоторыми другими причинами.
