
- •Міністерство освіти і науки, молоді та спорту України
- •“Ефекту надекспресії гена fps1 на стійкость клітин дріжджів до ізобутилового спирту та інших спиртів”
- •1. Загальна інформація про організацію – базу проходження практики
- •2. Інформація про функції, структуру та організацію роботи біохімічної лабораторії, її забезпечення реактивами, матеріалами та обладнаннями
- •3. Опис виконання практики згідно з календарним планом
- •5. Матеріали і методи досліджень [6, 8]
- •5.1. Матеріали досліджень
- •5.2. Методи досліджень.
- •5.2.1. Електротрансформація e.Coli dh5α
- •5.2.2. Виділення плазмідної днк з клітин e.Coli
- •5.2.3. Електрофорез днк в агарозному гелі
- •5.2.4. Розщеплення днк ендонуклеазами рестрикції
- •5.2.5. Трансформація дріжджів з використанням літій ацетату і поліетиленгліколю
- •5.2.6. Полімеразна ланцюгова реакція (плр)
- •5.2.7. Довготривале зберігання бактерійних та дріжджових трансформантів
- •5.2.8. Виділення тотальної днк з клітин дріжджів
- •5.2.9. Лігування днк-вставки з днк-вектором.
- •5.2.10. Елюція фрагментів днк з гелю.
- •6. Результати та їх обговорення
- •7. Пропозиції кафедрі біохімії з покращення підготовки студентів як спеціалістів
- •Висновки
6. Результати та їх обговорення
Клонування гену FPS1 (2010 п.н.) здійснювали за допомогою ПЛР. Спочатку проведено дизайн праймерів Ko519 та Ko520 на основі наявної послідовності нуклеотидів відповідного гену. Для клонування касети експресії гену FPS1 під контролем сильного конститутивного промотора гену алкогольдегідрогенази ADH1 та термінатора гена CYC1, що кодує цитохром С, було використано вихідну плазміду pRS303K-ADH-FBP-CYC, в якій було замінено ген фруктозо-1,6-бісфосфатази на ген аквагліцеропорину FPS1.
Плазміда pRS303K-ADH-FBP-CYC (7743 п.н.) сконструйована раніше на основі вектора pRS303K (5653 п.н.). Цей вектор містить домінантний селективний маркер kanMX, що забезпечує селекцію дріжджових трансформантів на середовищі з генетицином (G418).
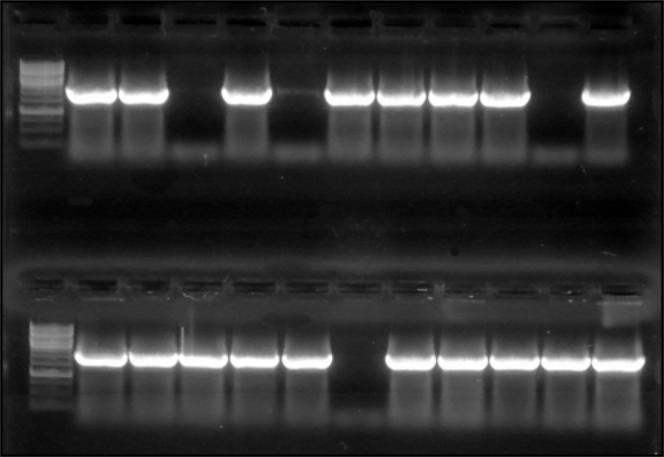
Як вектор використовували плазміду pRS303K-ADH-FBP-CYC, яку обробляли рестриктазами NotI та BamHІ. ПЛР-продукт, що містить послідовність ВРТ гена FPS1, обробляли тими ж ендонуклеазами рестрикції для отримання комплементарних липких кінців. Одержані вектор та вставку лігували за участю Т4-ДНК лігази. Лігазною сумішшю було протрансформовано компетентні клітини E. сoli, після чого їх висівали на селективне середовище. Наявність потрібної конструкції перевіряли за допомогою ПЛР (Рис.6.1). Проаналізовано 20 клонів, з них 17 містили ген FPS1 (2010 п. н.). Схему сконструйованої плазміди представлено на рис. 6.2.
2010 п.н. |
13 14 15 16 17 18 19 20 21 22 23 24
2010 п.н. |
1 2 3 4 5 6 7 8 9 10 11 12
Рис.
6.1.
ПЛР-аналіз
бактерійних трансформантів, одержаних
після трансформації лігазною сумішшю
1, 13 – маркери молекулярної ваги, 2 – 22 – зразки №1-20 з проаналізованих колоній, 23 – негативний контроль, 24 – позитивний контроль (сумарна ДНК S.cerevisiae BY4742 ).
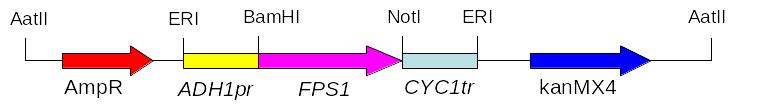
Рис. 6.2. Схема плазміди pRS303K-ADH-FPS1-CYC (8754 п. н.)
Для подальшої роботи було обрано зразки з колоній №1 та №3. Було виділено плазмідну ДНК. Для перевірки коректності конструкта було проведено рестрикційний аналіз сконструйованої плазміди pRS303K-ADH-FPS1-CYC (8754 п. н.) (Рис.6.3).
1
2 3 4 5 6 7 8 9
10 11 12 13 14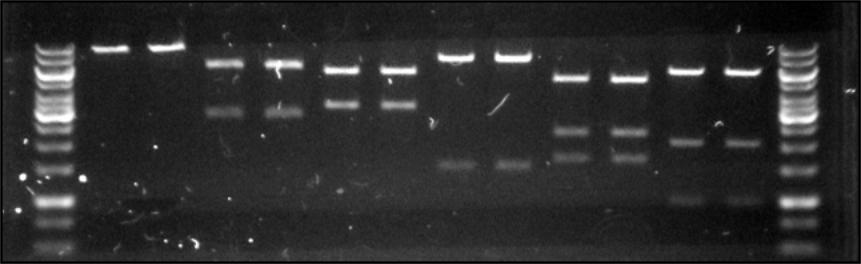
Рис. 6.3. Аналітична рестрикція pRS303K-ADH-FPS1-CYC
1, 14 – маркери молекулярної ваги, 2 – зразок №1, оброблений BamHI, 4 – EcoRV, 6 – BglII, 8 – ScaI, 10 – BglI, 12 – KpnI; 3 – зразок №3, оброблений BamHI, 5 – EcoRV, 7 - BglII, 9 – ScaI, 11 - BglI, 13 – KpnI.
У подальшій роботі використовували зразок № 1.
Для отримання інтегративних трансформантів плазміду pRS303K-ADH-FPS1-CYC було лінеаризовано рестриктазою AatII та використано для трансформації дріжджів S. cerevisiae BY4742, а також S. cerevisiae AS400. Відбір трансформантів здійснювали, висіваючи клітини після трансформації на середовище YPD з генетицином у концентрації 100 мкг/мл. Одержані трансформанти штаму BY4742 було стабілізовано. Наявність потрібної конструкції (ВРТ FPS1 і термінатор гена CYC1) перевіряли за допомогою ПЛР (праймери Ко 519 та Ко 454; Рис.3.10), крім того перевірено наявність в геномі гена стійкості до генетицину kanMX (праймери Ко 467, Ко 468) (Рис.6.4). Виявлено, що майже всі перевірені штами містять в геномі ген стійкості до генетицину, проте наявність FPS1+CYC1tr підтвердилася лише для штамів №5 та №7. Одержано також стійкі до генетицину клони після трансформації промислового штаму AS400, проте наявність гена FPS1 в геномі цих штамів не підтвердилася (Рис.6.4). Для подальшої роботи обрано по два клони штамів №5 та №7 (BY+FPS1 5-1, BY+FPS1 5-2, BY+FPS1 7-1, BY+FPS1 7-2).
1
2
3 4
5
6
7
8
9
10
11
12 13 14 15
16
17
18
19
20 21
22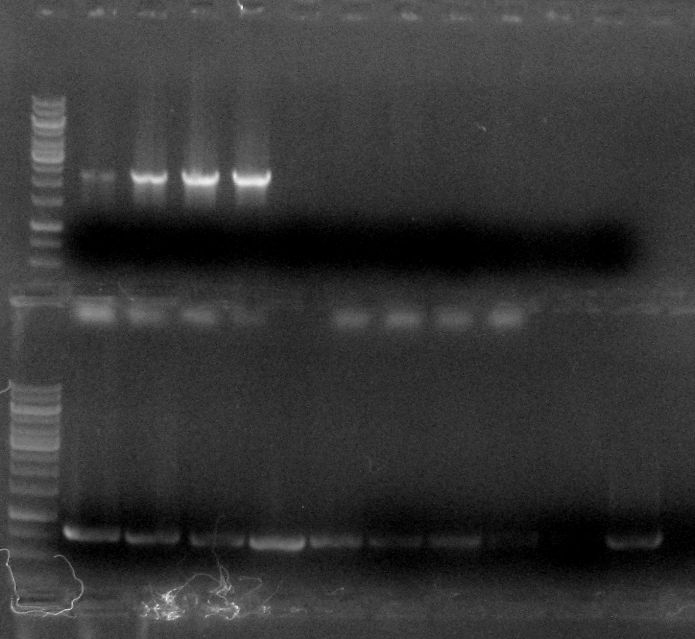
Рис. 6.4. ПЛР-аналіз геномної ДНК клонів, стійких до генетицину, на наявність конструкції FPS1+CYC1tr (2-10) та гена kanMX (12-21).
1, 11 – маркери молекулярної ваги, 2 – 10, 12 - 20 – досліджувані зразки (2, 12 - 5-1; 3, 13 – 5-2; 4, 14 –7-1; 5, 15 – 7-2, 6, 16 – AS5; 7, 17 – AS6; 8, 18 – AS7; 9, 19 – AS9; 10, 20 – AS21), 22 – негативний контроль (без додавання матриці для ампліфікації kanMX), 21 - позитивний контроль на kanMX
Перевірено стійкість одержаних трансформантів до гіпо- та гіперосмотичного шоку. Для тесту стійкості до гіперосмотичного шоку клітини вирощували на чашках з мінімальним середовищем YNB з додаванням 2% глюкози, ресуспендували в такому ж рідкому середовищі до OD600= 0,3 та сіяли краплями по 5 мкл клітинної суспензії (нерозведеної та в трьох серійних розведеннях 1:10) на мінімальне середовище з 1М сорбітолу (гіперосмотичний шок) та без сорбітолу (контроль) (Рис.6.5). Для гіпоосмотичного шоку клітини підрощували на середовищі з 1М собрітолу, після чого сіяли на середовище без сорбітолу (гіпоосмотичний стрес) або з 1М сорбітолом (контроль). Показано, що штами, які надекспресують FPS1, чутливіші до гіперосмотичнго стресу, ніж до гіпоосмотичного стресу. Можна припустити, що різниця у фенотипі штамів №5 та №7 зумовлена різною кількістю копій гена FPS1, або різним сайтом інтеграції в геном.
7-2
7-1 5-2 5-1 BY
BY
7-1
5-2 5-1 7-2
YNB
– сорбітол
(контроль) YNB
+ 1M сорбітол
(гіперосмотичний шок)
1 OD600
0,1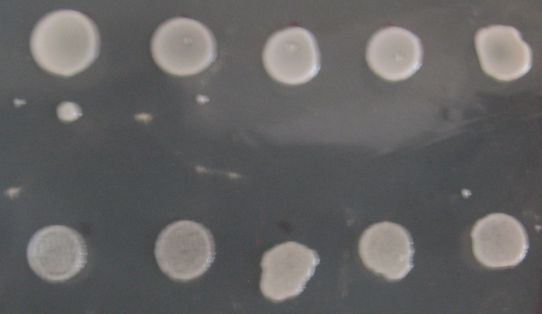

Рис. 6.5. Ріст штамів BY+FPS1 за умов гіперосмотичного стресу
Проведено крапельні тести на стійкість трансформантів до спиртів. Для цього клітини, підрощені на мінімальному середовищі YNB, сіяли краплями на таке ж середовище (контроль) та на середовища з додаванням 10% етанолу, 5% ізопропанолу або 2% ізобутанолу. Штами, що надекспресують FPS1, виявилися стійкішими до названих спиртів, ніж вихідних штам (рис. 6.6). Перевірено також стійкість даних штамів до ізобутанолу у рідкому середовищі (рис. 6.7).
Цікаво, що у середовищі без ізобутанолу штами № 5 та № 7 сильно флокулювали, що не спостерігалося в середовищі з додаванням ізобутанолу. Флокуляція зумовлена формуванням конгломератів клітин, які були добре помітні під мікроскопом; скупчення клітин були значно більшими у випадку культивування в середовищі без ізобутанолу (рис. 6.8).
1 0,1 0,01
OD600
OD600
OD600
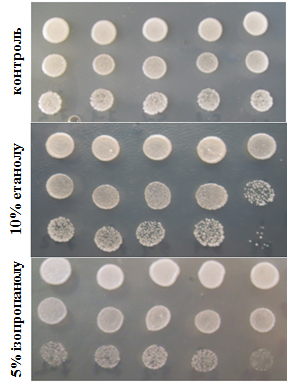



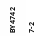

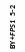
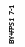

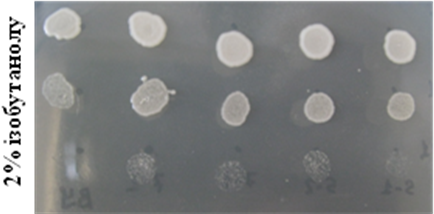
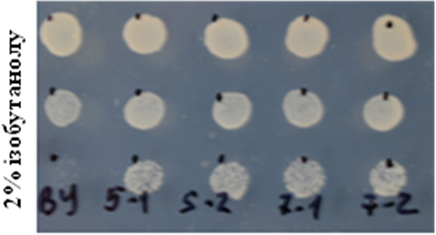
Рис. 6.6. Ріст штамів BY+FPS1 на середовищах з додаванням спиртів
Б
А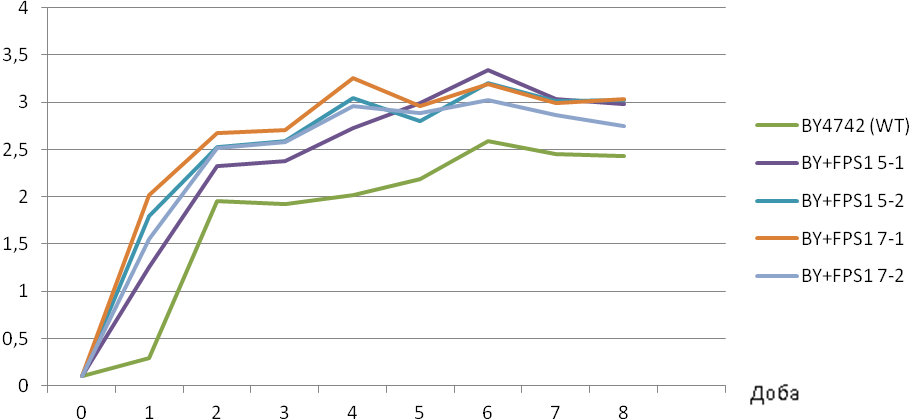


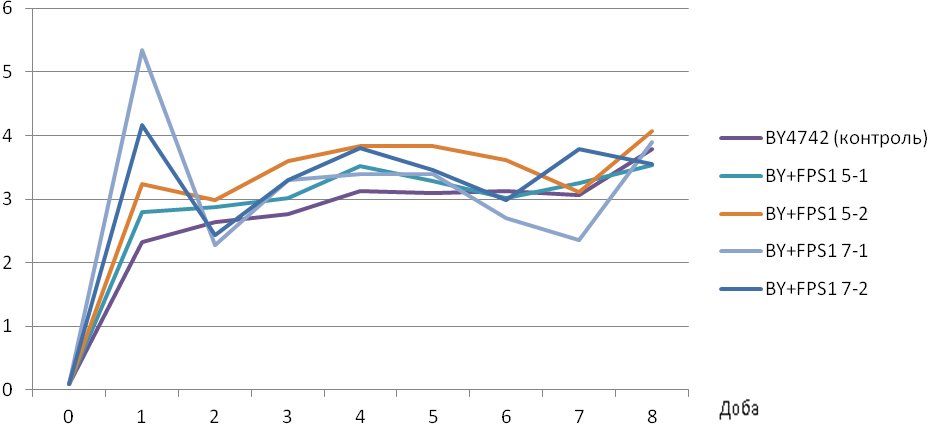
Рис. 6.7. Кінетика росту штамів BY+FPS1 в середовищі YNB + leu + ura+ +his + lys + 1% ізобутанолу (А) та в середовищі YNB+leu+ura+his+lys без додавання ізобутанолу (Б)
Без ізобутанолу +1%
ізобутанолу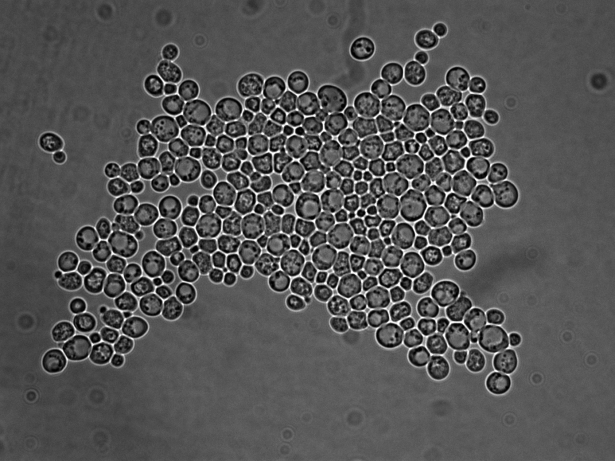
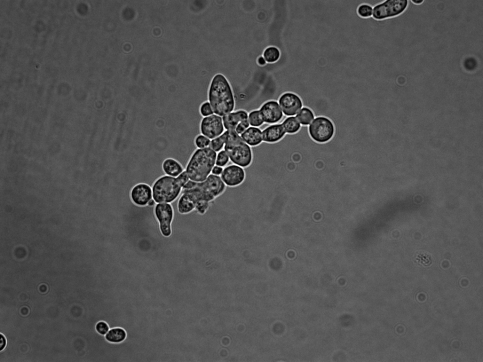
Рис. 6.8. Мікрофотографії клітин BY+FPS1 7-2, що культивувалися в середовищі без ізобутанолу або з додаванням 1% ізобутанолу
