
- •Часть II. Химия d- и f-элементов. Качественные задачи по химии элементов
- •Раздел II. Химические элементы побочных подгрупп (d-элементы)
- •9. Элементы III группы побочной подгруппы
- •9.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы III группы
- •Распространенность элементов побочной подгруппы III группы в земной коре
- •9.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы III группы
- •9.3. Соединения
- •Некоторые свойства оксидов элементов побочной подгруппы III группы
- •2Э(он)3 2эоон э2о3.
- •9.4. Применение
- •10. Элементы IV группы побочной подгруппы
- •10.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы IV группы
- •Распространенность элементов побочной подгруппы IV группы в земной коре
- •10.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы IV группы
- •10.3. Соединения
- •Некоторые свойства оксидов элементов побочной подгруппы IV группы
- •Гидроксиды элементов побочной подгруппы IV группы
- •10.4. Применение
- •11. Элементы V группы побочной подгруппы
- •11.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы V группы
- •Распространенность элементов побочной подгруппы V группы в земной коре
- •11.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы V группы
- •11.3. Соединения
- •11.4. Применение
- •12. Элементы VI группы побочной подгруппы
- •12.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы VI группы
- •Распространенность элементов побочной подгруппы VI группы в земной коре
- •12.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы VI группы
- •12.3. Соединения
- •Оксиды элементов побочной подгруппы VI группы
- •Гидроксиды элементов побочной подгруппы VI группы и их соли
- •12.4. Применение
- •13. Элементы VII группы побочной подгруппы
- •13.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы VII группы
- •Распространенность элементов побочной подгруппы VII группы в земной коре
- •13.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы VII группы
- •13.3. Соединения
- •Оксиды элементов побочной подгруппы VII группы
- •Гидроксиды элементов побочной подгруппы VII группы и их соли
- •13.4. Применение
- •14. Элементы VIII группы побочной подгруппы
- •14.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы VIII группы
- •Распространенность элементов побочной подгруппы VIII группы в земной коре
- •14.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы VIII группы
- •14.3. Соединения
- •14.4. Применение
- •15. Элементы I группы побочной подгруппы
- •15.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы I группы
- •Распространенность элементов побочной подгруппы I группы в земной коре
- •15.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы I группы
- •15.3. Соединения
- •Оксиды элементов побочной подгруппы I группы
- •Некоторые характеристики оксидов элементов побочной подгруппы I группы
- •Некоторые свойства гидроксидов элементов побочной подгруппы I группы
- •15.4. Применение
- •16. Элементы II группы побочной подгруппы
- •16.1. Характеристика элементов
- •Некоторые свойства элементов побочной подгруппы II группы
- •Распространенность элементов побочной подгруппы II группы в земной коре
- •16.2. Простые вещества
- •Некоторые свойства металлов побочной подгруппы II группы
- •16.3. Соединения
- •Оксиды элементов побочной подгруппы II группы
- •16.4. Применение
- •Раздел III. Лантаноиды и актиноиды (f-элементы)
- •17. Лантаноиды
- •17.1. Характеристика элементов
- •Некоторые свойства элементов-лантаноидов
- •Содержание лантаноидов в земной коре, %
- •17.2. Простые вещества
- •Некоторые свойства лантаноидов
- •17.3. Соединения
- •17.4. Применение
- •18. Актиноиды
- •18.1. Характеристика элементов
- •Некоторые свойства элементов-актиноидов
- •Содержание актиноидов в земной коре, %
- •18.2. Простые вещества
- •Некоторые свойства актиноидов
- •18.3. Соединения
- •18.4. Применение
- •Качественные задачи по химии элементов
- •Задачи на распознавание кислот и солей
- •Задачи на периодический закон и периодическую систему химических элементов д. И. Менделеева
- •Усиление кислотных свойств, ослабление основных свойств
- •Задачи на свойства отдельных элементов и их соединений
- •Качественные задачи на классификацию веществ, их получение и превращение
- •Задачи по наблюдению явлений и их объяснению
- •Задачи на применение приборов, их проектирование и конструирование
- •Задачи на определение массы (объема) продукта, полученного из вещества, имеющего примеси
- •Задачи на вычисление выхода (массовой доли выхода) продукта
- •Литература
Задачи по наблюдению явлений и их объяснению
Пример 18. В одной из двух фарфоровых чашек был выпарен досуха водный раствор аммиака, в другой – водный раствор гидроксида натрия. Можно ли не прибегая к каким-либо пробам, указать чашку, в которой был раствор аммиака? Ответ поясните.
Решение.
При нагревании раствора гидроксида натрия происходит испарение растворителя – воды. После удаления всей воды на дне чашки остается сухой остаток белого цвета – гидроксид натрия NaOH.
При нагревании раствора аммиака кроме испарения воды происходит термическое разложение весьма неустойчивого гидрата аммиака (гидроксида аммония):
NH3∙H2O = NH3↑ + H2O (пар).
Образующийся при этом аммиак улетучивается. В чашке не остается ничего. Поэтому определить ту чашку, в которой выпаривали раствор аммиака, довольно просто.
Пример 19. Склянка, почти доверху заполненная концентрированной серной кислотой, была оставлена открытой. Через несколько дней часть жидкости перелилась через край склянки. Чем это объясняется?
Решение.
Одним из характерных свойств концентрированной серной кислоты является гигроскопичность, то есть способность поглощать влагу из окружающей среды. Оставленная на несколько дней серная кислота поглощает водяной пар из воздуха, объем раствора при этом увеличивается и часть его переливается через край сосуда.
Пример 20. Как будет изменяться со временем масса открытого сосуда: а) с очень разбавленным раствором серной кислоты; б) с концентрированной серной кислотой?
Решение.
а) Масса открытого сосуда с очень разбавленным раствором серной кислоты со временем будет уменьшаться за счет испарения воды, при этом концентрация раствора будет увеличиваться;
б) Масса сосуда с концентрированной серной кислотой будет увеличиваться за счет поглощения водяного пара воздуха, при этом концентрация раствора будет уменьшаться.
Пример 21. Можно ли перевести бромоводород из наполненного этим газом стеклянного цилиндра в другой, «пустой» цилиндр, наклоняя первый цилиндр над вторым так, как если бы производилось переливание жидкости? Ответ подтвердите расчетами.
Решение.
«Переливание» бромоводорода из одного сосуда в другой возможно, так как этот бесцветный термически устойчивый газ значительно тяжелее воздуха:
![]() (воздуха)
= 29 г/моль, а M(HBr)
= 81 г/моль.
(воздуха)
= 29 г/моль, а M(HBr)
= 81 г/моль.
Тяжелый газ будет опускаться на дно цилиндра, вытесняя воздух.
Пример 22. В приборе (рис. 1) был поставлен следующий опыт. В банку был налит раствор гидроксида бария. Из бюретки по каплям прибавляли раствор серной кислоты. По мере прибавления серной кислоты лампа светила все более тускло. Через некоторое время лампа совсем погасла. Почему гаснет лампа? Что будет наблюдаться при дальнейшем прибавлении кислоты? Будут ли наблюдаться те же явления, если серную кислоту заменить соляной?
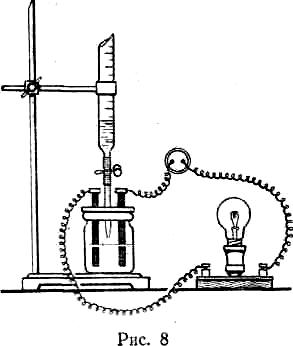
Рис. 1
Решение.
Лампочка будет светить тем ярче, чем больше электропроводность раствора. Электропроводность определяется количеством ионов, содержащихся в растворе. Первоначально в растворе присутствует сильный электролит – гидроксид бария. При добавлении серной кислоты протекает реакция:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O.
В данном процессе образуется малорастворимый сульфат бария и слабый электролит – вода. В результате в растворе значительно уменьшается количество ионов, способных переносить заряд (проводить электрический ток). При достижении точки эквивалентности, когда ν(Ba(OH)2) = ν(H2SO4), количество ионов в растворе уменьшится настолько, что лампочка может совсем погаснуть. Однако при дальнейшем добавлении серной кислоты, являющейся сильным электролитом, концентрация ионов в растворе возрастет, лампочка снова начнет светиться.
При замене серной кислоты соляной подобного не происходит, так как в ходе обменной реакции образуется сильный электролит – хлорид бария (растворимая соль, хорошо диссоциирующая в растворе):
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
Лампочка не будет гаснуть.
