
- •20Федеральное агентство по образованию
- •Введение
- •1 Общая характеристика растворов
- •2 Внутреннее строение растворов
- •3 Процесс растворения. Растворимость. Энергетика процесса растворения
- •4 Концентрации растворов
- •4.7 Расчеты, связанные с взаимным переходом одних форм выражения концентраций в другие
- •4.8 Расчеты, связанные со смешиванием растворов разных концентраций; из сухих солей и воды
- •Общие примеры решения задач при смешивании и разбавлении растворов
- •4.9 Расчеты по уравнениям реакций. Закон эквивалентов
- •5 Диффузия и осмос
- •6 Давление насыщенного пара растворов. Тонометрический закон рауля
- •8 Свойства растворов электролитов. Методы определения стеПени электролитической диссоциации
- •9 Рекомендации для самостоятельной работы, контрольные вопросы и требования к знаниям и умениям
- •9.1. Рекомендации
- •9.2. Вопросы для самоконтроля
- •9.3 Требования к знаниям и умениям
- •10 Задачи и упражнения
- •10.1 Растворимость. Энергетика процесса растворения
- •10.2 Процентная концентрация
- •10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
- •10.4. Моляльная концентрация (моляльность) , мольная доля, титр
- •10.5. Свойства растворов неэлектролитов, зависящие от концентрации частиц
- •10.5.1. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа
- •10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
- •10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
- •10.6 Свойства растворов электролитов. Методы определения степени электролитической диссоциации
- •11 Экспериментальная часть приготовление растворов заданной концентрации
- •Варианты расчетов
- •Библиографический список
- •Содержание
- •Свойства растворов электролитов и неэлектролитов
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
Варианты расчетов
Вариант 1. Приготовить 300 г 10%- ного раствора NaCl из 7%-ного
и 14%-ного растворов NaCl.
Решение: а) расчет произвести по ” правилу креста”:

 14%
(10-7) = 3 весовые части
14%
(10-7) = 3 весовые части
10%

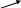 7% (14-10)
= 4 весовые части (вес.ч.)
7% (14-10)
= 4 весовые части (вес.ч.)

Весь раствор = 7 вес.ч.
Таким образом, 300 г 10%-ного раствора NaCl составляют 7 весовых частей.
Найти, какое количество граммов каждого из смешиваемых растворов необходимо взять:
7 вес.ч. - 300 г р-ра
3
вес.ч. – m14% ![]() 14%-ного раствора;
14%-ного раствора;
7 вес.ч. – 300 г р-ра
4
вес.ч. – m7%
![]() 7%-ного раствора;
7%-ного раствора;
б) расчет произвести по закону смешения.
Определить массу NaCl в 300 г 10%-ного раствора:
в 100 г р-ра - 10 г NaCl
в 300 г р-ра – m г NaCl m = 30 г NaCl.
Эта масса растворенного вещества состоит из масс его, содержащихся в исходных растворах.
Пусть масса 14%-ного раствора равна x г,
тогда масса 7%-ного раствора (300-x) г.
Масса NaCl в 14%-ном растворе равна (0,14∙x) г,
Масса NaCl в 7%-ном растворе равна 0,07∙(300-x) г.
Сумма масс NaCl равна 0,14∙x + 0,07∙(300-x) = 30 г.
Следовательно, x = 128,6 г - масса 14%-ного раствора,
300 - 128,6 = 171,4 г – масса 7%-ного раствора.
в) Рассчитать объемы каждого раствора, используя плотности:
![]()
![]()
Итак, необходимо слить 116,8 мл 14%-ного и 163,5 мл 7%-ного растворов NaCl, что в сумме даст: V10% = 116,8 + 163,5 = 280,3 мл раствора.
Вариант 2 Приготовить 300 г 10%-ного раствора из 14%-ного раствора NaCl
и воды.
Решение: а) расчет произвести по ”правилу креста”, концентрацию воды принять равной нулю:
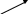
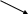 14%
(10-0) = 10 вес.ч.
14%
(10-0) = 10 вес.ч.
10 %
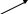
 0
(14-10) = 4 вес.ч.
0
(14-10) = 4 вес.ч.
Весь раствор 14 вес.ч.
Таким образом, 300 г 10%-ного раствора NaCl составляют 14 весовых частей.
Найти, какое количество граммов каждого из смешиваемых растворов необходимо взять:
14 вес.ч. - 300 г р-ра
10
вес.ч. - m14%
![]() 14%-ного раствора;
14%-ного раствора;
14 вес.ч. - 300 г р-ра
4
вес.ч. – mH2O ![]() воды;
воды;
б) расчет произвести по закону смешения.
Определить массу NaCl в 300 г 10%-ного раствора:
в 100 г р-ра – 10 г NaCl
в 300 г р-ра – m г NaCl m = 30 г NaCl
Эта масса растворенного вещества содержится только в исходном 14%-ном растворе.
Пусть масса 14%-ного раствора x г,
тогда масса воды (300-x) г.
Масса NaCl в 14%-ном растворе равна (0,14∙x) г, а в воде NaCl нет.
0,14∙x = 30. Следовательно, x = 214,2 г – масса 14%-ного раствора NaCl.
300 – 214,3 = 85,7 г воды.
в) Рассчитать объемы каждого раствора, используя плотности:
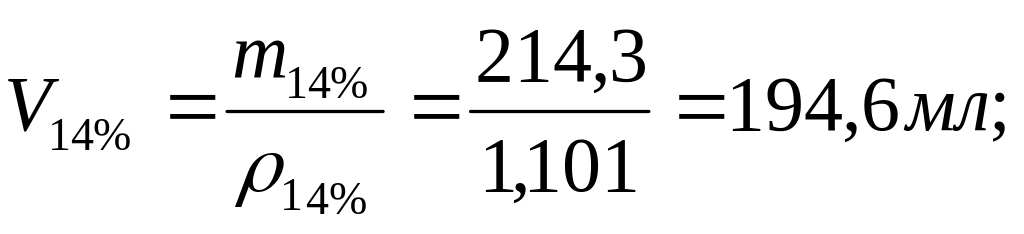
![]()
Итак, необходимо слить 194,6 мл 14%-ного раствора NaCl и 85,7 мл воды, что в сумме даст: V10% = 194,6 + 85,7 = 280,3 мл раствора.
Пример 1. Рассчитать См, Сн, Т, Сm, N 10%-ного раствора NaCl.
Решение:
в 100 г р-ра - 10 г NaCl
в 300 г р-ра - 30 г NaCl,
таким образом масса растворенного NaCl mNaCl = 30 г.
а) расчет молярности раствора
MNaCl = 58,45 г/моль – молярная масса NaCl
![]()
б) расчет молярной концентрации эквивалента раствора
М
![]()
![]()
в) расчет титра раствора
![]()
г) расчет моляльности раствора
![]() - масса растворителя;
- масса растворителя;
![]()
д) расчет мольной доли раствора
![]()
![]()
В 100 г р-ра NaCl содержится 10 г NaCl и 90 г H2O.
Определим число молей соли и воды:
![]()
![]()
Определим мольные доли компонентов раствора:
![]()
![]()
Сумма мольных долей компонентов раствора всегда равна 1:
NNaCl + NH2O = 0,03310 + 0,9669 = 1,0.
Пример 2. Рассчитать ∆р´, t´кип., t´зам., π´осм. 10%-ного раствора NaCl.
Решение: раствор соли NaCl является сильным электролитом, а для сильных электролитов, принимая кажущуюся степень диссоциации равной 1 или 100 % (точно можно вычислить экспериментально), значение изотонического коэффициента i равно 2, т.к. при диссоциации 1-го моля раствора NaCl образуется по 1-му молю ионов Na+ и Cl-.
а) расчет давления насыщенного пара раствора
![]()
где р0 = 1,0133·105 Па
n (NaCl) = 0,1711 моль;
N (Н2О) = 5,0 моль;
Тогда,
![]()
б) расчет температуры кипения раствора
![]()
![]()
в) расчет температуры замерзания раствора
![]()
![]()
г) расчет осмотического давления раствора
![]()
Приложение А
Таблица А1 Варианты заданий для самостоятельной работы
Номер варианта |
Номера задач |
|||||||||
10.1 |
10.2 |
10.3 |
10.4 |
10.5 |
10.6 |
10.7 |
10.8 |
|||
1 |
1 |
1 |
1 |
31 |
1 |
1 |
1 |
1 |
31 |
1 |
2 |
2 |
2 |
2 |
32 |
2 |
2 |
2 |
2 |
32 |
2 |
3 |
3 |
3 |
3 |
33 |
3 |
3 |
3 |
3 |
33 |
3 |
4 |
4 |
4 |
4 |
34 |
4 |
4 |
4 |
4 |
34 |
4 |
5 |
5 |
5 |
5 |
35 |
5 |
5 |
5 |
5 |
35 |
5 |
6 |
6 |
6 |
6 |
36 |
6 |
6 |
6 |
6 |
36 |
6 |
7 |
7 |
7 |
7 |
37 |
7 |
7 |
7 |
7 |
37 |
7 |
8 |
8 |
8 |
8 |
38 |
8 |
8 |
8 |
8 |
38 |
8 |
9 |
9 |
9 |
9 |
39 |
9 |
9 |
9 |
9 |
39 |
9 |
10 |
10 |
10 |
10 |
40 |
10 |
10 |
10 |
10 |
40 |
10 |
11 |
11 |
11 |
11 |
41 |
11 |
11 |
11 |
11 |
41 |
11 |
12 |
12 |
12 |
12 |
42 |
12 |
12 |
12 |
12 |
42 |
12 |
13 |
13 |
13 |
13 |
43 |
13 |
13 |
13 |
13 |
43 |
13 |
14 |
14 |
14 |
14 |
44 |
14 |
14 |
14 |
14 |
44 |
14 |
15 |
15 |
15 |
15 |
45 |
15 |
15 |
15 |
15 |
45 |
15 |
16 |
16 |
16 |
16 |
46 |
16 |
16 |
16 |
16 |
46 |
16 |
17 |
17 |
17 |
17 |
47 |
17 |
17 |
17 |
17 |
47 |
17 |
18 |
18 |
18 |
18 |
48 |
18 |
18 |
18 |
18 |
48 |
18 |
19 |
19 |
19 |
19 |
49 |
19 |
19 |
19 |
19 |
49 |
19 |
20 |
20 |
20 |
20 |
50 |
20 |
20 |
20 |
20 |
50 |
20 |
21 |
21 |
21 |
21 |
51 |
21 |
21 |
21 |
21 |
51 |
21 |
22 |
22 |
22 |
22 |
52 |
22 |
22 |
22 |
22 |
52 |
22 |
23 |
23 |
23 |
23 |
53 |
23 |
23 |
23 |
23 |
53 |
23 |
24 |
24 |
24 |
24 |
54 |
24 |
24 |
24 |
24 |
54 |
24 |
25 |
25 |
25 |
25 |
55 |
25 |
25 |
25 |
25 |
55 |
25 |
26 |
26 |
26 |
26 |
56 |
26 |
26 |
26 |
26 |
56 |
26 |
27 |
27 |
27 |
27 |
57 |
27 |
27 |
27 |
27 |
57 |
27 |
28 |
28 |
28 |
28 |
58 |
28 |
28 |
28 |
28 |
58 |
28 |
29 |
29 |
29 |
29 |
59 |
29 |
29 |
29 |
29 |
59 |
29 |
30 |
30 |
30 |
30 |
60 |
30 |
30 |
30 |
30 |
60 |
30 |
Приложение В
Таблица В1 Растворимость некоторых неорганических соединений в воде
Формула |
Точная формула |
Растворимость безводной соли, г на 100 г воды, при температуре, 0С |
|||||||
20 |
30 |
40 |
50 |
60 |
70 |
80 |
100 |
||
AgNO3 |
- |
222 |
300 |
376 |
445 |
525 |
- |
669 |
952 |
AlCl3 |
6Н2О |
45,9 |
46,6 |
47,3 |
- |
48,1 |
- |
48,6 |
49,0 |
Al(NO3)3 |
9Н2О |
73 |
81 |
89 |
96 |
108 |
120 |
- |
- |
Al2(SO4)3 |
18Н2О |
36,2 |
40,4 |
45,7 |
52,2 |
59,2 |
66,2 |
73,1 |
89,0 |
BaCl2 |
2 Н2О |
35,7 |
38,2 |
40,7 |
43,6 |
46,4 |
49,4 |
52,4 |
58,8 |
Ba(NO3)2 |
Н2О |
67,5 |
- |
101,2 |
- |
141,9 |
- |
205,8 |
300 |
Ca(NO3)2 |
4Н2О |
129,3 |
152,6 |
196 |
- |
- |
- |
- |
- |
CaSO4 |
2Н2О |
- |
0,209 |
0,209 |
0,205 |
- |
0,197 |
- |
0,162 |
CuCl2 |
2Н2О |
72,7 |
77,3 |
80,8 |
84,2 |
87,6 |
92,3 |
96,1 |
110 |
Cu(NO3)2 |
3Н2О |
- |
- |
163,1 |
171,8 |
181,8 |
194,1 |
207,8 |
247,3 |
CuSO4 |
5Н2О |
20,7 |
25,0 |
28,5 |
33,3 |
40,0 |
47,1 |
55,0 |
75,4 |
FeCl2 |
4Н2О |
- |
73,0 |
77,0 |
82,5 |
88,7 |
- |
100 |
- |
FeCl3 |
6Н2О |
91,9 |
106,8 |
- |
- |
- |
- |
- |
- |
Fe(NO3)3 |
6Н2О |
83,0 |
- |
- |
- |
166,6 |
- |
- |
- |
FeSO4 |
7Н2О |
26,5 |
32,9 |
40,2 |
48,6 |
- |
- |
- |
- |
H2S |
- |
0,447 |
0,358 |
0,86 |
- |
- |
- |
- |
- |
K2CO3 |
2Н2О |
110,5 |
113,7 |
116,9 |
121,3 |
126,8 |
133,5 |
139,8 |
155,7 |
KBr |
- |
65,5 |
70,6 |
75,5 |
80,2 |
85,1 |
90,0 |
95,0 |
104 |
KCl |
- |
34,0 |
37,0 |
40,0 |
42,6 |
45,5 |
48,1 |
51,1 |
56,7 |
KNO3 |
- |
31,6 |
45,8 |
63,9 |
85,5 |
110 |
138 |
169 |
246 |
K2SO4 |
- |
11,11 |
12,97 |
64,0 |
- |
83,2 |
- |
106,6 |
- |
MgCl2 |
6 Н2О |
54,5 |
- |
57,5 |
- |
61,0 |
- |
66,0 |
73,0 |
Mg(NO3)2 |
6 Н2О |
70,1 |
74,8 |
78,9 |
84,5 |
91,2 |
- |
106,2 |
- |
MgSO4 |
6 Н2О |
44,5 |
45,4 |
- |
50,4 |
55,0 |
59,0 |
64,2 |
73,9 |
NH4Cl |
- |
37,2 |
41,4 |
45,8 |
50,4 |
55,2 |
60,2 |
65,6 |
77,3 |
NH4NO3 |
- |
193 |
242 |
294 |
344 |
421 |
499 |
580 |
971 |
(NH4)2SO4 |
- |
75,4 |
78,0 |
81,0 |
- |
88,0 |
- |
95,3 |
103,3 |
Na2CO3 |
Н2О |
- |
50,5 |
48,5 |
- |
46,4 |
46,2 |
45,8 |
45,5 |
NaCl |
- |
36,0 |
36,3 |
36,6 |
37,0 |
37,3 |
37,8 |
38,4 |
39,8 |
NaNO3 |
- |
88 |
96 |
104 |
114 |
124 |
- |
148 |
180 |
Na2SO4 |
- |
- |
50,4 |
48,8 |
46,7 |
45,3 |
44,1 |
43,7 |
42,5 |
Примечание - Количество кристаллизационной воды в твердой фазе, находящейся в равновесии с насыщенным раствором. |
|||||||||
Продолжение таблицы Б.1
Таблица Б.2 ЭБУЛИОСКОПИЧЕСКИЕ КОНСТАНТЫ НЕКОТОРЫХ
РАСТВОРИТЕЛЕЙ (Э)
Растворитель |
tкип., 0С |
Э |
Растворитель |
tкип.,0С |
Э |
Анилин |
184,4 |
3,69 |
Серы двуокись |
-10,0 |
1,45 |
Ацетон |
56,0 |
1,5 |
Уксусная кислота |
118,4 |
3,1 |
Бензол |
80,2 |
2,57 |
Фенол |
181,2 |
3,6 |
Вода |
100,0 |
0,516 |
Хлороформ |
61,2 |
3,88 |
Диэтиловый эфир |
34,5 |
~2,0 |
Четыреххлористый углерод |
76,7 |
5,3 |
Метилацетат |
57,0 |
2,06 |
Этилацетат |
77,2 |
2,79 |
Метиловый спирт |
64,7 |
0,84 |
Этилен бромистый |
131,5 |
6,43 |
Нитробензол |
210,9 |
5,27 |
Этиловый спирт |
78,3 |
~1,0 |
Пиридин |
115,4 |
2,69 |
|
|
|
Сероуглерод |
46,3 |
2,29 |
|
|
|
Примечания Э – эбулиоскопическая константа (молярное повышение точки кипения раствора); tкип. – точка кипения чистого растворителя, °С |
|||||
Таблица Б.3 Криоскопические константы Некоторых
растворителей (Ккр.)
Растворитель |
tзам., °С |
Ккр. |
Растворитель |
tзам., °С |
Ккр. |
Анилин |
-6 |
5,87 |
Серная кислота |
10,5 |
6,17 |
Бензол |
5,5 |
5,1 |
n - Толуидин |
43 |
5,2 |
Вода |
0 |
1,85 |
Уксусная кислота |
16,65 |
3,9 |
1,4 – Диоксан |
12 |
4,7 |
Фенол |
41 |
7,3 |
Камфора |
178,4 |
39,7 |
Циклогексан |
6,5 |
20,2 |
n- Ксилол |
13,2 |
4,3 |
Четыреххлористый углерод |
-23 |
29,8 |
Муравьиная кислота |
8,4 |
2,77 |
Этилен бромистый: |
|
|
Нафталин |
80,1 |
6,9 |
сухой |
9,98 |
12,5 |
Нитробензол |
5,7 |
6,9 |
влажный |
8,0 |
11,8 |
Пиридин |
-42 |
4,97 |
|
|
|
Примечания Ккр. –криоскопическая константа (молярное понижение точки кристаллизации раствора); tзам. – точка замерзания чистого растворителя, °С. |
|||||
