
- •Методические указания для студента
- •Лабораторная работа Кб
- •Тема занятия
- •Квантовая биофизика
- •Цели и задачи
- •Основные понятия
- •Вопросы к занятию
- •Методические указания к работе (рекомендации) Изучить вопросы теории:
- •1. Что такое квантовая биофизика? Что такое фотобиологический процесс? Основные стадии фотобиологического процесса.
- •2. Возбуждение молекулы. Условия поглощения квантов света молекулой. Структура электронных уровней в молекулах. Полная энергия молекулы.
- •3. Спектры поглощения атомов и молекул и их интерпретация.
- •4. Пути растраты молекулой энергии поглощенного кванта. Флуоресценция. Фосфоресценция. Правило Стокса-Левшина. Механизм миграции энергии.
- •5. Первичные и вторичные фотохимические реакции.
- •6. Классификация фотобиологических процессов.
- •9. Информационно-биологические процессы.
- •Вопросы для самоконтроля
- •Основная литература
- •Дополнительная литература
3. Спектры поглощения атомов и молекул и их интерпретация.
a. Спектры поглощения атомов и их интерпретация.
b. Спектры поглощения молекул и их интерпретация.
3a. Спектры поглощения атомов и их интерпретация.
Под спектром поглощения в квантовой биофизике понимают график зависимости вероятности поглощения p от длины волны L (смотри рис.6b).

Ввиду того, что структура уровней в атомах очень проста (смотри рис.6a) и, в нашем примере, содержит всего два возбужденных уровня S1* и S2*, то и спектр поглощения имеет только две линии поглощения - A и B.
Интерпретация такого спектра тоже очень проста: линия A соответствует переходу электрона с орбитали S0 на орбиталь S2*, а линия B - с орбитали S0 на орбиталь S1*. Объясняется это тем, что энергия кванта обратно пропорциональна длине волны: E=hc/L.
Рассматривая спектр поглощения мы должны прийти к выводу, что вероятность поглощения квантов с длиной волны B больше, чем A.
3b. Спектры поглощения молекул и их интерпретация.

Ввиду того, что структура электронных орбиталей в молекулах гораздо сложнее, чем в атомах, то и спектр поглощения получается сложнее и внешне кажется нам сплошным. Детальное изучение такого спектра показывает, что он является дискретным, т.е. состоит из отдельных линий поглощения близко расположенных друг к другу. Каждой такой линии соответствует какой-то подуровень первого или второго порядка.
Интерпретация спектра несколько сложнее, чем атомарного. Если на спектре имеются далеко отстоящие друг от друга максимумы поглощения(в нашем примере это максимумы A и B), то это говорит о том, что в этой молекуле имеются две синглетных возбужденных орбитали S1* и S2*. Максимуму A соответствует переход электрона на орбиталь S2*, а максимуму B - на орбиталь S1*.
Примечание: если не понятно, почему так происходит, вернись к предыдущему пункту.
4. Пути растраты молекулой энергии поглощенного кванта. Флуоресценция. Фосфоресценция. Правило Стокса-Левшина. Механизм миграции энергии.
a. Пути растраты молекулой энергии поглощенного кванта. Флуоресценция. Фосфоресценция.
b. Правила Стокса-Левшина.
c. Механизм миграции энергии.
4a. Пути растраты молекулой энергии поглощенного кванта. Флуоресценция. Фосфоресценция.
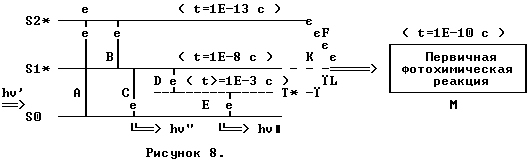
При поглощении кванта света hv' в молекуле происходит переход электрона (A на рисунке ) с орбитали S0 на орбиталь S2*, молекула переходит в синглетное возбужденное состояние (в нашем примере в синглетное состояние S2*). На этой орбитали электрон задерживается t=1E-13 секунды. Через такое короткое время электрон, независимо от того, где он находится (на орбитали S2*, S3* или S4*, если такие орбитали в этой молекуле есть!) спустится (B) на самую нижнюю возбужденную орбиталь S1*, при этом разность энергий ∆E = E2 - E1 растрачивается в тепло.
На орбитали S1* электрон задерживается на 5 порядков дольше - t=1E-8c, все это время молекула находится в синглетном возбужденном состоянии S1*. По истечении такого времени электрон может спуститься на орбиталь S0, при этом вся энергия ∆E = E1 - E0 растрачивается в тепло (безызлучательный переход), возможно сопровождение такого перехода (С) испусканием кванта света hv". Такой электронный переход с орбитали S1* на орбиталь S0 с испусканием кванта hv (S1* ══> S0 + hv) называется флуоресценцией (hv").
В ряде случаев события развиваются несколько иначе: электрон, находящийся на орбитали S1*, переходит на так называемую триплетную орбиталь. Название "триплетная" происходит от "triplet" (англ.), что означает - "тройка". Электроны, находящиеся на триплетных орбиталях (T на рисунке 8), не спарены и их спины могут быть направлены в одну сторону, т.е. параллельны или в разные, т.е. антипараллельны. Таким образом, спиновый момент триплетной орбитали может иметь три (триплет) значения +1, 0 или -1.
Для перехода электрона с S1* на T* необходимо затратить энергию, равную разнице энергий между орбиталями S1* и T*, эта энергия идет на оборачивание спина электрона. На орбитали T* электрон задерживается очень долго - от 1 миллисекунды до нескольких часов и даже суток. Все это время молекула находится в триплетном возбужденном состоянии.
По истечении этого времени электрон может спуститься (Е на рисунке 8) на основной синглетный уровень S0 и, если этот переход сопровождается испусканием кванта hv■, то произойдет фосфоресценция (T* => S0 + hv).
Все описанные ранее способы растраты энергии поглощенного кванта, с точки зрения квантовой биофизики, являются бесполезными, т.к. при этом фотобиологический процесс не состоится. Основным способом растраты энергии поглощенного кванта является первичная фотохимическая реакция.
4b. Правила Стокса-Левшина.

График зависимости интенсивности флуоресценции (вероятности переходов S1 => S0 с испусканием кванта света hv") называется спектром флуоресценции.
Спектр флуоресценции несет информацию о структуре основного синглетного уровня S0. Он зеркально симметричен спектру поглощения (правило Левшина). Объясняется это тем, что структура подуровней синглетных уровней S2, S1 и S0 в молекуле идентична.
Спектр флуоресценции сдвинут в длинноволновую область по сравнении со спектром поглощения (правило Стокса). Объясняется это тем, что часть энергии E2 поглощенного кванта hv' растрачивается в тепло, поэтому энергия E3 кванта флуоресценции hv" меньше чем E1, а значит длина волны кванта флуоресценции больше, чем поглощенного кванта.
Примечание: если не понятно, почему так происходит вернись к предыдущему пункту.
График зависимости интенсивности фосфоресценции (вероятности переходов Т1 => S0 с испусканием кванта света hv■) называется спектром фосфоресценции.
Спектр фосфоресценции еще дальше сдвинут в длинноволновую область, т.к. часть энергии E4 идет на оборачивание спина электрона. Он тоже симметрично идентичен спектру поглощения. Эти явления тоже входят в правила Левшина - Стокса.
4c. Механизм миграции энергии.
В биологических системах вероятность вступления молекулы в фотохимическую реакцию близка к единице, что, в первую очередь, связано с тем, что очень часто имеет место миграция энергии. Механизм миграции энергии можно представить следующим образом (смотри рисунок 10).

Молекула A поглотив квант света hv' переходит в возбужденное синглетное состояние S2* а затем передает энергию поглощенного кванта (донор) в виде электрона на эквипотенциальную орбиталь S1* молекулы B, которая выступает в роли акцептора. Получив избыток энергии, молекула B может вступить в химическую реакцию с какой-то другой молекулой, с которой без этого избытка энергии взаимодействовать не могла, или передаст электрон с помощью миграции энергии другой молекуле.
Такой способ безизлучательной передачи энергии на расстояния, значительно превышающие межатомные и происходящие без растраты на тепловые колебания и без кинетических соударений донора и акцептора в виде электрона на эквипотенциальную орбиталь называется миграцией энергии.
Для осуществления миграции энергии необходимы следующие условия:
а) спектр флуоресценции молекулы донора должен перекрываться со спектром поглощения молекулы акцептора (смотри рисунок 10b), чем больше зона перекрытия (X - на рисунке 10b), тем больше вероятность миграции энергии (свидетельство наличия эквипотенциальных орбиталей у донора и акцептора);
b) расстояние между молекулами должно быть не более 10 нанометров (это достаточно много, т.к. обычная химическая реакция может протекать если расстояние между молекулами не более 0.1 нм), вероятность миграции энергии резко возрастает при сближении молекул.
При уменьшении расстояния между молекулами в два раза вероятность миграции увеличивается в 64 раза!
Фотохимические реакции являются, с точки зрения квантовой биофизики, полезной тратой энергии поглощенного кванта света, т.к. только при таком исходе состоится фотобиологический процесс. Различают первичные и вторичные фотохимические реакции.
