
- •Назарбаев Интеллектуальная школа физико-математического направления г. Кокшетау Суммативная контрольная работа по химии за 2 четверть 2012 - 2013 учебного года
- •9 Класс
- •Назарбаев Интеллектуальная школа физико-математического направления г. Кокшетау Суммативная контрольная работа по химии за 2 четверть 201202013 учебного года
- •9 Класс
Назарбаев Интеллектуальная школа физико-математического направления г. Кокшетау Суммативная контрольная работа по химии за 2 четверть 2012 - 2013 учебного года
9 Класс
Ф.И. учащегося__________________________________ класс________________________________
Реакции, которые протекают в однородной среде
Гетерогенные
Гомофазные
Гомогенные
Гетерофазные
Скорость гетерогенной химической реакции определяется по формуле:
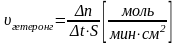

 b)
b)

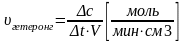
c) d)
Скорость гомогенной химической реакции определяется
изменением количества вещества в единицу времени.
изменением концентрации вещества в единицу времени
изменением объема вещества в единицу времени
изменением массы вещества в единицу времени
При повышении температуры скорость большинства химических реакций:
Повышается
Понижается
Остается неизменной
Нет правильного ответа
При повышении температуры на каждые 10оС
Скорость химической реакции падает в 2-4 раза
Скорость реакции увеличивается в 2-4 раза
Скорость реакции падает в 10 раз
Скорость реакции увеличивается в 10 раз
Состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем, называют
статичным
обратимым
химическим равновесием
необратимым
Согласно принципу Ле-Шателье
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, химическое равновесие сместится в сторону процесса, ослабляющего это воздействие.
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, химическое равновесие сместится в сторону процесса, усиливающего это воздействие.
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, химическое равновесие останется неизменным.
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, химическое равновесие сместится в сторону процесса, процесс станет необратимым
Соль, имеющая формулу Na2S, образована
Сильным основанием и сильной кислотой
Слабым основанием и сильной кислотой
Сильным основанием и слабой кислотой
Слабым основанием и слабой кислотой
Не подвергается гидролизу соль, имеющая формулу
AlCl3
Na2SO4
K2CO3
Na2SiO3
В растворе сульфата алюминия лакмус окрасится
В красный цвет
В синий цвет
В оранжевый цвет
Цвет лакмуса не изменится
Обратимой является реакция:
NaOH + HCl → NaCl + H2O
BaCl2 + H2SO4 → 2HCl + BaSO4
SO3 + H2O → H2SO3
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
При повышении давления в системе N2(г) + H2(г) + 2 C(т) 2 HCN(г)
Химическое равновесие сместится в сторону прямой реакции
Химическое равновесие сместиться в сторону обратной реакции
Повышение давления не повлияет на смещение химического равновесия
Верного ответа нет
Для реакции Cu2O(т) + 2 HCl(г) ↔ CuCl(ж) + H2O(г) добавление в систему хлороводорода сместит химическое равновесие
В прямом направлении
В обратном направлении
Не повлияет на смещение равновесия
Нет правильного ответа
Повышение температуры в системе СО2(г) + Н2(г) ↔ СО(г) + Н2О(г) - Q;
Не повлияет на смещение химического равновесия
Сместит химическое равновесие в сторону прямой реакции
Сместит химическое равновесие в сторону обратной реакции
Приведет к необратимости химической реакции
Для того, чтобы сместить химическое равновесие в системе 2NO(г) + O2 (г) = 2NO2 (г) + Q в сторону прямой реакции, необходимо
_________________ температуру
_________________ концентрацию реагирующих веществ
_________________ давление
Температурный коэффициент реакции 2СО(г) → СО2 (г) + С(т) равен 2. Для того, чтобы увеличить скорость реакции в 32 раза, необходимо повысит температуру на _____оС.
Химическая реакция протекает в растворе согласно уравнению А+В→С. Исходные концентрации: А-0,8 моль/л, В-1,0 моль/л.
Через 20 минут концентрация вещества А снизилась до 0,74 моль/л. Определите:
А) среднюю скорость реакции
Б) концентрацию вещества В через 20 минут
Какие из солей, формулы которых приведены ниже подвергаются гидролизу? Составьте уравнения гидролиза в молекулярном, полном и сокращенном ионном виде, укажите среду раствора. KCl, Na2CO3, AlCl3, Na2SO4
Сформулируйте определение принципа Ле-Шателье. Для реакций: N2(г)+3Н2(г )→ 2NH3(г)+ Q;
СaCO3(т) → CaO(т) + CO2(г) – Q Определите смещение химического равновесия
При повышении температуры
При повышении давления
Объясните принятое Вами решение
|
Определите скорость химической реакции при температуре 60оС, если при 20 оС скорость данной реакции 0,02 моль/л*с, а температурный коэффициент равен 2.
|
Как изменится скорость реакции 2SО2 (г) + O2 (г) = 2SO3 (г) при увеличении давления в системе в 2 раза?
