
- •Пособие для подготовки к 1-ой контрольной работе по теме «Алифатические углеводороды»
- •Теория химического строения органических веществ а.М.Бутлерова.
- •Классификация органических соединений и реакций.
- •Основные понятия в органической химии.
- •Алифатические углеводороды. Предельные или насыщенные углеводороды (алканы, парафины).
- •Названия радикалов
- •Способы получения алканов.
- •Химические свойства алканов.
- •Способы получения алкенов
- •Химические свойства
- •Гидрогалогенирование (присоединение галогенводородов)
- •3. Гидрогалогенирование. Перекисный эффект Караша.
- •5. Окисление
- •6. Полимеризация
- •Химические свойства.
- •Алкины (ацетиленовые, непредельные)
- •Химические свойства.
Названия радикалов
-
Структура радикала
Название радикала
-CH3
Метил
-CH2-CH3
Этил
-CH2-CH2-CH3
Пропил

Изопропил
-CH2-CH2-CH2-CH3
Бутил
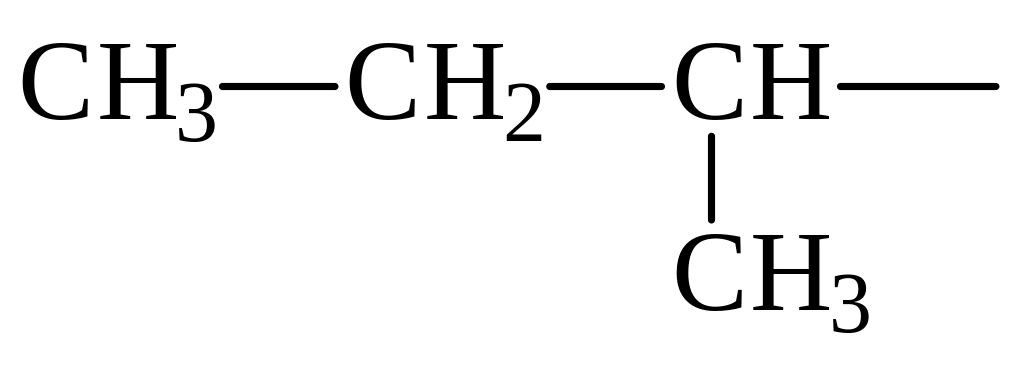
Втор.бутил

Изобутил

Трет.бутил
Еще могут понадобиться заместители, содержащие двой ную связь:
CH2=CH-
Винил
CH2=CH-CH2-
Аллил
Систематическая номенклатура
1. Выбираем самую длинную углеродсодержащую цепь – главную цепь
2. Нумеруем эту цепь так, чтобы радикалы получили наименьшие номера.
3. В случае одинаковых радикалов используем умножающие приставки (ди – 2, три -3, тетра – 4, пента – 5 и т.д.).
4. Называем радикалы и цифрой указываем их местоположение в главной цепи. Записываем радикалы в алфавитном порядке.
5. Называем главную цепь, в соответствии с количеством углеродных атомов составляющих главную цепь.

2,2,4-триметилпентан
Рациональная номенклатура.
В этом случае все углеводороды называют от родоначальника ряда алканов метана, окружающие его атомы заменяют радикалами.

Способы получения алканов.
А. Промышленные методы.
Химическая переработка каменного угля ( 1930г.)
2. Каталитическое гидрирование оксида углерода (открыта в 1925 г. в институте Фишера, Германия). Синтез Фишера-Тропша
Б. Синтетические методы – для получения индивидуальных алканов.
Гидрирование непредельных углеводородов – алкенов
![]()
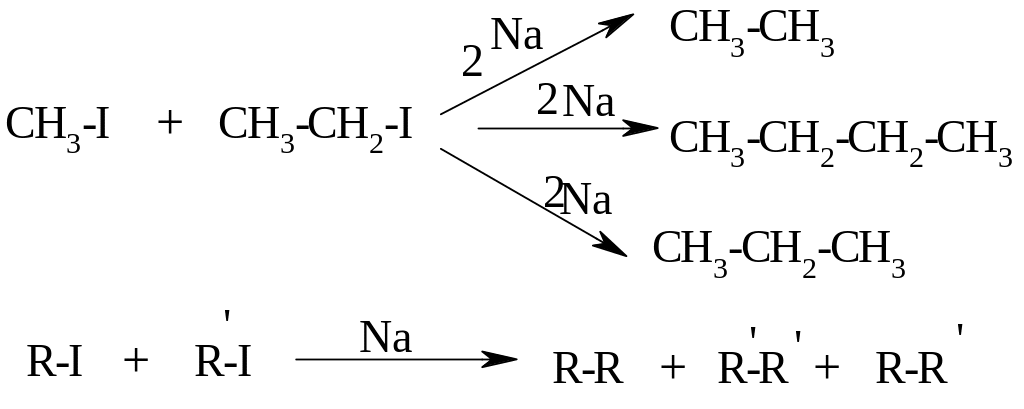
Реакция Вюрца (1855 г).
![]()
Если в реакцию Вюрца вводят два различных галогенпроизводных, то образуется смесь 3-х углеводородов
3. Декарбоксилирование (отщепление СО2) солей карбоновых кислот
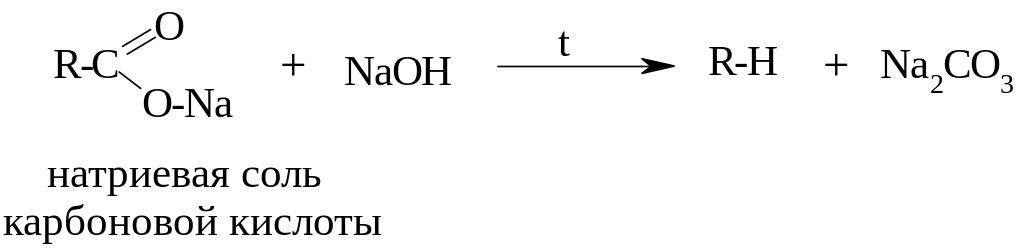
- образуется углеводород, в котором меньше на один атом углерода, чем в исходной молекуле карбоновой кислоты
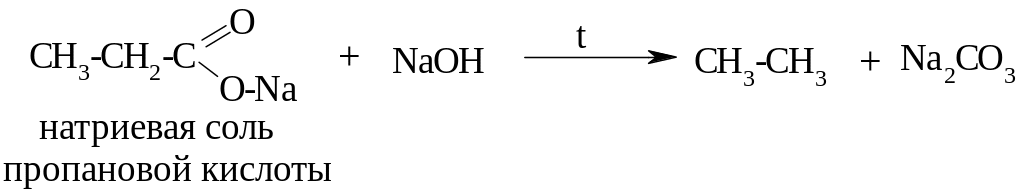
Химические свойства алканов.
Раньше алканы носили название парафины в переводе с лат. parum affinis – “малое сродство”. Они проявляют при обычных условиях чрезвычайно высокую химическую инертность – не взаимодействуют с ионными реагентами (кислоты, щелочи), окислителями, активными металлами.
Галогенирование (действие галогенов)
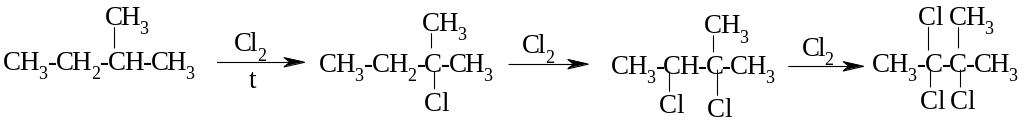
Нитрование – замещение атома Н на NO2-группу (действие HNO3). В 1888 г.М.Н. Коновалов предложил реакцию взаимодействия алканов с разб. HNO3.

Сульфохлорирование и сульфоокисление (SO2 + Cl2) или (SO2 + O2).

Дегидрирование (отщепление Н2). Реакция протекает с разрывом связи С-Н).
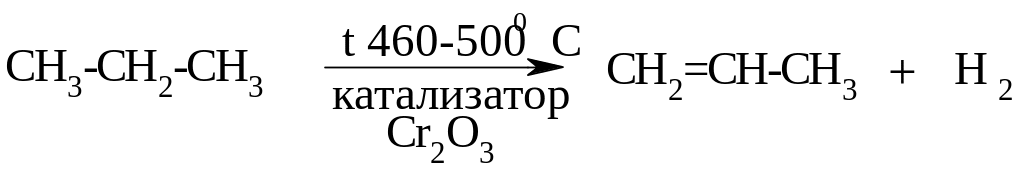
Окисление
а) при 20 0С устойчивы к действию обычных окислителей KMnO4, K2Cr2O7.
б) при высокой температуре происходит сгорание.

в) окисление при средних температурах 110-130 0С в жидкой и паровой фазе, окислителем является О2 воздуха в присутствии катализаторов (MnO2), проходит через ряд промежуточных стадий, в результате образуются кислоты
Крекинг – реакции разрыва С-С-связи при высоких температурах (термическое разложение алканов)

Сопровождается гомолитическим разрывом связи. Наибольшей термической устойчивостью обладает метан (до 800 0С) с ростом длины и увеличением разветвленности углеродной цепи термическая устойчивость снижается.
Алкены
(непредельные, ненасыщенные, этиленовые, олефины)
Алкены (этиленовые углеводороды) - алифатические непредельные углеводороды, в молекулах которых атомы углерода связаны двойной связью. Двойная связь в алкенах хотя и изображается двумя одинаковыми черточками, однако представляет собой комбинацию из двух связей – одной σ- и одной π-связи.
По систематической номенклатуре названия алкеновых углеводородов производят от названий соответствующих алканов, заменяя суффикс –ан на –ен.
По рациональной номенклатуре названия алкенам дают от родоначальника ряда этилена, представляя, что атомы водорода замещены на радикалы. Записывая название соединения, радикалы располагают по старшинству (на основании молекулярной массы).
В случае одного или двух заместителей местоположение указывают приставкой симм-или несимм-.
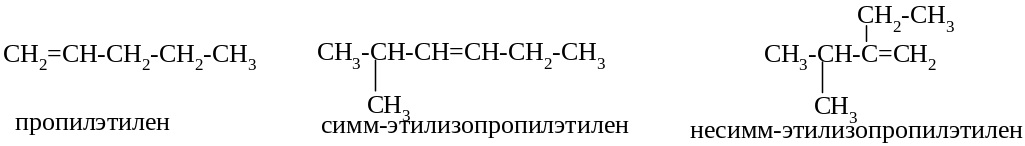
В случае трех или четырех заместителей местоположение радикалов указывают буквенной нумерацией α- и β-.
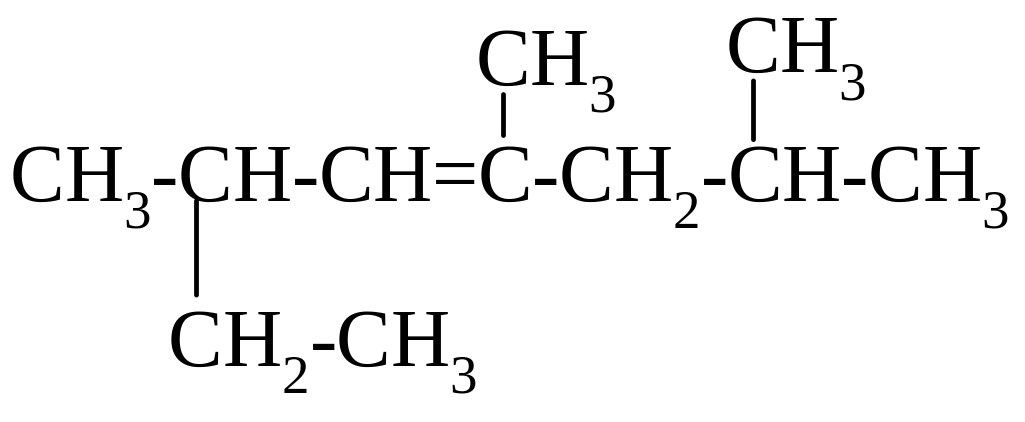
α-метил-α-изобутил-β-втор-бутилэтилен.
Первые члены гомологического ряда алкенов этилен С2Н4 и пропилен С3Н6 изомеров не имеют. Для алкенов возможны два типа структурной изомерии:
структурная
- по положению двойной связи
- изомерия углеродной цепи
межклассовая
пространственная (геометрическая)
